Peças cultivadas no laboratório
Criar um membro em falta não é grande coisa – para uma estrela do mar ou salamandra, criaturas que são bem conhecidas por usar “superpoderes” regenerativos para substituir braços e caudas em falta. Mas eles não são os únicos animais que podem reconstruir partes do corpo que são destruídas ou danificadas. Os veados podem voltar a brotar até 66 libras. (30 quilos) de chifres em apenas três meses. Os Zebrafish podem rebrotar os seus corações, enquanto os vermes planos demonstraram que podem regenerar as suas próprias cabeças.
Para os humanos, no entanto, o que se perde é perdido – ou é?
Células individuais no seu corpo estão constantemente a ser substituídas à medida que se desgastam, um processo que abranda com o envelhecimento mas que continua durante toda a vida humana. Você pode até observar esta regeneração frequente e visível em um dos seus órgãos: a sua pele. Na verdade, os humanos derramam toda a sua camada externa de pele a cada duas a quatro semanas, perdendo cerca de 510 gramas de células da pele por ano, de acordo com a American Chemical Society.
No entanto, a regeneração de órgãos e partes completas do corpo, uma prática comum entre os Senhores do Tempo do “Doutor que é o Doutor”, está além do escopo da biologia humana. Mas nos últimos anos, os cientistas cultivaram com sucesso uma série de estruturas do corpo humano, estruturas similares que foram testadas com sucesso em animais, e órgãos humanos de pequena escala conhecidos como “organóides”, que são usados para estudar a função e estrutura dos órgãos humanos em um nível de detalhe que anteriormente era impossível. Aqui estão alguns exemplos recentes:
Trompa de Falópio
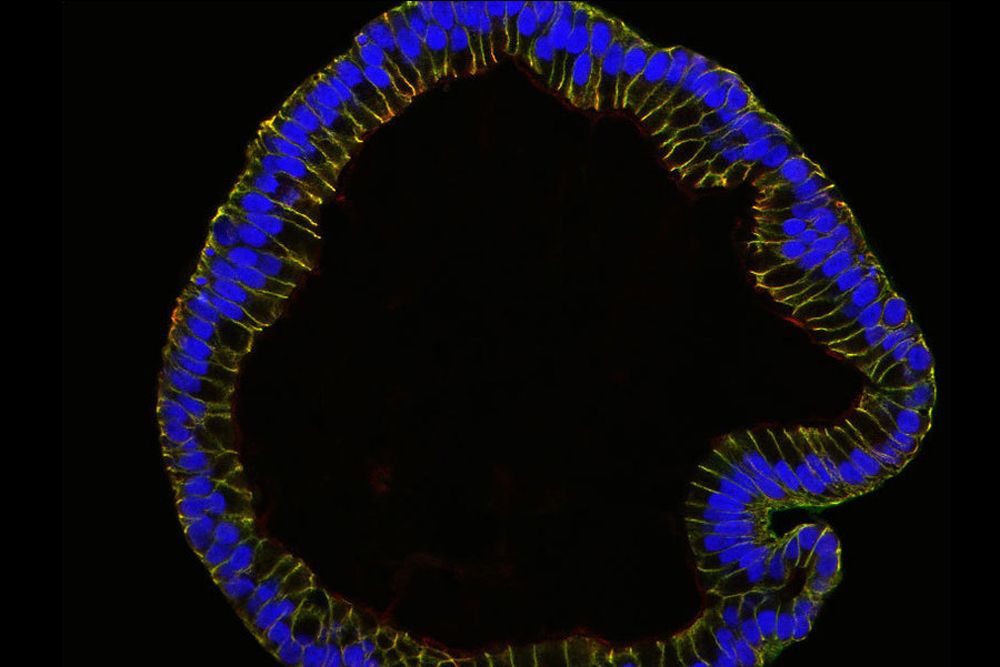
Utilizando células estaminais, os cientistas do Instituto Max Planck de Biologia da Infecção em Berlim cultivaram a camada celular mais interna das trompas de falópio humanas, as estruturas que ligam os ovários e o útero. Em uma declaração divulgada em 11 de janeiro, os pesquisadores descrevem os organóides resultantes como compartilhando as características e formas que são particulares às trompas de falópio de tamanho normal.
Minibrain
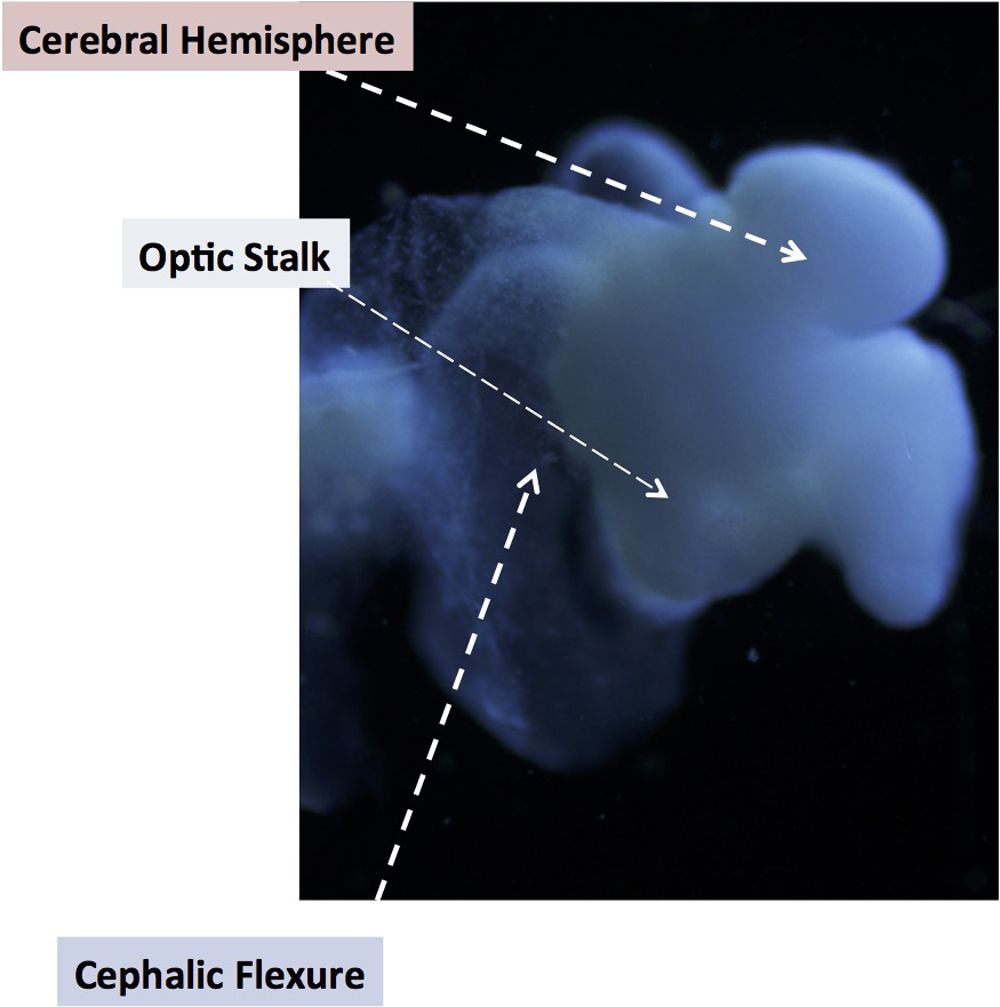
Um cérebro de laboratório do tamanho de uma borracha de lápis foi cultivado a partir de células da pele por cientistas da The Ohio State University (OSU), e é estrutural e geneticamente semelhante ao cérebro de um feto humano de 5 semanas. Descrito como “um alterador cerebral” por representantes da OSU em uma declaração de 18 de agosto, o organóide tem neurônios funcionais com extensões portadoras de sinal como axônios e dendritos. Na foto do mini-cérebro, os rótulos identificam estruturas que são tipicamente encontradas em um cérebro fetal.
Mini coração
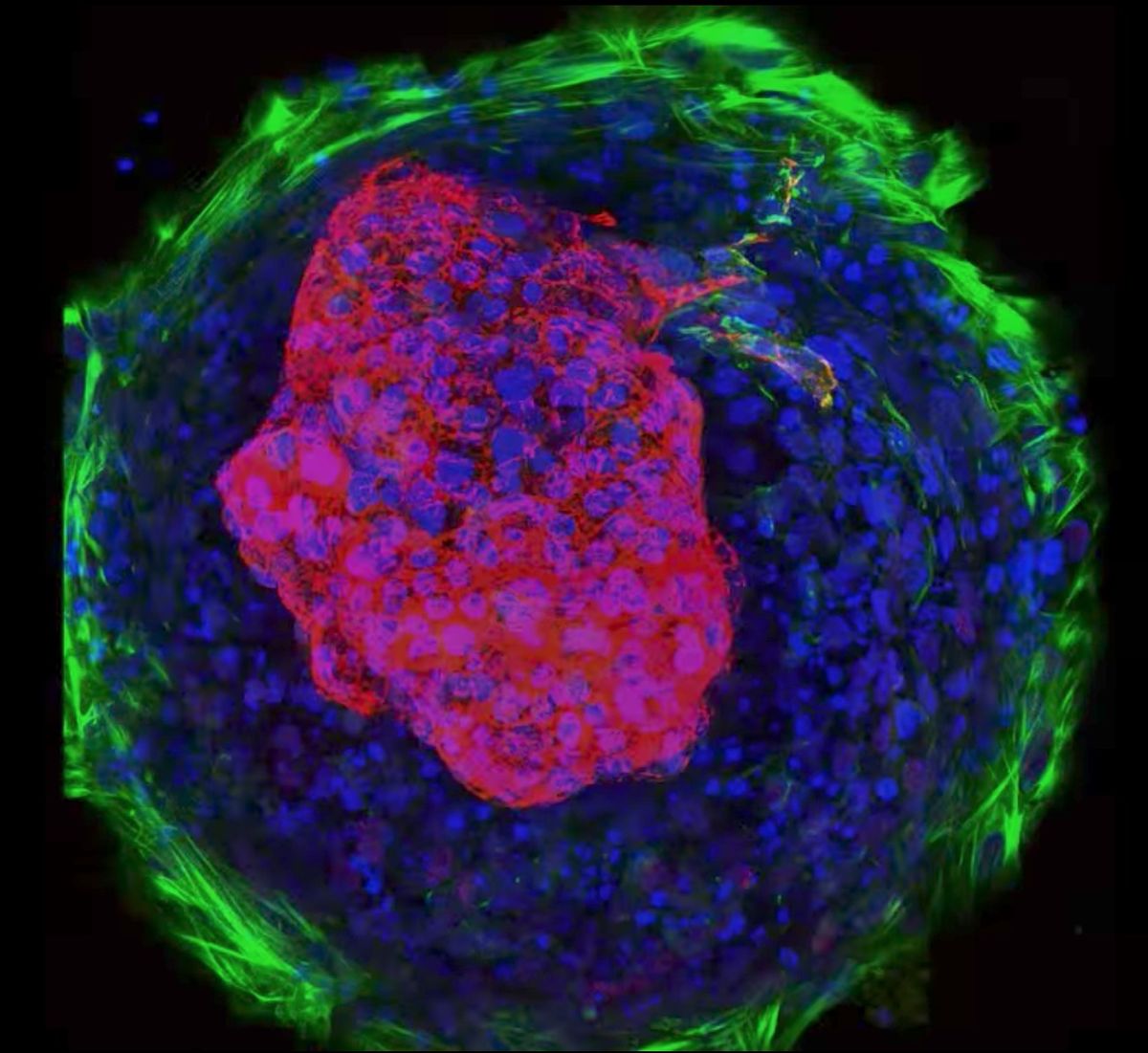
Pesquisadores incitaram as células-tronco a se desenvolverem em músculo cardíaco e tecido conjuntivo, e então se organizarem em minúsculas câmaras e “batimentos”. Em um vídeo da realização, as células do músculo cardíaco (indicadas pelo vermelho no centro) estão batendo enquanto o tecido conjuntivo (anel verde) fixa o mini coração ao prato onde ele cresceu. Kevin Healy, um professor de bioengenharia da Universidade da Califórnia, Berkeley, e co-autor do estudo, disse em uma declaração. “Essa tecnologia pode nos ajudar a selecionar rapidamente os medicamentos susceptíveis de gerar defeitos cardíacos de nascença e orientar as decisões sobre quais medicamentos são perigosos durante a gravidez”. A pesquisa foi publicada em março de 2015 na revista Nature Communications
Minikidney
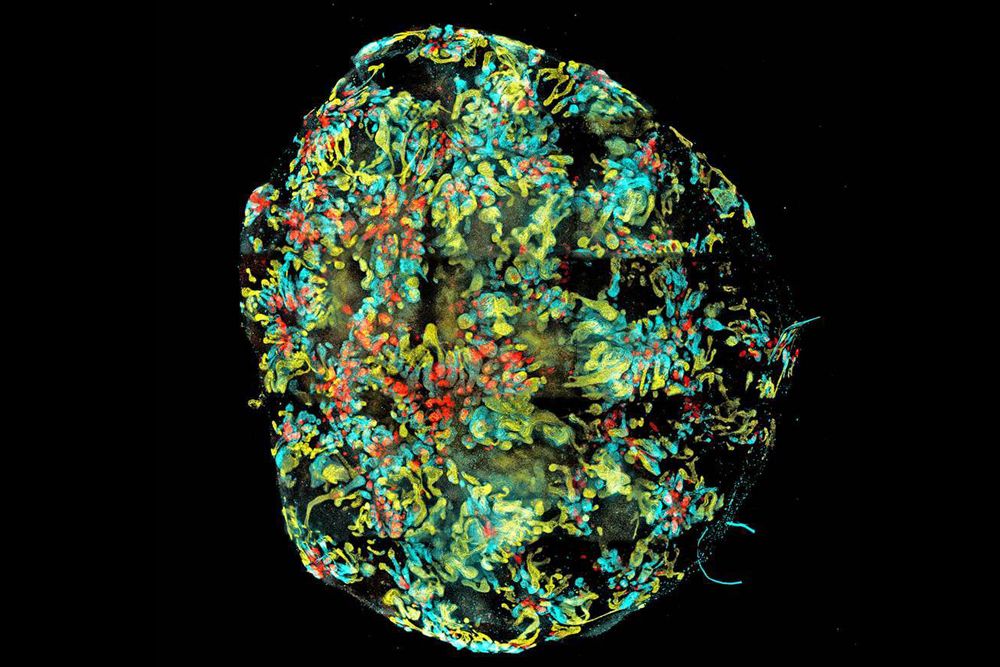
Uma equipe de cientistas australianos cultivou um minikidney, diferenciando células-tronco para formar um órgão com os três tipos distintos de células renais pela primeira vez. Os investigadores cultivaram o organóide num processo que seguiu o desenvolvimento normal dos rins. Na imagem, as três cores representam os tipos de células renais que formam “nefrónios”, as diferentes estruturas dentro do rim.
Minilung
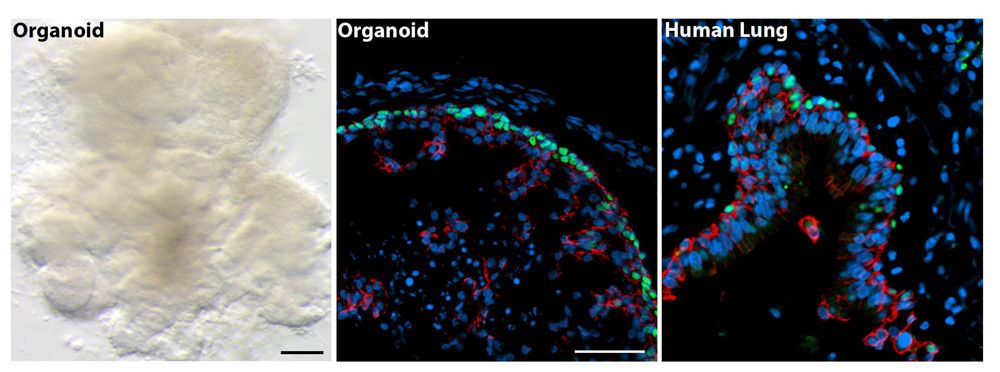
Pesquisadores de várias instituições colaboraram para o crescimento de organóides pulmonares 3D que desenvolveram os brônquios, ou estruturas de vias aéreas, e sacos pulmonares. “Estes minilungos podem imitar as respostas dos tecidos reais e serão um bom modelo para estudar como os órgãos formam mudanças com a doença, e como eles podem responder a novos medicamentos”, disse Jason R. Spence, autor de estudo sênior e professor assistente de medicina interna e biologia celular e do desenvolvimento na Faculdade de Medicina da Universidade de Michigan, em uma declaração. Os minilungos sobreviveram no laboratório por mais de 100 dias.
Ministomach
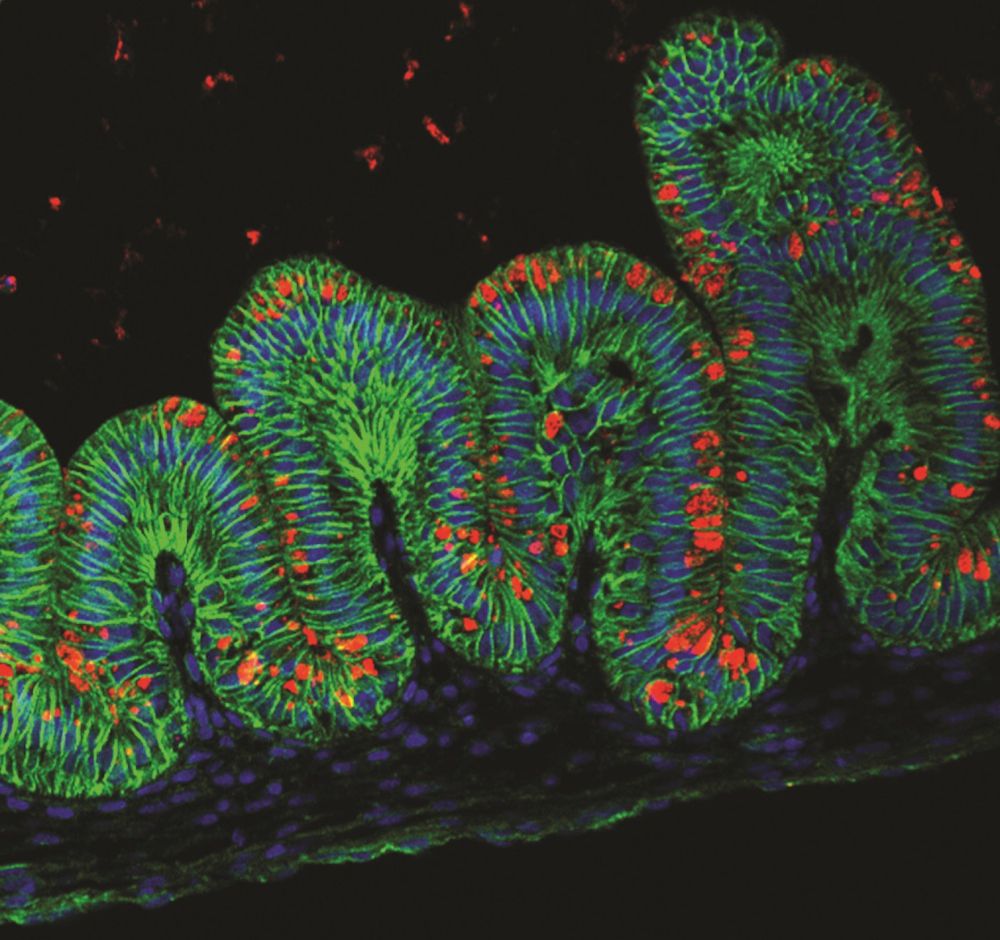
Ministomaches que levaram cerca de um mês para serem cultivados em uma placa petri formada por “estruturas ocas e ovais”, parecidas com uma das duas seções do estômago, disse Jim Wells, co-autor do estudo e professor de biologia do desenvolvimento no Centro Médico do Hospital Infantil de Cincinnati. Wells disse à Live Science que os pequenos estômagos, que mediam cerca de 0,1 polegadas (3 milímetros) de diâmetro, seriam especialmente úteis para os cientistas que estudam os efeitos de uma certa bactéria que causa doenças gástricas. Isto porque a bactéria se comporta de forma diferente em sujeitos animais, disse ele.
Vagina
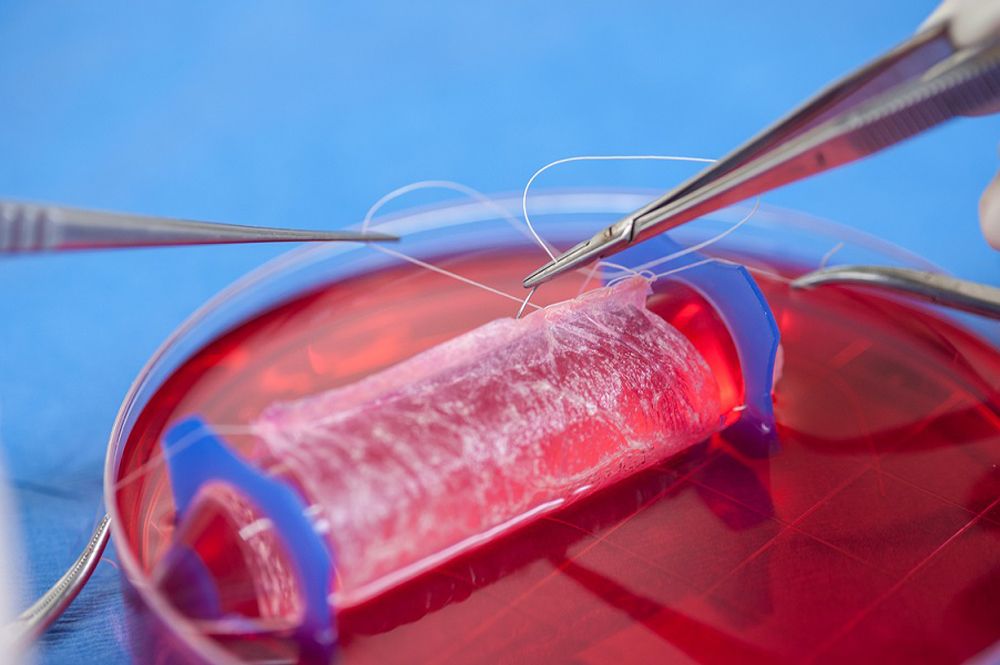
Em abril de 2014, um estudo publicado na revista The Lancet descreveu os transplantes bem sucedidos de vaginas cultivadas em laboratório, criadas ao nutrir as células das pacientes em um andaime em forma de vagina. Os transplantes, realizados vários anos antes em quatro meninas e mulheres jovens entre 13 e 18 anos de idade, corrigiram um defeito congênito no qual a vagina e o útero estavam ausentes ou subdesenvolvidos. As adolescentes foram examinadas anualmente durante oito anos após os transplantes, período durante o qual os órgãos funcionaram normalmente, permitindo uma relação sexual sem dor.
Penis

Cientistas do Wake Forest Institute for Regenerative Medicine utilizaram células de coelho para o crescimento do tecido erétil do pênis, transplantando os pênis cultivados em laboratório para coelhos machos, que depois acasalaram com sucesso. Mas o processo ainda está em fase experimental, e a aprovação da US Food and Drug Administration é necessária para que a equipe amplie seu trabalho e incorpore tecidos e sujeitos humanos. O U.S. Armed Forces Institute of Regenerative Medicine está fornecendo dinheiro para o estudo, pois a pesquisa poderia beneficiar os soldados que sofreram lesões na virilha em combate.
Esophagus
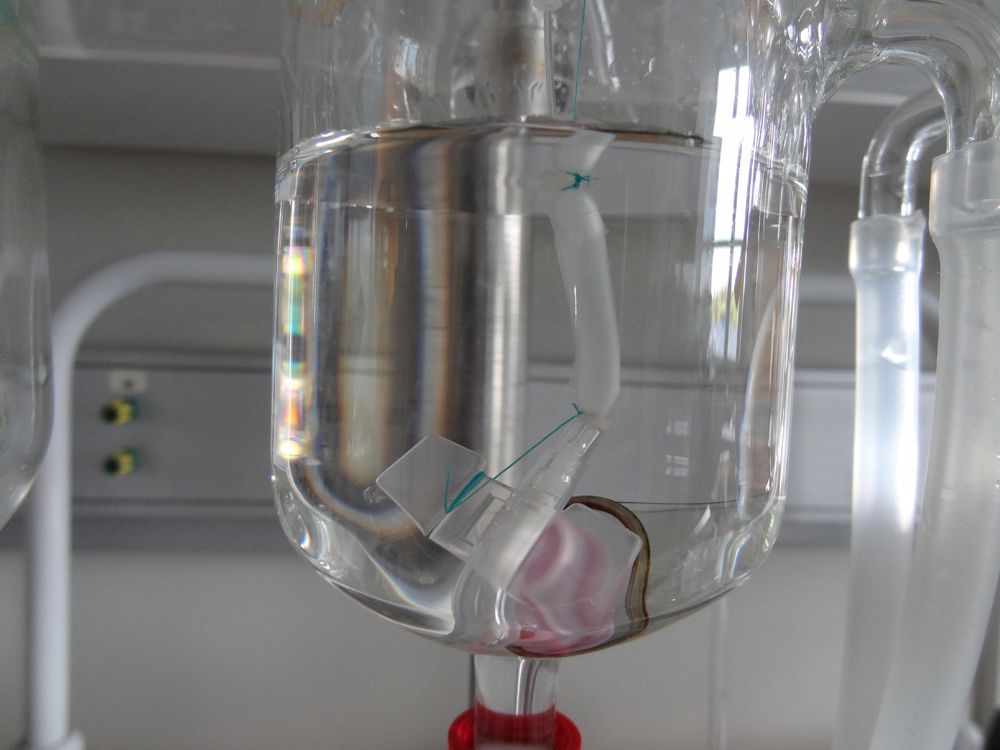
Na Universidade Estadual de Medicina de Kuban, em Krasnodar, Rússia, uma equipe internacional de cientistas construiu um esôfago de trabalho através do cultivo de células-tronco em um andaime por três semanas; eles então implantaram com sucesso o órgão em ratos. Os cientistas testaram a durabilidade do novo esôfago inflando e deflacionando-o 10.000 vezes, implantando as estruturas artificiais em 10 ratos e substituindo até 20% dos órgãos originais dos animais.
Ear
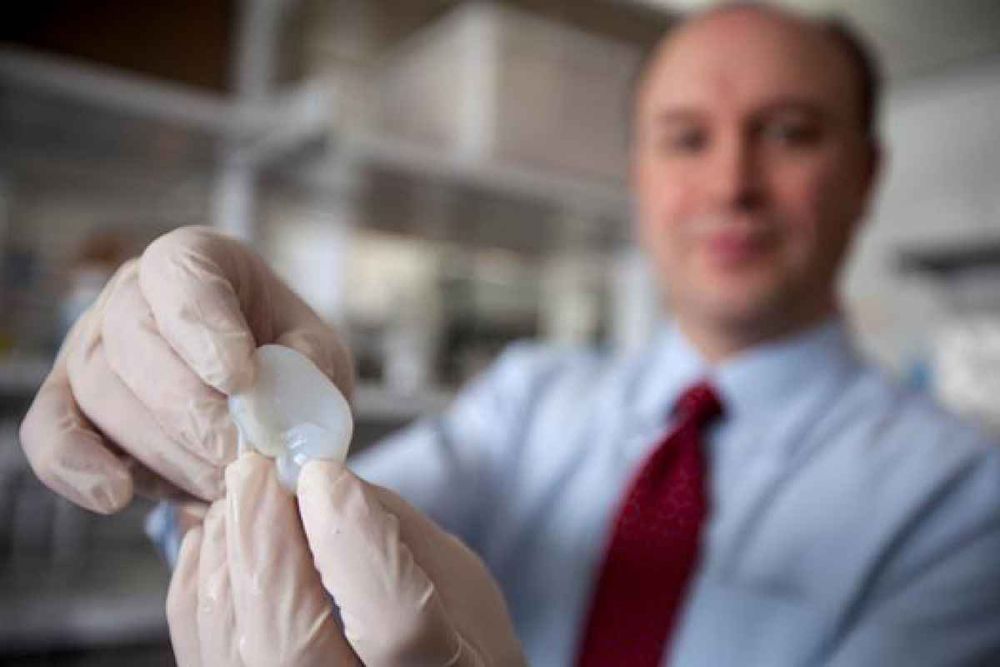
Agora ouça isto: Os cientistas têm orelhas humanas impressas em 3D, cultivando-as através do revestimento de formas de orelhas moldadas com células vivas que cresceram ao redor da moldura. Os pesquisadores criaram o molde em forma de orelha, modelando o ouvido de uma criança usando software 3D e depois enviando o modelo para uma impressora 3D. Uma vez que os cientistas tinham o molde na mão, eles o injetaram com um coquetel de células auditivas vivas e colágeno de vacas, e “saltaram uma orelha”, relatou a Live Science. As orelhas fabricadas foram então implantadas em ratos durante um a três meses, enquanto os cientistas avaliaram mudanças no tamanho e forma à medida que os órgãos cresciam.
Recent news