Quando uma substância muda de fase, ou seja, de sólido para líquido ou líquido para gás, a energia, ela requer energia para fazer isso. A energia potencial armazenada nas forças interatômicas entre moléculas precisa ser superada pela energia cinética do movimento das partículas antes que a substância possa mudar de fase.
Se medirmos a temperatura da substância que é inicialmente sólida à medida que a aquecemos, produzimos um gráfico como na Figura 1.
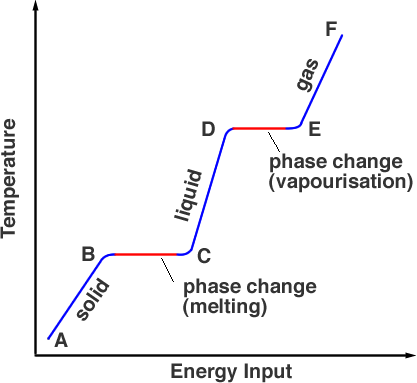
Iniciar um ponto A, a substância está em sua fase sólida, aquecendo-a leva a temperatura até seu ponto de fusão mas o material ainda é um sólido no ponto B. Como é aquecido mais adiante, a energia da fonte de calor vai para quebrar as ligações que mantêm os átomos no lugar. Isto acontece de B a C. No ponto C, toda a fase sólida foi transformada na fase líquida. Mais uma vez, à medida que a energia é adicionada, a energia vai para a energia cinética das partículas elevando a temperatura, (C a D). No ponto D, a temperatura atingiu seu ponto de ebulição, mas ainda está na fase líquida. Dos pontos D a E a energia térmica supera as ligações e as partículas têm energia cinética suficiente para escapar do líquido. A substância está a entrar na fase gasosa. Além de E, mais aquecimento sob pressão pode aumentar ainda mais a temperatura é como funciona uma panela de pressão.
Calor Latente de Fusão e Vaporização
A energia necessária para mudar a fase de uma substância é conhecida como calor latente. A palavra latente significa oculto. Quando a mudança de fase é de sólido para líquido devemos usar o calor latente de fusão, e quando a mudança de fase é de líquido para gás, devemos usar o calor latente de vaporização.
A energia necessária é Q= m L, onde m é a massa da substância e L é o calor latente específico de fusão ou vaporização que mede a energia térmica para transformar 1 kg de um sólido em líquido.
Quadro 1. mostrar o
| Substância | Calor específico latente de fusão kJ.kg-1 |
°C | Calor específico latente de vaporização kJ.kg-1 |
°C |
|---|---|---|---|---|
| Água | 334> | 0 | 2258 | 100 |
| Etanol | 109 | -114 | 838 | 78 |
| Ácido etanóico | 192 | 17 | 395 | 118 |
| Clorofórmio | 74 | -64 | 254 | 62 |
| Mercúrio | 11 | -39 | 294 | 357 |
| Sulphur | 54 | 115 | 1406 | 445 |
| Hidrogénio | 60 | -259 | 449 | -253 |
| Oxygen | 14 | -219 | 213 | -183 |
| Nitrogénio | 25 | -210 | 199 | -196 |
Condutas de calor
Como a densidade de transitores em um microprocessador aumenta, a quantidade de calor discipulado aumenta. Um processador Pentium 4 (180 nm rodando a 2GHz) disipa, 55 Watts de potência como calor. A sua área é de apenas 131 mm2. Isto dá um 55 W/(131/(102)) = 42 W cm-2. Em comparação, um ferro a vapor é 5 Wcm-2,
Uma solução é o tubo de calor. Como seu nome sugere, ele transfere calor de regiões de alta temperatura para regiões de baixa temperatura onde há mais espaço para dissipadores de calor ou ventiladores de resfriamento.
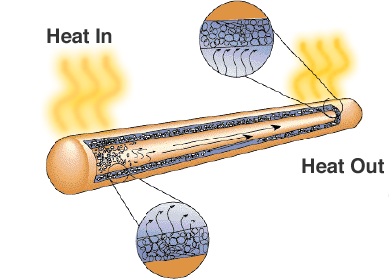
Embora pareça apenas um tubo metálico selado, há um pavio ou material poroso e um líquido com um alto calor latente de vaporização. Quando o tubo é aquecido o líquido usa o calor para evaporar e se transforma em gás, o gás se move para uma região mais fria do tubo de calor onde é condensado e usa o calor latente para se transformar novamente em líquido. Os tubos de calor são uma solução fiável e rentável para computadores portáteis onde os ventiladores reduziriam a duração da bateria.