- Introduction
- Materiais e Métodos
- Subjetos e Paradigma Experimental
- Functional Magnetic Resonance Imaging and Blood-Oxygen Level-Dependent Signals
- Selecção de Regiões de Interesse para Sinais de Dependência do Nível de Oxigénio no Cerebelo/Cérebro
- Cálculo da Média do Nível de Oxigênio no Sangue Dependente do Nível de Oxigênio, Intervalo de Batimento e Ondas Respiratórias
- Resultados
- Discussão
- Coincidência de Ondas Respiratórias e Artefato Respiratório dependente do Nível de Oxigênio
- Ativação Neural Rítmica Associada à Oscilação Neural Dependente do Nível de Oxigénio-Sangue
- Atividade Neural Age como “força motriz” para as oscilações da freqüência cardíaca lenta
- Limitações e Perspectivas Futuras
- Conclusão
- Dados Disponibilidade
- Declaração Ética
- Contribuições dos autores
- Conflict of Interest Statement
- Administração de agradecimentos
- A abreviações
Introduction
Respiratory sinus arrhythmia (RSA) reflects heart rate (HR) acceleration during inspiration and HR deceleration during expiration. É um princípio fundamental (Yasuma e Hayano, 2004) e o fenômeno central da respiração por ressonância estimulada a 6/min associada à variabilidade amplificada da freqüência cardíaca de baixa freqüência (VFC), maior bem-estar emocional (Mather e Thayer, 2018) e melhor processamento das emoções negativas (Zaccaro et al., 2018). Curiosamente, há exceções ao aumento da RSA com intervalo batimento a batimento da FC (IRR) durante a inspiração e com a fase da IRR levando ao ritmo respiratório (Rassler et al., 2018). Esta RSA paradoxal incomum foi encontrada em uma minoria de participantes saudáveis durante a ressonância magnética funcional (fMRI), uma situação desconfortável, às vezes claustrofóbica, geralmente associada ao aumento da ansiedade de estado (Munn et al., 2015; Pfurtscheller et al., 2018).
Ondas respiratórias espontâneas baixas com uma taxa entre 6 e 9 respirações/min são também acompanhadas por um VHC elevado e poderiam, assim, facilitar o processamento de emoções desagradáveis como ansiedade e estresse (Thayer e Lane, 2009). Devido ao papel de liderança da RRI sobre as oscilações respiratórias durante a interrupção incomum da RSA (Rassler et al., 2018), um oscilador neural autônomo (marcapasso central; Julien, 2006) no cérebro parece provável, o que atua como uma fonte de oscilações lentas da RRI. É interessante notar que Perlitz et al. (2004) relataram um novo tipo de ritmo cardiovascular na faixa de 0,15-Hz no homem e no cão com uma origem comum no tronco cerebral. A característica mais interessante desta banda larga “ritmo 0,15-Hz” (incluindo também componentes de freqüência próximos a 0,1 Hz) é que períodos de ondas fuso são acoplados de fase com respiração na proporção de 1:1. Nosso principal interesse de pesquisa foi identificar este marcapasso, o qual é sugerido para ser localizado no tronco cerebral (Lambertz e Langhorst, 1998; Perlitz et al, 2004), analisando sinais BOLD.
O sinal BOLD não quantifica diretamente a atividade neural em si, mas é sensível a mudanças na taxa metabólica cerebral, fluxo sanguíneo cerebral e volume sanguíneo cerebral (Obrig et al., 2000; Buxton et al., 2004) e a vários tipos de movimento (movimentos de tórax e vasos sanguíneos; Birn et al., 2006). Portanto, sinais BOLD podem ser compostos por componentes neurais e não neurais (por exemplo, movimento dos vasos). É esperado que dois sinais BOLD de origem diferente possam ser identificados no tronco cerebral com seu grande vaso sanguíneo (artéria basilar) e a fonte neural postulada 0,15-Hz (Perlitz et al., 2004). Assumimos que um deles resulta do movimento dos vasos sanguíneos (BOLDv) e indica o início de uma ação respiratória lenta, pois ocorre quase simultaneamente com a ativação neural dos neurônios respiratórios. Pensa-se que o outro está associado à ativação neural (BOLDn) retardada pelo tempo de acoplamento neurovascular de 2-3 s (Mateo et al., 2017). Especula-se que ambos os sinais BOLD apontam para um marcapasso central no tronco cerebral.
Materiais e Métodos
Subjetos e Paradigma Experimental
O grupo de sujeitos estudados foi o mesmo (idade 23,8 ± 3,3 anos) analisado recentemente por Rassler et al. (2018). O registro e o pré-processamento do ECG e da respiração foram descritos nesse trabalho. Todos os participantes deram consentimento informado por escrito para o protocolo do estudo, que havia sido aprovado pelo Comitê de Ética local da Universidade de Graz.
Functional Magnetic Resonance Imaging and Blood-Oxygen Level-Dependent Signals
Functional images were acquired with a 3 T scanner (Magnetom Skyra) using a multiband GE-EPI sequence (Moeller et al, 2010) com uma aquisição simultânea de seis bandas com TE/TR = 34/871 ms, ângulo de viragem de 52°, 2 mm × 2 mm × 2 mm tamanho voxel, 66 fatias axiais contíguas (11 × 6), matriz de aquisição de 90 × 104, e um FOV de 180 mm × 208 mm. Esta taxa de varredura de 871 ms (1,15 Hz de freqüência de amostragem) permite estudar oscilações lentas na faixa de 0,1-0,15 Hz. Para mais detalhes sobre pré-processamento, veja Pfurtscheller et al. (2018). O atlas de etiquetagem anatômica automática (AAL) (Tzourio-Mazoyer et al., 2002) foi usado para extrair cursos de tempo de sinais BOLD em 116 regiões de interesse (ROIs). Este atlas não mostra ROIs no tronco cerebral, mas apenas na proximidade do cerebelo e do verme. Devido à proximidade destas regiões e devido à contiguidade de uma artéria principal, é razoável supor que o sinal recolhido das ROIs AAL rotulado “cerebelo” reflete parcialmente a atividade do tronco cerebral.
Selecção de Regiões de Interesse para Sinais de Dependência do Nível de Oxigénio no Cerebelo/Cérebro
Entre as 116 ROIs do atlas AAL, as ROI 91 a ROI 108 correspondem a cortes axiais do cerebelo incluindo o tronco cerebral (Tzourio-Mazoyer et al.., 2002). As imagens T1 da fatia axial (Talairach space z = -34) documentam a proximidade do cerebelo e do tronco cerebral (Figura 1). Devido ao seu pequeno número de voxels (<200), os ROIs 107 e 108 foram excluídos da análise posterior. As ROIs do cerebelo/tronco cerebral foram inspecionadas visualmente a fim de buscar ROIs apropriadas, ou seja, ROIs com uma boa relação sinal/ruído e ondas dominantes de BOLD lento. As seguintes ROIs foram identificadas: 96, 98, 100, 103, e 105. Os números indicam as etiquetas de ROI de acordo com o atlas AAL. Os números ímpares e pares denotam os hemisférios esquerdo e direito, respectivamente.
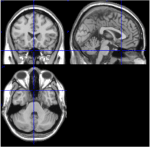
Figura 1. Imagens T1 de cortes mediais, sagitais e axiais de um tema (espaço Talairach 0, 20, -34). Na fatia sagital (imagem superior direita), as pons são claramente visíveis, e na fatia axial (inferior) a proximidade do cerebelo e tronco cerebral é documentada.
Cálculo da Média do Nível de Oxigênio no Sangue Dependente do Nível de Oxigênio, Intervalo de Batimento e Ondas Respiratórias
Averaging permite melhorar a relação sinal/ruído, mas requer o uso de um gatilho. Como não estão disponíveis tais gatilhos nos dados de estado de repouso, foram usados os máximos (picos) ritmicamente ocorridos do sinal RRI (Pfurtscheller et al., 2017): Primeiro, foram identificados os picos mais proeminentes dos sinais de RRI, espaçados pelo menos vários segundos entre si. No caso de oscilações 0,1-Hz, esses intervalos entre os picos foram em torno de 10 s, e no caso de oscilações 0,15-Hz, foram em torno de 7 s (um exemplo é representado na Figura 2 pelas linhas verticais a tracejado quase equidistantes). Os picos marcados de RRI foram usados como gatilhos de média (épocas com 6 s antes e 6 s depois do gatilho) através do BOLD, RRI e sinais respiratórios.
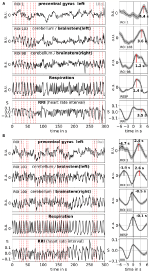
Figura 2. Exemplos de sinais contínuos de BOLD, RRI e respiração e ondas médias correspondentes (±SE) para dois sujeitos, um com oscilações dominantes de 0,1-Hz e outro com oscilações dominantes de 0,15-Hz . As linhas verticais tracejadas nos painéis do lado esquerdo indicam os máximos (picos) das oscilações do RRI usadas como gatilho para a determinação da média. Os picos das ondas médias são indicados nos painéis do lado direito.
Resultados
Slow BOLD oscilações no cerebelo/tronco cerebral são caracterizados pela sua qualidade de sinal favorável, mas ainda mais importante, pela sua coincidência com as oscilações no RRI e respiração. Como relatado em Rassler et al. (2018), as oscilações 0,1-Hz prevaleceram durante ~37% do tempo de registro, enquanto as oscilações 0,15-Hz prevaleceram em ~45%. Dois exemplos característicos das oscilações 0,1-Hz (sujeito 1Rb1) e 0,15-Hz (sujeito 11Ra1) são mostrados na Figura 2. Em ambos os casos, oscilações de RRI de grande magnitude coincidem com a respiração em forma de aumento da RRI durante a inspiração e também são claramente refletidas nos sinais de BOLD no tronco cerebral. Note que a dinâmica variável das oscilações espontâneas e das ondas únicas, respectivamente, no estado de repouso, dão forte evidência de que não apenas um, mas uma variedade de ritmos cardiovasculares existem com componentes de freqüência próximos a 0,1 e 0,15 Hz. Alguns destes ritmos são amplificados durante o processamento da ansiedade, outros não, e alguns são sincronizados no córtex pré-frontal e no tronco cerebral e outros não.
Exemplos de sinais espontâneos e ondas médias de dois sujeitos característicos são mostrados na Figura 2. As ondas médias com latências de pico marcadas (distância do pico da RRI) de todos os sujeitos são mostradas na Figura 3. De notar que a variância relativamente pequena das ondas BOLD médias no tronco cerebral sublinha a fiabilidade das medidas de pico.
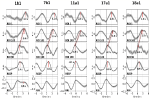
Figura 3. Ondas médias (±SE) de sinais BOLD do giro pré-central esquerdo (ROI 1), tronco cerebral esquerdo (BOLDn, ROIs 103, 105), tronco cerebral direito (BOLDv, 96, 98, 100), respiração e intervalos RR (de cima para baixo) de todos os cinco sujeitos. As latências de pico (diferença do pico RRI) de picos importantes são marcadas. A mudança de tempo de 2-3 s entre os dois sinais BOLD do cerebelo/tronco cerebral é indicada por uma linha pontilhada.
A onda BOLD no hemisfério direito que precede a onda respiratória em 0,3 ± 0,2 s foi interpretada como BOLDv, e a onda BOLD no hemisfério esquerdo que atrasa a onda respiratória em 2,3 ± 0,5 s foi tomada como BOLDn. A diferença de pico entre as ondas BOLDv e BOLDn foi de 2,6 ± 0,4 s.
As ondas médias na Figura 3 destacam a mudança clara de fase entre os dois sinais BOLD no tronco cerebral (BOLDn, BOLDv) em todos os cinco sujeitos. As diferenças de picos são indicadas por linhas pontilhadas. Além dos dois sinais BOLD do tronco cerebral, o sinal BOLD do giro pré-central esquerdo (ROI 1) foi analisado como controle. Embora as ondas BOLD médias no córtex pré-frontal (PFC) exibam uma variância elevada (SE), elas estão em surpreendente combinação perfeita com as ondas BOLDn no cerebelo/tronco encefálico. Isto confirma a forte interação entre PFC e tronco cerebral na faixa de frequência lenta em torno de 0,1 Hz.
Discussão
Coincidência de Ondas Respiratórias e Artefato Respiratório dependente do Nível de Oxigênio
A respiração é acompanhada não apenas pelo movimento do tórax, mas também pelo movimento dos vasos sanguíneos cerebrais (Birn et al., 2006). Um desvio temporal estável de 0,3 ± 0,2 s foi observado entre o pico positivo do sinal BOLDv no cerebelo/tronco cerebral direito e o máximo de cada onda respiratória (início da expiração). A respiração foi espontânea, e o pico respiratório atrasou o pico de BOLDv, possivelmente indicando uma rápida vasomoção da artéria basilar, um grande vaso sanguíneo próximo ao lado rostral das pons. Esta vasomoção pode ser considerada um artefato respiratório induzido por uma modulação respiratória dos neurônios simpatoexcitatórios no núcleo reticular rostroventrolateral. Uma influência marcante do gerador do padrão respiratório central na atividade do nervo simpático tem sido observada em muitas espécies, incluindo a humana (Haselton e Guyenet, 1989; Häbler e Jänig, 1995; Eckberg, 2003; Mandel e Schreihofer, 2006). A diminuição da atividade desses neurônios na medula rostroventrolateral (ou seja, depressão simpática) durante a inspiração e um aumento abrupto da atividade com cessação de estouros frênicos é um dos padrões predominantes de acoplamento respiratório-simpático (Haselton e Guyenet, 1989). Estas oscilações simpáticas moduladas pela respiração causam vasodilatação máxima no final da inspiração (i.e, máximo do sinal BOLD imediatamente antes do início da expiração) e vasoconstrição durante a expiração (mínimo do sinal BOLD imediatamente antes do início da inspiração).
Ativação Neural Rítmica Associada à Oscilação Neural Dependente do Nível de Oxigénio-Sangue
As oscilações BOLDn (BOLDn) atrasaram o artefato respiratório periódico (BOLDv) em 2.6 ± 0,4 s. Ambas as oscilações do BOLD foram registradas simultaneamente em cortes axiais com BOLDn associado à atividade neural como força motriz da respiração espontânea e BOLDv refletindo o movimento de um vaso associado ao início da expiração. Este atraso de 2-3 s corresponde ao tempo de acoplamento neurovascular (Mateo et al., 2017).
Várias influências externas na emoção provocadas pela posição supina desconfortável com a cabeça do sujeito em um espaço ruidoso limitado podem ativar primeiro as áreas sensoriais primárias e ser seguidas pela projeção cortical para os neurônios respiratórios do tronco cerebral. Além disso, as influências internas e comportamentais decorrentes dos centros superiores modificam os padrões respiratórios metabólicos. O débito respiratório final envolve uma interação complexa entre estruturas corticais, tronco cerebral e sistema límbico e é característica da respiração emocional (Homma e Masaoka, 2008; Kato et al., 2018). Portanto, é bastante plausível que as oscilações no giro pré-central esquerdo (ROI 1) foram sincronizadas com as oscilações lentas e neuralmente induzidas do BOLD no cerebelo/tronco cerebral.
Atividade Neural Age como “força motriz” para as oscilações da freqüência cardíaca lenta
A dinâmica variável dos padrões de acoplamento observados no estado de repouso aponta para uma variedade de ritmos cardiovasculares na faixa de frequência entre 0,1 e 0,15 Hz. Isto sublinha a importância, flexibilidade e complexidade da interação cérebro-coração e merece mais pesquisas intensivas.
Nos cinco participantes, o padrão de acoplamento entre respiração e FC foi bastante contrário à RSA típica (Rassler et al., 2018), ou seja, a RRI aumentou durante a inspiração e diminuiu durante a expiração. Durante situações que provocam ansiedade, a respiração tende a ser mais rápida e a atividade vagal diminuiu, levando a uma FC mais alta (RRI mais curta). No entanto, quando a respiração é inconscientemente/autonomicamente retardada numa situação provocadora de ansiedade, a actividade vagal pode aumentar, resultando numa FC mais baixa (RRI maior). Parece que não só a ativação cortical induz um aumento quase simultâneo da RRI (Barry, 1983; Damen e Brunia, 1987; Pfurtscheller e Lopes da Silva, 1999; Pfurtscheller et al., 2013), mas nosso estudo fornece primeiro evidências de que também um marcapasso central no cerebelo/tronco cerebral pode atuar como força motriz para oscilações intrínsecas da RRI e ondas respiratórias lentas espontâneas. Esta descoberta apoia fortemente o trabalho de Perlitz et al. (2004) sobre o “ritmo 0,15-Hz”
Limitações e Perspectivas Futuras
A selecção de ROIs com sinais BOLD de boa qualidade no cerebelo/tronco encefálico foi feita por inspecção visual. Isto incluiu a diferenciação entre oscilações de BOLD de origem neural e artefatos de movimento. Este último denota sinais BOLD com bloqueio de tempo com respiração. Para estudos posteriores, recomenda-se calcular os valores de bloqueio de fase (PLV; Pfurtscheller et al.2017) entre RRI e os sinais individuais de BOLD no cerebelo/tronco encefálico. Além disso, a avaliação síncrona da métrica de ventilação, como volume corrente/volume respiratório por tempo, pCO2 final da maré e tipo de respiração (nariz vs. boca), bem como o uso de vários métodos de denoising em ambientes clínicos e experimentais com animais, poderia dar uma visão mais profunda das complexas interações dos sistemas regulatórios envolvidos.
O “switch-off” da arritmia do seio respiratório é uma exceção a um fenômeno fisiológico fundamental que pode ocorrer, por exemplo, em situações que provocam ansiedade. Entre 23 participantes saudáveis de um estudo de fMRI, apenas cinco sujeitos apresentaram este padrão de acoplamento paradoxal.
Um pré-requisito para a análise de BOLD (Bn e Bv) no tronco cerebral é uma coincidência de respiração lenta e oscilações da RRI; entretanto, tal acoplamento 1:1 só pode ser encontrado em uma minoria de participantes. Portanto, este tipo de análise é restrito a estes casos raros. No entanto, supomos que um marcapasso central no tronco cerebral também é prevalente em indivíduos com uma RSA normal e acoplamento 1:2 ou 1:3 (duas ou três respirações durante um ciclo de RRI). Os primeiros resultados do cálculo do acoplamento de fase (PLV) entre as oscilações BOLD do tronco cerebral e as oscilações RRI na banda de 0,1- a 0,15-Hz suportam esta suposição. Com este método, é possível medir a actividade do pacemaker no tronco cerebral independentemente da taxa de respiração. Este trabalho está em andamento.
Deve-se notar que o nível de ansiedade de estado nos indivíduos com respiração espontânea lenta variou entre AS = 14 e AS = 28 (faixa possível de escores de AS: 10-40) e nem todos os indivíduos com escores de ansiedade elevados exibiram este tipo de respiração lenta. Portanto, concluímos que não existe uma relação clara entre a respiração lenta espontânea e o processamento da ansiedade.
Conclusão
1. As oscilações BOLD do cerebelo/tronco encefálico em repouso podem ter frequências alternadas entre 0,1 e 0,15 Hz, semelhantes às relatadas na RRI e nos sinais respiratórios (Rassler et al., 2018).
2. Alguns sinais BOLD do cerebelo/tronco encefálico podem ser influenciados pela vasomoção (artéria basilar), enquanto outros podem estar associados a uma atividade de marcapasso central no tronco encefálico. Consequentemente, o tempo real de início da respiração bem como sua fonte neural pode ser detectada em sinais de BOLD.
3. Ambos sinais de BOLD com diferentes origens registradas simultaneamente caracterizam uma fonte comum, que suporta o trabalho de Perlitz et al. (2004).
4. Os resultados sugerem que há evidência para uma respiração emocional inconsciente a 6-9/min (0,1-0,15 Hz), que – de forma similar à respiração de ressonância consciente a 6/min (0.1 Hz) promovendo bem-estar psicológico (Mather and Thayer, 2018) – também eleva o VHF e pode facilitar o processamento de emoções negativas.
Dados Disponibilidade
Os conjuntos de dados gerados para este estudo estão disponíveis mediante solicitação ao autor correspondente.
Declaração Ética
Este estudo foi realizado de acordo com as recomendações da Declaração de Helsinque de 1964 com o consentimento livre e esclarecido por escrito de todos os sujeitos. Todos os sujeitos deram consentimento livre e esclarecido por escrito, de acordo com a Declaração de Helsinque. O protocolo foi aprovado pelo Comitê de Ética da Universidade de Graz.
Contribuições dos autores
GP contribuiu para a conceituação e rascunho original. BR e AA ajudaram na metodologia, processamento de dados, estatística, redação e visualização. AS, BR, GS, WK e JT revisaram e editaram o manuscrito.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Administração de agradecimentos
Os autores gostariam de agradecer a Thomas Zussner, David Fink e Karl Koschutnig, da Universidade de Graz, pelo apoio na aquisição de dados.
A abreviações
BOLD, dependente do nível de oxigenação do sangue; ECG, eletrocardiograma; (f)RM, ressonância magnética (funcional); FC, freqüência cardíaca; VHF, variabilidade da freqüência cardíaca; PFC, córtex pré-frontal; ROI, região de interesse; RRI, intervalo batimento a batimento; RSA, arritmia sinusal respiratória.
Barry, R. J. (1983). Bradicardia primária e a resposta cardíaca evocada no contexto da sala de cirurgia. Fisiol. Psicol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., e Bandettini, P. A. (2006). Separando as flutuações relacionadas à variação respiratória das flutuações relacionadas à atividade neuronal na fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., e Liu, T. T. (2004). Modelando a resposta hemodinâmica à ativação cerebral. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., e Brunia, C. H. M. (1987). Mudanças na frequência cardíaca e nos potenciais lentos do cérebro relacionados com a preparação motora e a antecipação de estímulos numa tarefa de estimativa de tempo. Psicofisiologia 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). A porta respiratória humana. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., e Jänig, W. (1995). Coordination of sympathetic and respiratory systems: neurophysiological experiments. Clin. Exp. Hipertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., e Guyenet, P. G. (1989). Central respiratory modulation of medullary sympathoexcitatory neurons in rat. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., e Masaoka, Y. (2008). Ritmos respiratórios e emoções. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). O enigma das ondas de Mayer: fatos e modelos. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Relações entre traços e parâmetros respiratórios durante a respiração silenciosa em sujeitos normais. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., e Langhorst, P. (1998). Mudanças simultâneas de organização rítmica em neurônios tronco cerebral, respiração, sistema cardiovascular e EEG entre 0,05 Hz e 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., e Schreihofer, A. M. (2006). Central respiratory modulation of barosensitive neurones in rat caudal ventrolateral medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., e Kleinfeld, D. (2017). A entrada de flutuações vasomotoras arteriole por atividade neural é uma base de conectividade “estado de repouso” dependente do nível de oxigenação do sangue. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Como a variabilidade da frequência cardíaca afeta as redes cerebrais de regulação das emoções. Moeda. Opinião. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). GE-EPI multibandas multislice em 7 Tesla, com aceleração de 16 vezes usando imagens paralelas parciais com aplicação em fMRI de alto cérebro inteiro espacial e temporal. Magn. Ressonância. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., e Murphy, F. (2015). Claustrofobia em ressonância magnética: uma revisão sistemática. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontaneous low frequency oscillations of ccerebral hemodynamics and metabolism in human adult. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Ritmos cardiovasculares na faixa 0,15-Hz: origem comum de fenômenos idênticos no homem e no cão na formação reticular do tronco cerebral? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., e Lopes da Silva, F. (1999). Sincronização e dessincronização EEG/MEG relacionada a eventos: princípios básicos. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Comunicação cérebro-coração: evidência de oscilações do “marcapasso central” com frequência dominante a 0,1 Hz no cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Sincronização de oscilações intrínsecas 0,1-Hz dependentes do sangue em amígdala e córtex pré-frontal em sujeitos com aumento da ansiedade de estado. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., e Müller-Putz, G. R. (2013). Ritmo cardíaco acelerado e alterações do EEG durante a execução e retenção de imagens do motor do pé em movimento. Frente. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., e Pfurtscheller, G. (2018). O “Switch-off” da arritmia do seio respiratório pode ocorrer em uma minoria de sujeitos durante a ressonância magnética funcional (fMRI). Frente. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard e a conexão coração-cérebro: elaboração de um modelo de integração neurovisceral. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Rotulagem anatômica automatizada das ativações em SPM usando uma parcela anatômica macroscópica do cérebro mono-sujeito da ressonância magnética MNI. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Arritmia sinusal respiratória: por que os batimentos cardíacos sincronizam-se com o ritmo respiratório? Peito 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Como o controle da respiração pode mudar sua vida: uma revisão sistemática sobre correlatos psico-fisiológicos de respiração lenta. Frente. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar