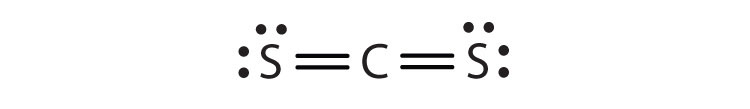4.3 Múltiplas Ligações Covalentes
Objectivo de Aprendizagem
- Reconhecer moléculas que provavelmente terão múltiplas ligações covalentes.
Em muitas moléculas, a regra do octeto não seria satisfeita se cada par de átomos ligados partilhasse dois electrões. Considere o dióxido de carbono (CO2). Se cada átomo de oxigénio partilhar um electrão com o átomo de carbono, obtemos o seguinte:
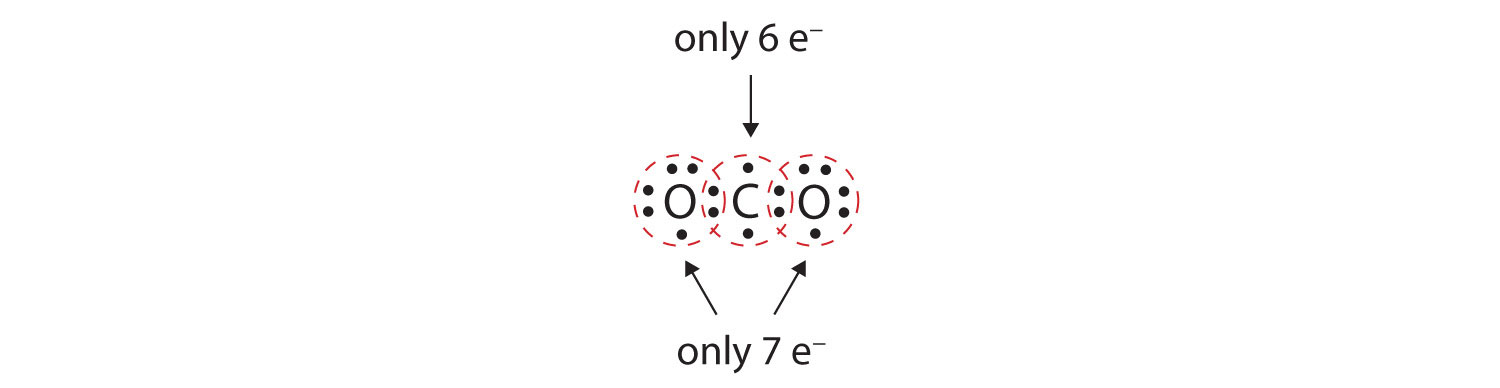
Isto não dá ao átomo de carbono um octeto completo; encontrará apenas seis electrões na sua casca de valência. Além disso, cada átomo de oxigênio tem apenas sete elétrons em sua concha de valência. Finalmente, nenhum átomo faz o número de ligações que ele normalmente forma (Figura 4.2 “Quantas ligações covalentes são formadas?”). Este arranjo de elétrons compartilhados está longe de ser satisfatório.
Por vezes mais de um par de elétrons deve ser compartilhado entre dois átomos para que ambos os átomos tenham um octeto. No dióxido de carbono, um segundo elétron de cada átomo de oxigênio também é compartilhado com o átomo central de carbono, e o átomo de carbono compartilha mais um elétron com cada átomo de oxigênio:
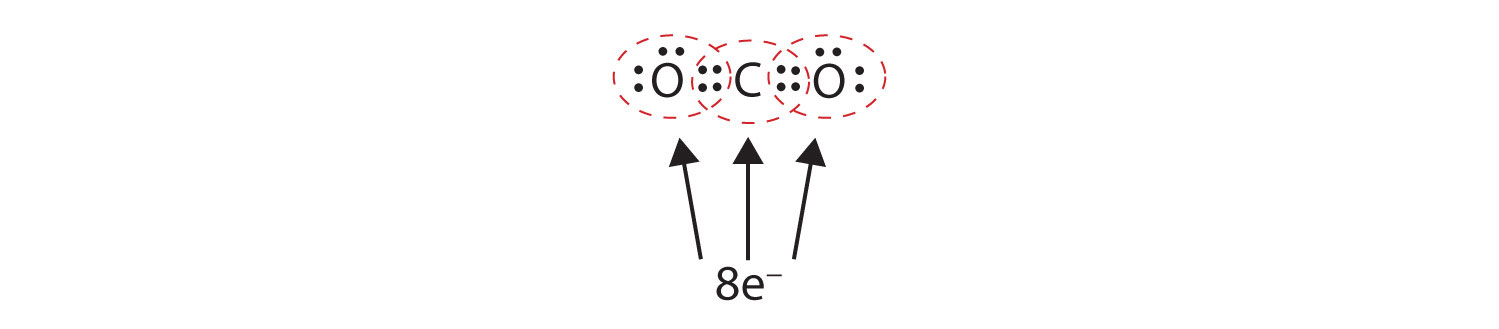
Neste arranjo, o átomo de carbono compartilha quatro elétrons (dois pares) com o átomo de oxigênio à esquerda e quatro elétrons com o átomo de oxigênio à direita. Agora há oito elétrons ao redor de cada átomo. Dois pares de elétrons compartilhados entre dois átomos fazem uma dupla ligaçãoDois pares de elétrons sendo compartilhados por dois átomos em uma molécula. entre os átomos, que é representada por um traço duplo:
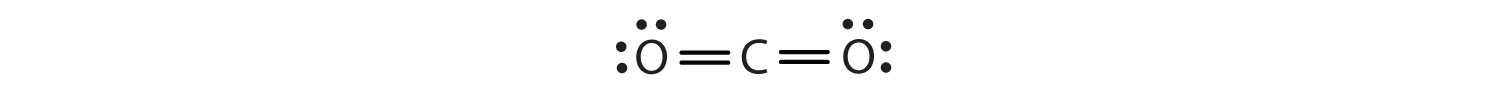
Algumas moléculas contêm ligações triplasTrês pares de elétrons sendo compartilhados por dois átomos em uma molécula, ligações covalentes em que três pares de elétrons são compartilhados por dois átomos. Um composto simples que tem uma ligação tripla é o acetileno (C2H2), cujo diagrama de Lewis é o seguinte:

Exemplo 5
Desenhar o diagrama de Lewis para cada molécula.
- N2
- CH2O (O átomo de carbono é o átomo central.)
Solução
-
A ligação entre os dois átomos de azoto é uma ligação tripla. O diagrama de Lewis para N2 é o seguinte:

-
Em CH2O, o átomo central é rodeado por dois tipos diferentes de átomos. O diagrama de Lewis que preenche a valência de cada átomo é o seguinte:

Nota
Uma aplicação do CH2O, também chamado formaldeído, é a preservação de espécimes biológicos. As soluções aquosas de CH2O são chamadas de formalina e têm um odor agudo e característico (pungente).
Exercício de construção do CH2O
-
O2
-
C2H4
Desenhar o diagrama de Lewis para cada molécula.
Exercício de Revisão de Conceito
-
Qual é a pista de que uma molécula tem uma ligação múltipla?
Resposta
-
Se uma única ligação entre todos os átomos não der um octeto a todos os átomos (excepto ao hidrogénio), podem estar presentes ligações covalentes múltiplas.
Key Takeaway
- Algumas moléculas devem ter ligações covalentes múltiplas entre os átomos para satisfazer a regra do octeto.
Exercícios
-
Cada molécula contém ligações múltiplas. Desenhe o diagrama de Lewis para cada uma delas. O primeiro elemento é o átomo central.
- CS2
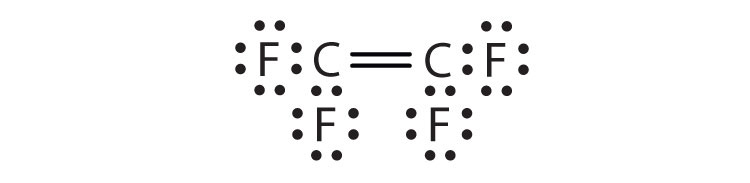
- C2F4
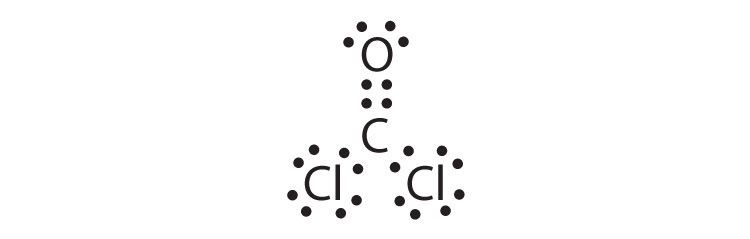
- COCl2
-
Cada molécula contém ligações duplas. Desenhe o diagrama de Lewis para cada uma delas. Assumir que o primeiro elemento é o átomo central, a menos que se note o contrário.
- N2
- HCN (O átomo de carbono é o átomo central.)
- POCl (O átomo de fósforo é o átomo central.)
-
Explicar porque é que os átomos de hidrogénio não formam ligações duplas.
-
Por que é incorrecto desenhar uma ligação dupla no diagrama de Lewis para MgO?
Respostas
-
-
-
Hidrogénio só pode aceitar mais um electrão; ligações múltiplas requerem mais do que um par de electrões para serem partilhados.