Introdução
Câncer de próstata é a forma mais comum de malignidade e a segunda principal causa de morte por câncer entre os homens.1 Estudos cadavéricos mostram que a possibilidade de desenvolver câncer de próstata micro-foci aumenta com a idade (30% na quarta década de vida, 40% na quinta década, etc.).2
Apesar de alguns cânceres serem agressivos, outros têm pouco ou nenhum potencial metastático.3 Muitos homens com câncer de próstata de baixo risco não progredirão ou se tornarão clinicamente sintomáticos durante sua vida.4 Devido a esta variabilidade, foram introduzidas diferentes opções de tratamento, oferecendo efeitos terapêuticos comparáveis à prostatectomia radical (RP), preservando ao mesmo tempo a função sexual e a continência. Neste cenário, a vigilância ativa (SA) pode oferecer redução da morbidade e melhora na qualidade de vida.5 Os pequenos tumores não agressivos são os candidatos ideais para o SA, embora não tenha sido alcançado consenso. A doença de baixo risco é definida como Gleason score (GS) 6 e antígeno específico da próstata (PSA)
ng/ml. Pacientes com estágio clínico >T2a são geralmente excluídos.6
O grau histológico é um determinante independente do prognóstico da doença e da sobrevida.7 O sistema de classificação GS é a classificação mais amplamente aceita,8 mas muitos estudos mostraram que o GS obtido a partir da biópsia prostática nem sempre se correlaciona com o grau patológico final das peças cirúrgicas. O upgrade de GS (aumento de pelo menos um ponto na GS) foi relatado em até 57% dos casos.9,10 Erros na atribuição de GS podem levar a uma vigilância inadequada de tumores biologicamente agressivos, ou à seleção de tratamentos com taxas de cura inferiores em doenças de alto risco, o que pode ter um impacto negativo nos resultados dos pacientes.11 Portanto, vários estudos recentes pesquisaram fatores que poderiam prever a atualização da GS.12
Baixo volume da próstata (PV) e, mais especificamente, a alta densidade de antígenos específicos da próstata (PSAD) demonstraram ser fatores preditores da progressão do risco em muitos estudos, refletindo a possibilidade de câncer agressivo não detectado.6 Vários estudos demonstraram uma forte relação entre a PSAD e a agressividade do câncer de próstata.13 A PSAD tem sido proposta como um forte preditor de atualização da GS em pacientes com doença de Gleason 6 confirmada por biópsia, mas não há um consenso geral sobre o valor de corte.11-O objetivo principal do nosso estudo foi identificar os preditores independentes para a atualização da GS e determinar o melhor valor de corte para a PSAD para identificar pacientes em risco.
Materiais e métodos
Coletamos as informações do estudo na base de dados do nosso centro hospitalar mantida prospectivamente. Foram selecionados pacientes com câncer de próstata clinicamente localizado que foram submetidos a uma prostatectomia radical (RP) e fizeram uma biópsia pré-operatória da próstata dentro do período de janeiro de 2004 a fevereiro de 2015. A detecção de GS 3+3 na biópsia da próstata foi tomada como critério de inclusão. Todas as informações clínicas, de imagem, laboratoriais e patológicas foram obtidas do banco de dados e corroboradas pelos registros de casos clínicos dos pacientes.
Incluímos a idade do paciente pré-operatório, estágio clínico da doença, PSA pré-cirúrgico, PSAD pré-operatório, GS biópsia, número total de núcleos de biópsia tomados e número de núcleos de biópsia com câncer e analisamos a associação desses fatores com a atualização da GS após a RP. Diferentes valores de corte foram utilizados para cada variável para identificar e quantificar uma potencial relação com o Gleason upgrade. Também foi analisada a associação do GS upgrade com variáveis da síndrome metabólica, como diabetes mellitus (DM), hipertensão arterial (HBP) e obesidade, que foram obtidas a partir dos prontuários clínicos dos pacientes. As últimas variáveis foram incluídas porque estudos anteriores mostraram sua associação com pior prognóstico e maior taxa de recidiva.18,19
PSAD foi calculado dividindo-se o valor do PSA pré-operatório pelo PV. A PV foi calculada pela ultrassonografia transretal usando o diâmetro transversal máximo (D1), o diâmetro anteroposterior máximo (D2) e o diâmetro longitudinal máximo (D3), usando a fórmula D1×D2×D3×ϖ/6 baseada na teoria da dimensão da elipse prostática.14 A biópsia da próstata foi realizada usando o protocolo previamente descrito pelo nosso hospital. Todos os pacientes estavam levemente sedados e uma única dose i.v. de piperacilina/tazobactam foi administrada 15min antes do procedimento.20 Utilizamos uma agulha calibre 18 com uma pistola automática de biópsia para obter o tecido prostático. Para a primeira biópsia, foram recuperados 12-18 núcleos, dependendo do tamanho da próstata e da presença de nódulos suspeitos.21 Todas as amostras foram colocadas em um recipiente separado que identificou o local correspondente e foram enviadas ao serviço de patologia de nosso hospital.
Estatística descritiva foram apresentadas como média±desvio padrão (DP) e mediana/IQR para variáveis contínuas e como freqüência absoluta e porcentagem de distribuição para variáveis categóricas. Pacientes que no pós-operatório foram atualizados para GS 7 ou superior foram comparados com aqueles que não foram atualizados. Para determinar as diferenças e semelhanças médias, as variáveis categóricas foram comparadas usando o teste qui-quadrado de Pearson e as variáveis contínuas com o teste da mediana e o teste t de Student. Um teste de regressão univariada foi usado para detectar preditores independentes significativos de atualização. Uma curva de característica operacional receptora (ROC) foi usada e a área sob a curva (AUC) foi calculada para mostrar o valor de corte ótimo para variáveis com significância preditiva para atualização da GS. Estimamos a sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo de diferentes pontos de corte propostos por outros autores, aplicámo-los à nossa população e depois comparámo-los com o nosso valor de corte. Todos os testes foram bicaudais e um valor de p
Resultados
De um total de 342 pacientes em nossa base de dados, 144 (42,1%) foram excluídos porque tinham um GS ≥4 na biópsia da próstata. Isto deixou 198 (57,9%) pacientes que preencheram nossos critérios de inclusão de GS 6 (3+3). Setenta e três desses pacientes foram excluídos devido a informações clínicas incompletas dos prontuários médicos.
A idade média dos pacientes era 65,1±6,3 anos, o índice de massa corporal (IMC) era 26,7±3,6kg/m2, o número de núcleos tomados era 13,4±3,5, o número de núcleos positivos era 2,5±2 e o PSAD pré-operatório era 0,26±0,23ng/ml2. A mediana do PSAO pré-operatório foi 7,2 IQR 5,67-10,05 e a PV foi 38 IQR 26,5-55,5. O estágio clínico baseado no exame retal digital foi T1c em 86 (69,6%) pacientes, T2a em 28 (22,4%), T2b em 7 (5,6%), T2c em 2 (1,6%) e T3 em um (0,8%) paciente.
ASP pré-operatório foi categorizado da seguinte forma: 6 (4,8%) pacientes tinham valores de PSA
ng/ml, 88 (70,4%) estavam entre 4 e 9,9ng/ml, 23 (18,4%) estavam entre 10 e 19,9ng/ml, e 8 (6,4%) tinham PSA ≥20ng/ml. A biópsia GS e a GS cirúrgica permaneceram iguais em 71 (56,8%) pacientes com GS 3+3, enquanto 54 (43,2%) pacientes tiveram um upgrade. Dos pacientes com atualização, 70% subiram para um GS de 7 e 30% aumentaram para ≥8.
Tabela 1 mostra as características demográficas e clínicas dos pacientes com e sem atualização do GS. Encontramos uma correlação estatisticamente significativa entre o upgrade pós-operatório e o valor do PSAD pré-operatório (p0,001), PSA pré-operatório (p=0,039), PV (p=0,004), e idade do paciente ≥70 anos (p=0.011).
Característica dos pacientes com e sem atualização do escore de Gleason após prostatectomia radical.
>
| Características | Upgrade | Sem upgrade | Valor p | |
|---|---|---|---|---|
| Não. de pacientes (%) | 54 (43,2%) | 71 (56.8%) | ||
| Age (anos) | ||||
| Média±SD | 66.22±6,5 | 64,28±6,0 | 0,092b | |
| Age (n.º de anos).) | ||||
| >70 anos de idade | 20 | 12 | >0.011*,a | |
| 34 | 59 | |||
| IMC (kg/m2) | ||||
| Média±SD | 26.22±4,0 | 27,14±3,1 | 0,178c | |
| PSA (ng/ml) | ||||
| Mediana/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c | |
| Volume do próstata (ml) | ||||
| Mediana/IQR | 30.6/22.5–43.5 | 46/32.2–63.7 | 0.007*,c | |
| PSAD (ng/ml2) | ||||
| Média±SD | .36±.27 | .19±.16 | *,c | |
| Núcleos de biópsia (ng/ml2>).) | ||||
| Média±SD | 12,9±3,4 | 13,7±3,7 | >0.240c | |
| Núcleos positivos (n.º) | ||||
| Média±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c | |
| Obesidade (nº.) | ||||
| Positivo | 9 (16,6%) | 16 (22,5%) | 0.500a | |
| Negativo | 45 (83,4%) | 55 (77.5%) | ||
| DM (nº.) | ||||
| Positivo | 16 (29,6%) | 14 (19.7%) | 0,150a | |
| Negativo | 38 (70,4%) | 57 (80.3%) | ||
| HBP (nº.) | ||||
| Positivo | 21 (38.9%) | 30 (42,2%) | 0,775a | |
| Negativo | 33 (61,1%) | 41 (57.8%) | ||
IQR: intervalo interquartílico; IMC: índice de massa corporal; PSA: antigénio específico da próstata; PSAD: densidade do antigénio específico da próstata; DM: diabetes mellitus; HBP: tensão arterial elevada.
X2 teste.
Teste t do estudante.
Teste mediano.
Estatisticamente significativo com um valor de p
Estimamos um ponto de corte de PSAD óptimo de 0.17ng/ml2 através da análise ROC, com um AUC de 0,675 (p=0,001, 95%CI .580-,770), e depois analisamos os valores de corte propostos por outros autores e os comparamos. A Tabela 2 e a Fig. 1 mostram esses resultados.
Análise de diferentes valores de corte do PSAD como preditor de atualização da GS.
| Upgrade | Sem upgrade | p | Odds rácio | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (nº.) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD (nº.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD (nº.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (nº.) | ||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49 (69%) | |||||||
X2 teste.
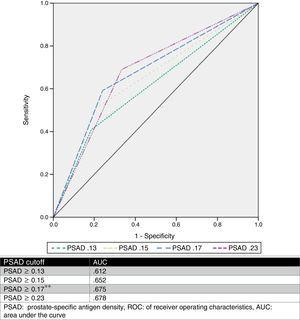
C curve.
Tabela 3 mostra os resultados da regressão univariada para a detecção de preditores independentes de atualização.
Preditores independentes de upgrade (regressão univariada).
>
| Características | HR | 95 CI | valor de p |
|---|---|---|---|
| Idade | 0.5 | 0,99-1,11 | 0,09 |
| >70 anos de idade | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0.166 |
| PSAD ≥0.13 | 1.11 | 1.32-6.99 | 0.009* |
| PSAD ≥0.15 | 1.39 | 1.79-9.03 | 0.001* |
| PSAD ≥0.17 | 1.51 | 2.98-9.99 | |
| PSAD ≥0.23 | 1.49 | 2.08-9.49 | |
| PSA | 0.05 | 0.99-1.11 | 0.059 |
| > Volume da próstata | 0.02 | 1.01-1.04 | 0.008* |
| Núcleos de biópsia positivos | 0.06 | 0.98-1.18 | 0.24 |
| Obesidade | 0.31 | 0.54-3,40 | 0,507 |
| DM | 0,61 | 0,79-4.27 | 0.152 |
| HBP | 0.10 | 0.53-2.29 | 0.775 |
BMI: índice de massa corporal; PSA: antigénio específico da próstata; PSAD: densidade do antigénio específico da próstata; DM: diabetes mellitus; HBP: tensão arterial elevada.
Discussão
Estudos transversais encontraram uma falta de concordância entre o relatório de GS da biópsia da próstata e o relatório da prostatectomia radical. Em uma meta-análise recente, incluindo 14.839 pacientes, os autores estimaram uma atualização do GS em 30% dos pacientes, com apenas 63% permanecendo inalterado após a prostatectomia.22 Gleason upgrade foi encontrado em 29-58% dos casos,23 e é pior no subgrupo de pacientes com biópsia GS 3+3 (até 63,3%).14 Em nosso centro hospitalar, encontramos um upgrade GS em 42,1% de todos os pacientes que foram submetidos à prostatectomia radical e em 43,2% dos pacientes com um escore de Gleason de biópsia de 3+3,
Muitos autores têm tentado encontrar preditores de upgrade GS, particularmente com a popularidade atualmente crescente dos protocolos AS. Os preditores anteriormente descritos são: idade >60 anos, valor PSA >5,0ng/ml e >25% de núcleos positivos durante a biópsia.24
PSAD foi analisado e vários valores de corte foram descritos (como ≥0.13ng/ml, ≥0.15ng/ml e ≥0.23ng/ml).11,13,16,17 No entanto, não há consenso sobre o uso deste valor para prever com precisão uma atualização do GS. Com base em nossos resultados, propusemos um valor de corte de ≥0.17ng/ml, que tinha uma AUC de 0,675, sensibilidade de 75,9%, especificidade de 59,2%, VPP de 58,5%, e VPL de 76,3% para a previsão do upgrade da GS. Selecionamos este ponto de corte, pois ao analisarmos outros valores propostos em relação à nossa série de casos, obtivemos a melhor AUC com um valor ≥0,23ng/ml (0,678), porém com uma sensibilidade pior e uma alta taxa de falsos negativos (33,33%). Por outro lado, quando utilizamos os valores ≥0.13ng/ml e ≥0.15ng/ml, eles apresentaram uma taxa de falsos positivos de 59% e 49%, respectivamente. A taxa de falsos negativos e a taxa de falsos positivos do corte proposto pela nossa equipa foi de 24% e 41%, respectivamente, o que consideramos ser o mais útil. Fig. 2 mostra um gráfico da nossa população.

A população do estudo, mostrando as diferentes densidades de antígenos específicos da próstata e dados de atualização.
Nosso estudo incluiu apenas pacientes com biópsia GS de 3+3, devido à importância desta variável ao considerar um paciente para AS. Considerando que existem outros fatores levados em consideração para a vigilância ativa, não podemos declarar que o risco de atualização de GS e PSAD estão determinando variáveis para propor uma estratégia terapêutica, mas definitivamente acreditamos que elas devem ser discutidas antes de tomarmos uma decisão. Uma segunda biópsia poderia ser indicada para pacientes com PSAD ≥0.17ng/ml, considerando o risco de subclassificação, a fim de corroborar a GS. As biópsias de fusão da próstata e as biópsias de fusão guiadas por ressonância magnética têm demonstrado alta sensibilidade e especificidade para a localização de câncer significativo não identificado.25 Entretanto, estas opções não estão amplamente disponíveis no México, portanto, a saturação transretal guiada por ultra-som ou biópsia de modelo poderia ser uma opção mais viável para aumentar a precisão diagnóstica.
Evidências recentes sugerem uma associação entre os diferentes componentes da síndrome metabólica e o câncer de próstata, aumentando o risco de se apresentar com a doença e morrer dela,21 bem como uma maior taxa de recorrência bioquímica após tratamento radical.22 Entretanto, em nosso estudo não pudemos demonstrar associação com a atualização do escore de Gleason.
Volume do próstata, que está diretamente relacionado à idade, poderia ser um elemento de distração. Quando uma biópsia aleatória guiada por ultra-som é realizada em uma grande próstata, há um risco potencial de deixar áreas maiores sob amostragem, o que representa um risco maior de faltar um tumor significativo.
AS tem proporcionado resultados promissores em pacientes com câncer de próstata de baixo risco, com melhorias na qualidade de vida, preservação da função erétil e continência urinária, e em outras complicações associadas aos tratamentos radicais.6 No entanto, há um risco de diagnosticar mal um câncer agressivo e retardar o tratamento oportuno, afetando o prognóstico do paciente. Há muitos critérios para a seleção de candidatos AS, sendo a classificação de risco D’Amico26 e os critérios Epstein27 os mais utilizados para este fim. O primeiro não inclui PSAD, mas nos critérios Epstein sugere-se o uso de um valor de corte ≥0.15ng/ml. Em nosso hospital, usamos critérios muito rigorosos e o valor de corte do PSAD ≥0.17ng/ml será incluído como parte da discussão ao selecionar um possível candidato para AS.
O caráter retrospectivo de nosso estudo foi sua principal limitação. A amostra potencial foi reduzida ainda mais devido a dados incompletos nos registros de casos clínicos. Outra limitação foi o fato de não termos todos os dados das amostras da biópsia, de modo que não pudemos analisar pacientes com o critério completo de AS. Entretanto, com a quantidade de pacientes incluídos no estudo, foram obtidos resultados significativos e estes podem ser usados para considerar o risco de atualização da GS em pacientes com GS 3+3,
Conclusões
Concluímos que é importante usar o maior número possível de ferramentas para tomar decisões precisas e identificar os pacientes com alto risco de atualização patológica que possam se beneficiar de uma avaliação mais meticulosa e/ou tratamento agressivo. O PSAD deve ser usado rotineiramente para identificar pacientes com câncer aparentemente de baixo risco em risco de atualização de GS, resultando em uma seleção mais precisa de candidatos a AS. De acordo com nossos dados, podemos evitar um estadiamento de GS potencialmente incorreto em aproximadamente 43% dos casos.
Nós encontramos uma alta frequência de atualização de GS em nossa população. Em nosso estudo, os valores de PSAD foram significativamente associados à atualização e o valor de corte mais preciso foi de 0,17ng/ml2. Recomendamos que uma revisão local do risco de atualização do GS e seus potenciais preditores seja realizada em todos os centros hospitalares antes de oferecer vigilância ativa aos potenciais candidatos.
Divulgações éticasProteção de sujeitos humanos e animais
Os autores declaram que nenhum experimento foi realizado em humanos ou animais para este estudo.
Confidencialidade dos dados
Os autores declaram que nenhum dado de paciente aparece neste artigo.Os autores declaram que nenhum dado de paciente aparece neste artigo.
Direito à privacidade e consentimento informado
Os autores declaram que nenhum dado de paciente aparece neste artigo.
Financiamento
Não foi recebido nenhum endosso de qualquer tipo para realizar este artigo.
Conflito de interesse
Os autores declaram que não têm nenhum conflito de interesse, não receberam nenhum patrocínio para o estudo.