Considerar uma reacção de substituição nucleofílica geral.
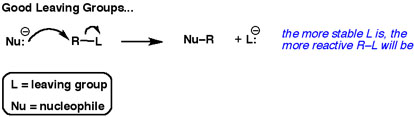
A segunda seta mostra sempre um par de electrões a ir em direcção ao grupo de saída.
Os melhores grupos de saída “querem” esses electrões. Eles não querem compartilhá-los com outros átomos.
Os melhores grupos que saem são bases fracas.
As bases fracas têm ácidos conjugados fortes. Então podemos identificar bases fracas olhando para uma tabela.
Cautela: O valor #”p “K_”a “# mede a posição de um equilíbrio. Mas deixar a habilidade do grupo é baseado em taxas de reação. Assim, embora a correlação seja boa, não é perfeita.

Em geral, quanto mais fraca a base, melhor o grupo de saída.
Excepção: O flúor é um grupo de saída pobre.
F- é um pequeno íon. A sua alta densidade de carga torna-o relativamente impolarizável. O grupo de saída precisa ser polarizável para diminuir a energia do estado de transição. Você nunca deve ver F- sair em uma reação #”S”_”N “2#.
Question: Porque é que a água é um bom grupo de saída?
Answer#color(branco)(ll)#: Não é! Hydronium ion is the leaving group.
Explicação:
Considerar o equilíbrio
#”R-OH ⇌ R”^”+” + underbrace(“OH”^”-“)_color(red)(“conj. base de H”_2 “O”)#
A água é um ácido fraco, por isso o ião hidróxido é uma base forte. Ele “quer” usar seus pares de elétrons solitários para formar uma ligação covalente.
Assim, a posição de equilíbrio fica longe à esquerda.
Se protonarmos o álcool, obtemos
#”R-“stackrelcolor(blue)(+)(“O”) “H”_2 ⇌ “R”^”+” + underbrace(“OH”_2)_color(red)(“conj. A base de H”_3 “O”^”+”)#
A água é a base conjugada do íon hydronium, o ácido mais forte que pode existir na água.
A água é uma base fraca.
Tem pouca tendência a partilhar os seus pares de electrões com outras espécies.
A água na forma de íon-hidrónio é um excelente grupo de saída.
Aqui está um vídeo sobre o que faz um bom grupo de saída.