Introdução
Neutrófilos são a população mais abundante de glóbulos brancos circulantes e a primeira linha de defesa do hospedeiro contra patógenos invasores . Em condições normais, os neutrófilos circulantes têm uma semi-vida de 6-12 h e são funcionalmente quiescentes. Durante a inflamação, os neutrófilos chegam rapidamente aos locais de infecção e lesão, aumentam a atividade antimicrobiana e morrem dentro do tecido infiltrado. Eles desempenham papéis importantes no sistema imunológico inato, e respostas neutrófilas significativas são observadas na inflamação sistêmica, como trauma, lesão por queimadura, sepse e grandes cirurgias .
No entanto, a desregulação das respostas neutrófilas, como liberação excessiva ou descontrolada de citocinas pró-inflamatórias, pode causar danos ao tecido hospedeiro ou órgãos durante a sepse grave, e doenças auto-imunes .
Terapia de remoção de leucócitos (LRT), leucocitaférese (LCAP), ou aférese granulocitária/monocitária (GMA) é um método de aférese terapêutica que remove os leucócitos periféricos através da circulação extracorpórea. Tem sido usado como tratamento não farmacológico na colite ulcerativa (UC) e na doença de Crohn (DC), e tem mostrado uma excelente eficácia a curto prazo .
LCAP usando Cellsorba, uma coluna de fibras de polietileno teleftalato (Asahi-Kasei Medical, Tokyo, Japão), tem sido relatado para remover ~100% dos granulócitos/monócitos, ~60% dos linfócitos, e ~50% das plaquetas tanto da entrada como da saída do aparelho Cellsorba . Embora os mecanismos exatos da TRL não tenham sido totalmente explorados, seus mecanismos potenciais foram relatados, que incluem uma redução no número de leucócitos ativados ou citocinas pró-inflamatórias, como o fator de necrose tumoral (TNF)-α, interleucina (IL)-1β, IL-6 e IL-8 .
Infecção do local cirúrgico (ISC) continua sendo uma das causas mais comuns de morbidade em grandes cirurgias, o que prolonga a hospitalização e aumenta os custos médicos . A vigilância multicêntrica prospectiva japonesa mostrou que 19,5% dos pacientes com CU desenvolveram SSI após a cirurgia .
Em um estudo caso-controle, comparamos retrospectivamente a incidência de SSIs entre pacientes submetidos à proctocolectomia com anastomose de bolsa ileal (IPAA) (n=29) e aqueles submetidos ao IPAA com LCAP pós-operatória (n=43). O LCAP pós-operatório reduziu significativamente a incidência de LES em pacientes UC submetidos à proctocolectomia com IPAA (p<0,01) . Em um estudo prospectivo multicêntrico que realizamos, a incidência de LES foi comparada entre os pacientes CU submetidos à cirurgia (grupo controle; n=103) e aqueles submetidos à cirurgia com LCAP pós-operatória (n=40). Os LSIs ocorreram em 4 de 37 pacientes (10,8%) no grupo LCAP, enquanto ocorreram em 29 de 103 pacientes (28,2%) no grupo controle, embora a diferença não tenha alcançado significância estatística (p=0,069) .
Estas observações clínicas sugerem que o LCAP remove os leucócitos ativados pró-inflamatórios produtores de citocinose no pós-operatório de inflamação sistêmica devido à cirurgia colorretal importante, e pode suprimir a ocorrência de LSIs. Temos relatado uma associação entre disfunção neutrófila e complicações infecciosas pós-operatórias .
Neutrófilos são as células mais abundantes entre os leucócitos circulantes e podem ser as mais freqüentemente removidas pelo LCAP . Assim, focamos nas funções dos neutrófilos circulantes isolados antes e depois da LCAP, para esclarecer os mecanismos terapêuticos da LCAP pós-operatória sobre a ocorrência de LES em pacientes com CU após a cirurgia.
Materiais e Método
Patientes
Três pacientes com CU submetidos ao IPAA receberam LCAP pós-operatória no Departamento de Cirurgia Gastrointestinal e Pediátrica da Faculdade de Medicina da Universidade de Mie Graduate School of Medicine de 2004 a 2008. O diagnóstico da UC foi baseado em dados clínicos, radiográficos, endoscópicos, cirúrgicos e histopatológicos. Antes da cirurgia, os pacientes recebiam vários tratamentos médicos, incluindo anti-inflamatórios (aminossalicilatos, corticosteróides) ou imunossupressores (azatioprina, mercaptopurina, ciclosporina), ou ambos. O LCAP pós-operatório foi realizado uma vez dentro de 2 horas após a cirurgia. Pacientes com sintomas clínicos de sepse foram excluídos do estudo. Pacientes com hemodinâmica instável após a cirurgia também foram excluídos de acordo com o protocolo. O consentimento livre e esclarecido por escrito foi obtido de todos os pacientes antes do início deste estudo, que foram realizados de acordo com a Declaração de Helsinki e foram aprovados pelo Comitê de Revisão Institucional (No. 474).
Isolamento dos neutrófilos Neutrófilos
Neutrófilos pré e pós LCAP foram isolados dos mesmos pacientes antes e após a cirurgia. O isolamento dos neutrófilos foi baseado em um procedimento previamente descrito. As amostras de sangue (10 ml) foram diluídas com um volume igual de tampão fosfato salino (PBS), em camadas sobre um volume de Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canadá) e centrifugadas a 600 × g durante 30 min à temperatura ambiente. Após a remoção das células mononucleares, plasma e Ficoll-Paque PLUS, o sedimento foi ressuspenso em 12 mL de solução de cloreto de amônio para lisar os glóbulos vermelhos, lavado duas vezes em PBS, e ressuspenso em PBS. Os neutrófilos foram lavados duas vezes com PBS e ressuspendidos em TCM-10 . As preparações celulares foram testadas para viabilidade (>99%) por exclusão do azul de tripano e para pureza (>95% CD13+, CD33+ granulócitos) por citometria de fluxo.
Atividade fagocitária
Atividade fagocitária ex vivo dos neutrófilos circulantes contra Escherichia coli foi comparada entre neutrófilos pré e pós-CLAP isolados de pacientes idênticos.
Fagocitose Neutrofílica foi medida usando biopartículas fluorescentes . Para opsonizar as biopartículas bacterianas, o reagente opsonizador reconstituído e as biopartículas bacterianas (5 × 105) foram misturados, vortexados e incubados durante 1 h a 37°C em uma incubadora umedecida de 5% de CO2. Após duas lavagens com PBS, separadas por centrifugação a baixa velocidade (1500 × g, 15 min, 4°C), as pastilhas foram incubadas com neutrófilos (5 × 105) em 1 mL de meio sem antibióticos durante 3 h a 37°C numa incubadora humidificada a 5% de CO2. Após 3 h de incubação, a atividade fagocitária dos neutrófilos contra E. coli foi analisada usando um FACScan (Becton-Dickinson, San Jose, CA, EUA) e 10.000 eventos foram contados por amostra.
Preparação de E. coli. coli
Escherichia coli (ATCC25922) foi adquirida da American Type Culture Collection (Manassas, VA, EUA), e cultivada na Modified Eagle’s Medium (Invitrogen, Tokyo, Japão) da Dulbecco por 10 h a 37°C. O meio de cultura foi centrifugado a 1.700 × g durante 10 min à temperatura ambiente para obter um pellet, que foi lavado duas vezes e ressuspenso em solução salina estéril normal. Uma alíquota (100 μL) da suspensão foi diluída em série com solução salina estéril, banhada em Agar-B (Qbiogene, Carlsbad, CA, EUA), e incubada durante 18 h para determinar a concentração bacteriana. O restante foi armazenado a -80°C até o uso.
Co-cultura de neutrófilos com E. coli
Apenas antes do uso, a suspensão de E. coli foi diluída em meio para alcançar uma concentração final de 2,5 × 106 ufc/mL. Após a opsonização da E. coli usando soro autólogo por 30 min a 37°C, os neutrófilos (2,5 × 105 /mL) foram coculurados em 1 mL de meio sem antibióticos por 3 h a 37°C em uma incubadora umidificada de 5% de CO2. Após centrifugação das células a 600 × g por 10 min a 4°C, os sobrenadantes foram coletados para analisar a produção de citocinas, elastase neutrofílica (NE) e viabilidade dos neutrófilos.
Viabilidade dos neutrófilos em circulação
Viabilidade dos neutrófilos em circulação contra E. coli foi comparada entre neutrófilos pré e pós-CLAP isolados de pacientes idênticos. Para avaliar a viabilidade dos neutrófilos após co-cultura com E. coli, foi realizado um ensaio de apoptose .
Apoptose de neutrófilos após co-cultura com E. coli foi quantificada por citometria de fluxo usando um Kit de Detecção de Apoptose Anexo em V (BioVision Research Products, Palo Alto, CA, EUA). Os neutrófilos foram incubados em 1X tampão de ligação, ao qual foram adicionados 5 μL isotiocianato de fluoresceína V (FITC) e 5 μL iodeto de propidium (PI). Após incubação à temperatura ambiente durante 5 min no escuro, as células foram analisadas usando um FACScan e 10.000 eventos foram contados por amostra.
A combinação de Anexoin V-FITC e PI foi capaz de distinguir entre células apoptóticas precoces (Anexoin V+, PI-), células necróticas (Anexoin V-, PI+), células apoptóticas tardias ou necróticas secundárias (Anexoin V+, PI+) e células viáveis (Anexoin V-, PI-).
Ensaio imunoenzimático (ELISA)
Citocinas no soro de pacientes antes e depois da LCAP e sobrenadantes após co-cultura de neutrófilos pré e pós LCAP com E. coli foram medidas pelo ELISA de acordo com as instruções do fabricante. As citocinas incluíram TNF-α, IL-1 antagonista do receptor (IL-1Ra), IL-6, IL-8, e NE. Os kits ELISA de TNF-α, IL-1Ra, IL-6 e IL-8 foram adquiridos de R&D Systems (Minneapolis, MN, EUA). O kit NE ELISA foi adquirido da Immundiagnostik (Bensheim, Alemanha). Os limites de detecção de TNF-α, IL-1Ra, IL-6, IL-8 e NE foram 1, 2, 0,01, e 2 pg/mL e 0,12 ng/mL, respectivamente, e os níveis abaixo desses limites foram considerados indetectáveis. O nível de cada citocina foi avaliado em duplicata e o valor médio das citocinas foi calculado.
Análise estatística
Todas as análises estatísticas foram feitas usando JMP versão 5 (SAS Institute, Cary, NC, EUA). As associações entre variáveis contínuas e categóricas foram avaliadas usando o teste Mann-Whitney U ou o teste t pareado quando apropriado. P<0,05 foi considerado estatisticamente significativo.
Resultados
Características da paciente
Vinte e nove pacientes UC submetidos ao IPAA receberam LCAP pós-operatório. As características dos pacientes são mostradas na Tabela 1. A idade média ao diagnóstico foi de 27 anos (variação de 15-54 anos) e a idade média na cirurgia foi de 33 anos (variação de 16-61 anos). A duração da doença foi de 6,9 anos (faixa de 0,1-28 anos). A colite do lado esquerdo foi em 6/29 (21%) pacientes e a pan-colite em 23/29 (79%) pacientes. A gravidade da colite foi classificada em leve (7; 24%), moderada (11; 38%) e grave (4; 38%).
| Características da paciente | |
|---|---|
| Variáveis | Patientes (n=29) Número |
| Gênero | |
| Homem | 19 |
| Feminino | 10 |
| Termo do diagnóstico | 27( 15-54) |
| Idade na cirurgia | 33(16-61) |
| Duração da doença | 6.9 (0.1-28) |
| Severidade da doença | |
| mild | 7 |
| moderado | 11 |
| severe | 4 |
| Prazo da doença | |
| Esquerda…colite lateral | 6 |
| Pan- colitis | 23 |
| Sistema de classificação de maltes | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Dose total de esteróides (mg) | 17285 (800-70000) |
| Utilização de imunossupressores | |
| Sim | 5 |
| Não | 24 |
| Tempo de operação (min) | 262.4 (118-496) |
| Perda de carga (ml) | 307,9 (17-826) |
Tabela 1: Características do paciente.
>
Mudança de curso temporal nos leucócitos, neutrófilos e plaquetas
LBC, neutrófilos e plaquetas foram contados antes da cirurgia, antes do LCAP (após a cirurgia), e após o LCAP (dentro de 12 horas após o LCAP), respectivamente. Como mostrado na Figura 1, a contagem de leucócitos, neutrófilos e plaquetas foi significativamente menor após a LCAP do que antes da LCAP. Todos os pacientes que receberam LCAP pós-operatório não tiveram efeito adverso hematológico.
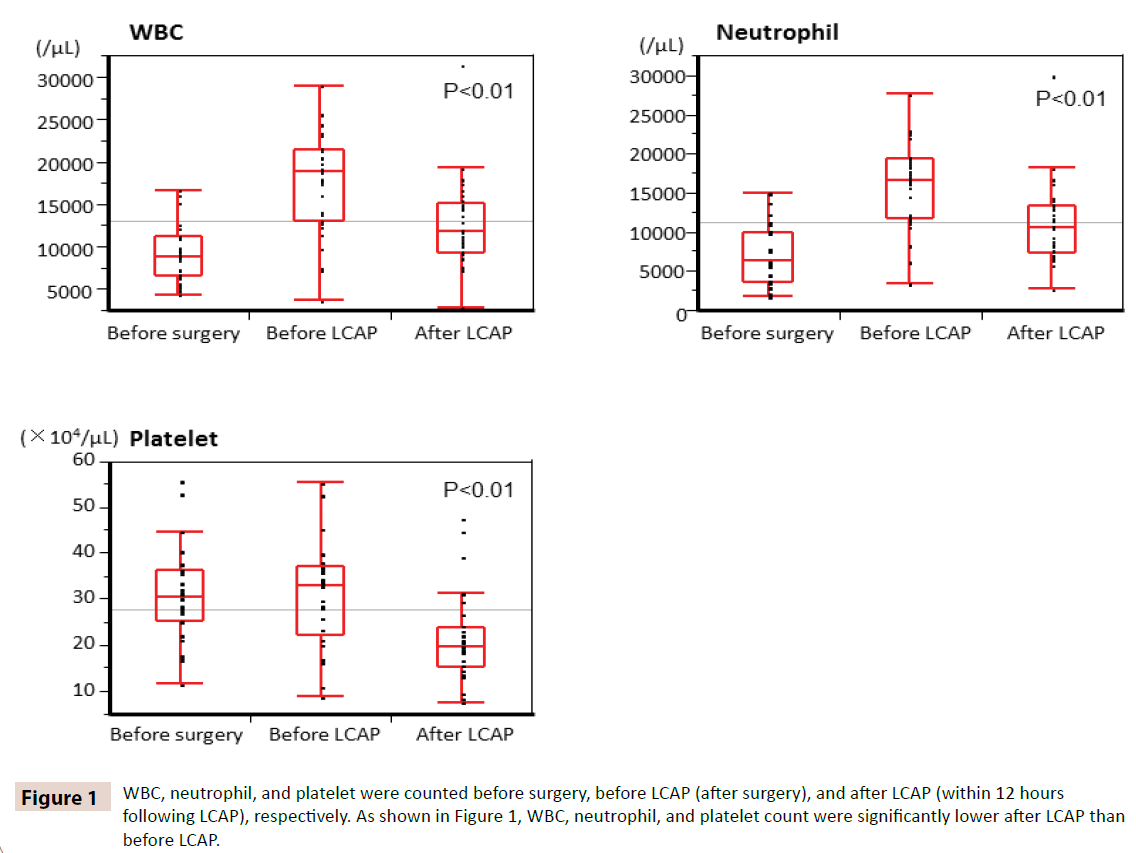
Figure 1: leucócitos, neutrófilos e plaquetas foram contados antes da cirurgia, antes do LCAP (após a cirurgia) e após o LCAP (dentro de 12 horas após o LCAP), respectivamente. Como mostrado na Figura 1, os leucócitos, neutrófilos e plaquetas foram significativamente menores após LCAP do que antes LCAP.
Atividade fagocitária dos neutrófilos contra E. coli
Para esclarecer se LCAP influencia a atividade fagocitária dos neutrófilos circulantes, a atividade fagocitária contra E. coli foi comparada entre neutrófilos pré e pós LCAP. Como mostrado na Figura 2, nenhuma diferença significativa na atividade fagocítica dos neutrófilos (intensidade fluorescente média) contra E. coli foi observada entre os neutrófilos pré-LCAP (mediana 1259,4, intervalo 50,8-3505,6) e pós LCAP (mediana 1077,6, intervalo 24,4-4152,1) (P=0,72). Estes resultados sugerem que o LCAP não afecta a actividade fagocitária dos neutrófilos circulantes contra E. coli.
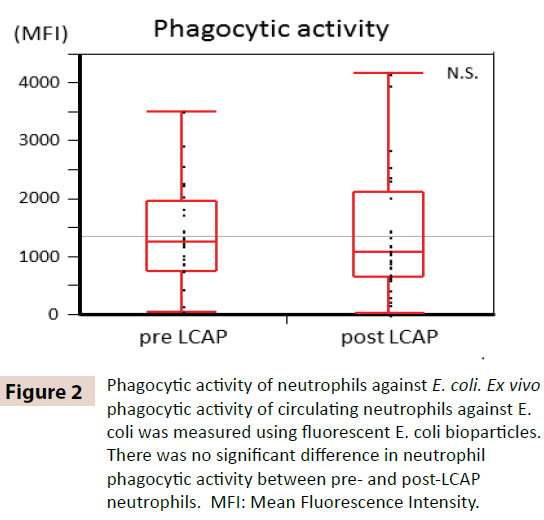
Figure 2: Actividade fagocitária dos neutrófilos contra E. coli. Atividade fagocítica ex vivo dos neutrófilos circulantes contra E. coli foi medida usando biopartículas fluorescentes de E. coli. Não houve diferença significativa na atividade fagocítica dos neutrófilos neutrófilos entre os neutrófilos pré e pósLCAP. IFM: Intensidade média de fluorescência.
Neutrofilo viabilidade após co-cultura com E. coli
Para esclarecer se o LCAP influencia a resposta dos neutrófilos contra infecção bacteriana, a viabilidade dos neutrófilos contra E. coli foi comparada entre os neutrófilos pré e pós LCAP. As percentagens de células viáveis (Annexin V-, PI-), células apoptóticas precoces (Annexin V+, PI-), células necróticas (Annexin V-, PI+), e células apoptóticas tardias ou necróticas secundárias (Annexin V+, PI+) foram comparadas entre neutrófilos pré e pós-CLAP. Como mostrado na Figura 3, a porcentagem mediana de neutrófilos viáveis coculurados com E. coli foi maior no pós-CLAP (mediana 34.2%, intervalo 1.16-77.7%) do que no pré-CLAP (mediana 27.9%, intervalo 0.53-89.7%) neutrófilos, embora a diferença não tenha alcançado significância estatística(P=0.82). A porcentagem de neutrófilos necróticos coculaturados com E. coli foi significativamente reduzida em pós-LCAP (mediana 0.73%, variação 0.0-26.0%) do que em pré-LCAP (mediana 1.14%, variação 0.0-26.0%) neutrófilos (P=0.0232).
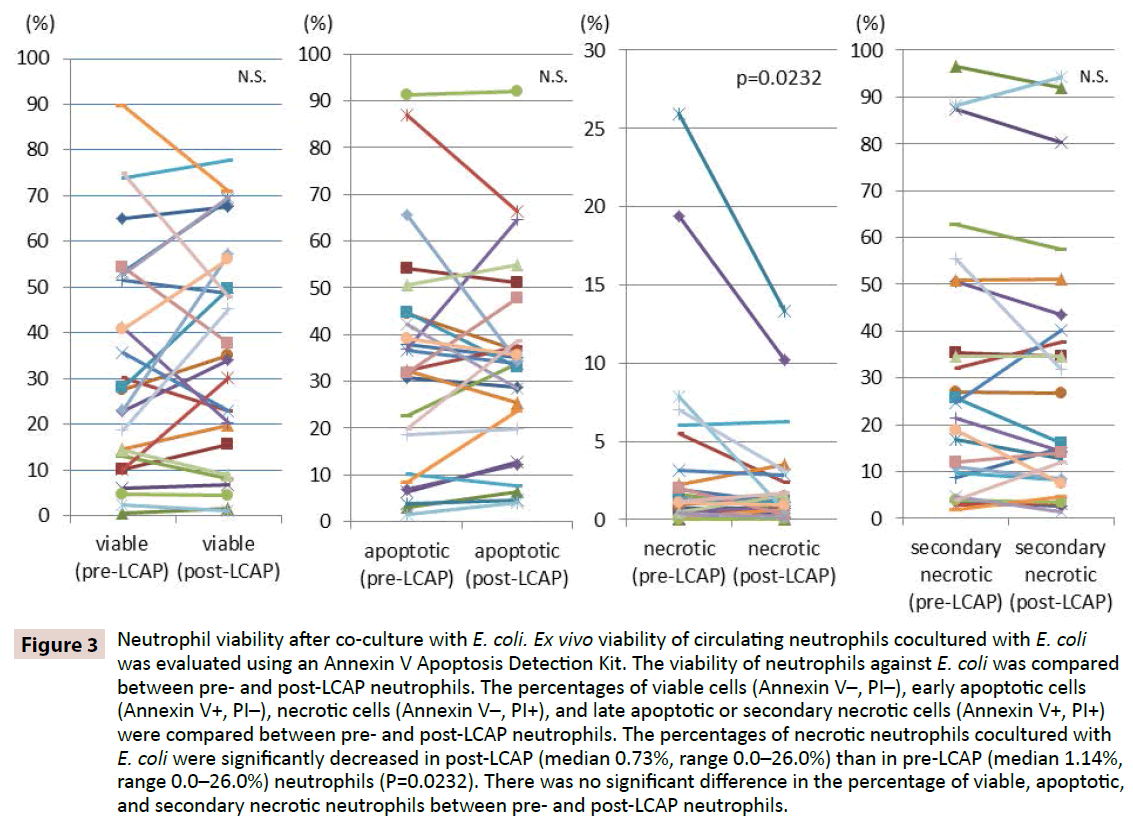
Figure 3: Viabilidade dos neutrófilos após co-cultura com E. coli. A viabilidade ex vivo dos neutrófilos circulantes coculaturados com E. coli foi avaliada usando um Kit de Detecção de Apoptose Anexo em V. A viabilidade dos neutrófilos contra E. coli foi comparada entre os neutrófilos pré e pós-CLAP. As percentagens de células viáveis (Annexin V-, PI-), células apoptóticas precoces (Annexin V+, PI-), células necróticas (Annexin V-, PI+), e células apoptóticas tardias ou necróticas secundárias (Annexin V+, PI+) foram comparadas entre neutrófilos pré e pós-CLAP. As porcentagens de neutrófilos necróticos coculaturados com E. coli foram significativamente diminuídas nos neutrófilos pós-LCAP (mediana 0.73%, intervalo 0.0-26.0%) do que nos neutrófilos pré-LCAP (mediana 1.14%, intervalo 0.0-26.0%) (P=0.0232). Não houve diferença significativa na percentagem de neutrófilos viáveis, apoptóticos e necrófilos secundários entre os neutrófilos pré e pós-LCAP.
Não houve diferença significativa na percentagem de neutrófilos apoptóticos coculturados com E. coli entre neutrófilos pré LCAP (mediana 32.3%, intervalo 1.51-91.2%) e pós LCAP (mediana 33.8%, intervalo 4.0-92.1%) neutrófilos (P=0.57). Nenhuma diferença significativa na porcentagem de neutrófilos apoptóticos tardios ou necróticos secundários coculaturados com E. coli também foi observada entre neutrófilos pré LCAP (mediana 23.1%, variação 1.81-96.5%) e pós LCAP (mediana 16.1%, variação 1.44-94.3%) (P=0).13).
Estes resultados sugerem que a LCAP pode diminuir o subconjunto distinto de neutrófilos circulantes que induzem necrose contra infecção bacteriana, e aumentar o número de neutrófilos viáveis (provavelmente não aparados) na circulação sistêmica.
Produção de citocinas pelos neutrófilos após cocultura com E. coli
Para esclarecer se o LCAP influencia a produção de citocinas pelos neutrófilos circulantes, os níveis de citocinas nos sobrenadantes de cultura após co-cultura com E. coli foram comparados entre neutrófilos pré e pós LCAP. Como mostrado na Figura 4, não houve diferença significativa nos níveis de NE, TNF-α, IL-6, IL-8 e IL-1Ra em sobrenadantes em cultura entre os neutrófilos pré e pós LCAP. Esses resultados sugerem que o LCAP não afeta a produção de citocinas dos neutrófilos circulantes contra E. coli.
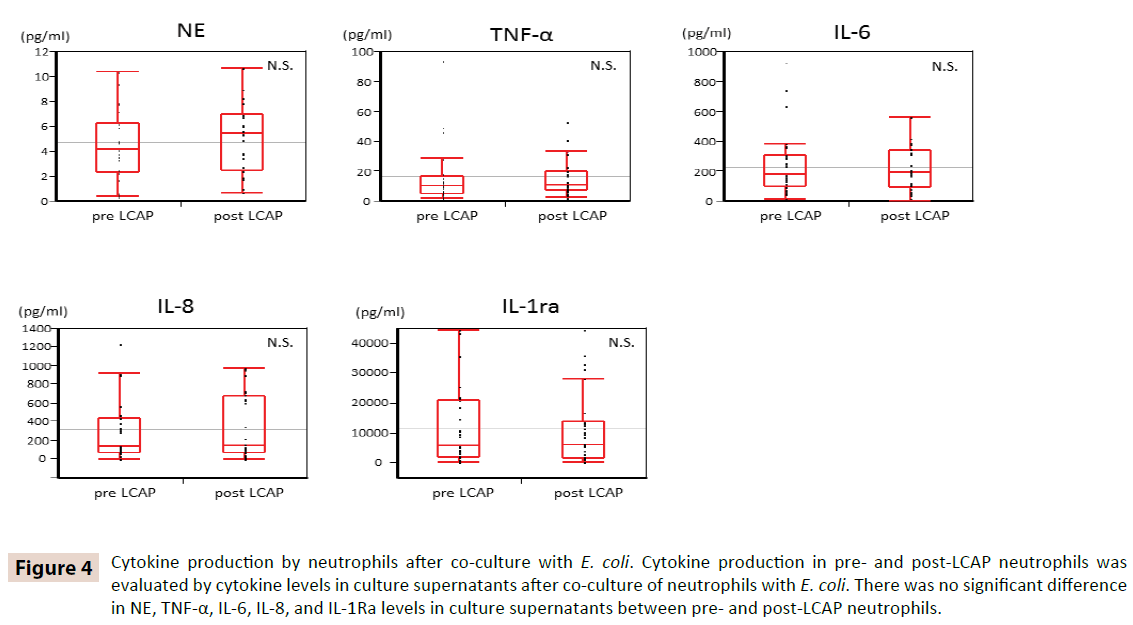
Figure 4: Produção de citocinas por neutrófilos após co-cultura com E. coli. A produção de citocinas nos neutrófilos pré e pós-LCAP foi avaliada pelos níveis de citocinas em sobrenadantes de cultura após a co-cultura de neutrófilos com E. coli. Não houve diferença significativa nos níveis de NE, TNF-α, IL-6, IL-8 e IL-1Ra em sobrenadantes em cultura entre neutrófilos pré e pós LCAP.
>
Citoquinas do soro antes e depois da LCAP
Para esclarecer se a LCAP influencia a resposta inflamatória sistêmica do hospedeiro, as citocinas do soro foram medidas usando amostras de sangue coletadas antes e depois da LCAP. Como mostrado na Figura 5, o NE sérico após LCAP (mediana de 5,62 pg/mL, variação de 0,16-10,4 pg/mL) foi significativamente maior do que antes de LCAP (mediana de 2,87 pg/mL, variação de 0,15-7,61 pg/mL) (P=0,0251). Não foi encontrada diferença significativa nos níveis séricos de TNF-α, IL-6, IL-8 e IL-1Ra antes e depois da LCAP.
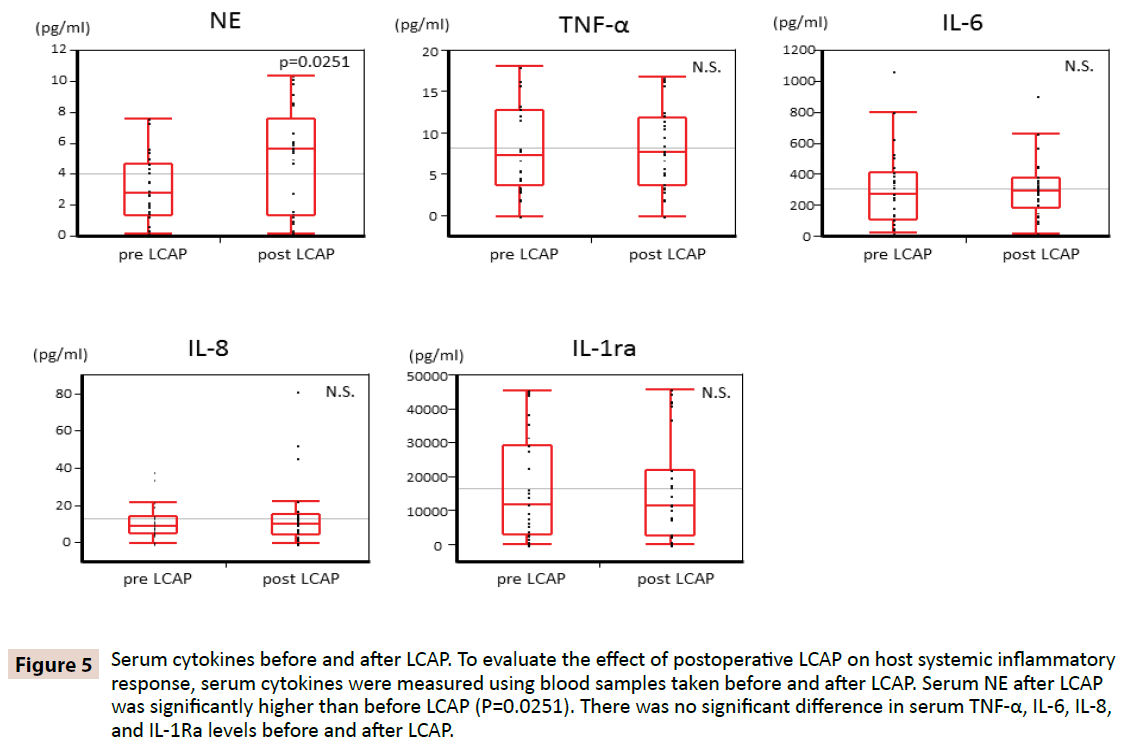
Figure 5: Citocinas séricas antes e depois da LCAP. Para avaliar o efeito da LCAP pós-operatória na resposta inflamatória sistêmica do hospedeiro, as citocinas séricas foram medidas usando amostras de sangue coletadas antes e depois da LCAP. O NE sérico após LCAP foi significativamente maior do que antes da LCAP (P=0,0251). Não houve diferença significativa nos níveis séricos de TNF-α, IL-6, IL-8, e IL-1Ra antes e depois da LCAP.
Associações das funções neutrófilas pós LCAP com o tempo de operação ou contagem de neutrófilos pós-operatória
Para esclarecer se as funções neutrófilas circulantes após LCAP influenciam a ocorrência de LES, examinamos a associação entre atividade fagocitária ou produção de citocinas dos neutrófilos pós LCAP e fatores de risco de LES relacionados ao estresse cirúrgico, como tempo de operação, perda de sangue e contagem de neutrófilos pós-operatória.
Como mostrado na Figura 6, NE nos sobrenadantes após co-cultura de neutrófilos pósLCAP com E. coli foi significativamente maior em pacientes com tempo de operação >3 h (mediana de 5,65 pg/mL, variação de 0,97-10.7 pg/mL) do que naqueles com tempo de operação <3 h (mediana 1,05 pg/mL, intervalo 0,72-2,44 pg/mL) (P=0,0158).
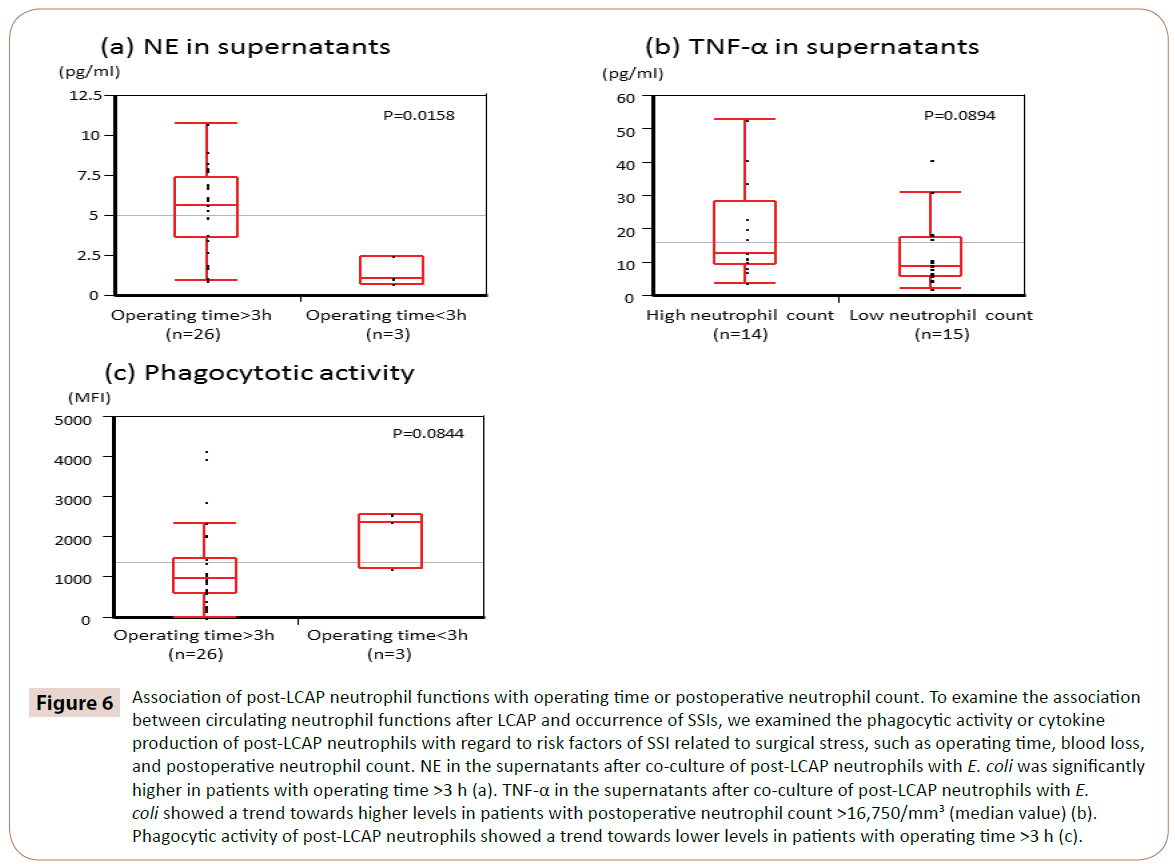
Figure 6: Associação das funções neutrófilas pósLCAP com tempo de operação ou contagem de neutrófilos pós-operatória. Para examinar a associação entre as funções de neutrófilos circulantes após LCAP e a ocorrência de SSIs, examinamos a atividade fagocitária ou produção de citocinas dos neutrófilos pósLCAP com relação aos fatores de risco de SSI relacionados ao estresse cirúrgico, como tempo de operação, perda de sangue e contagem de neutrófilos pós-operatória. NE nos sobrenadantes após co-cultura de neutrófilos pósLCAP com E. coli foi significativamente maior em pacientes com tempo de operação >3 h (a). TNF-α nos sobrenadantes após a co-cultura de neutrófilos pósLCAP com E. coli mostrou uma tendência para níveis mais elevados em pacientes com contagem de neutrófilos pós-operatória >16.750/mm3 (valor mediano) (b). A atividade fagocitária dos neutrófilos pósLCAP mostrou uma tendência a níveis mais baixos em pacientes com tempo de operação >3 h (c).
TNF-α nos sobrenadantes após co-cultura de neutrófilos pósLCAP com E. coli mostrou uma tendência para níveis mais altos em pacientes com contagem de neutrófilos pós-operatória >16.750/mm3 (valor mediano) (P=0,0894).
Atividade fagocitária dos neutrófilos pósLCAP contra E. coli mostrou uma tendência para níveis mais baixos em pacientes com tempo de operação >3 h (P=0,0844).
Associações entre os níveis séricos de TNF-α após LCAP e SSI
Para esclarecer se a resposta inflamatória sistêmica do hospedeiro após LCAP influencia a ocorrência de SSI, examinamos a associação entre os níveis séricos de citocinas após LCAP e a ocorrência de SSI.
Como mostrado na Figura 7, o TNF-α sérico após LCAP mostrou uma tendência a níveis mais altos em pacientes que desenvolveram SSI do que naqueles que não o fizeram (P=0,0714).
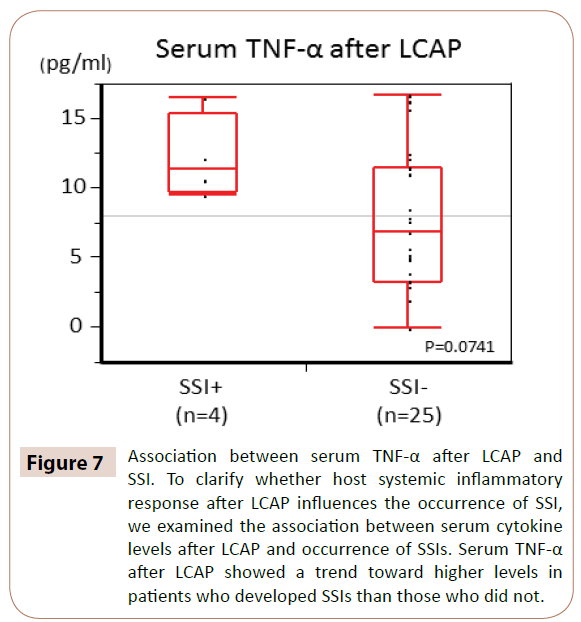
Figure 7: Associação entre TNF-α sérico após LCAP e SSI. Para esclarecer se a resposta inflamatória sistêmica do hospedeiro após LCAP influencia a ocorrência de SSI, nós examinamos a associação entre os níveis séricos de citocinas após LCAP e a ocorrência de SSIs. A TNF-α sérica após LCAP mostrou uma tendência a níveis mais altos em pacientes que desenvolveram LES do que aqueles que não o fizeram.
Não houve diferença significativa entre os níveis séricos de IL-6, IL-8 e IL-1Ra após LCAP e ocorrência de LES.
Discussão
Severa possíveis mecanismos de ação de LCAP ou GMA, embora seus mecanismos exatos não tenham sido completamente investigados. A variabilidade dos resultados parece depender das diferenças nas células sanguíneas utilizadas nas análises (granulócitos, monócitos ou linfócitos), dos métodos de colheita de sangue (retirados da linha de entrada ou saída, ou da veia periférica), e dos sujeitos do estudo (voluntários saudáveis ou doentes).
A maioria dos investigadores utilizou leucócitos como neutrófilos, monócitos, ou linfócitos retirados das linhas de entrada e saída de um dispositivo de circulação extracorpórea . Os leucócitos das linhas de saída são as células restantes filtradas pelo LCAP. Eles retornam imediatamente à circulação sistêmica dos pacientes e são remixados com os leucócitos circulantes. Os leucócitos das linhas de saída são a pequena proporção de todos os leucócitos circulantes após o LCAP. Para esclarecer o efeito sistêmico do LCAP no sistema imunológico do hospedeiro, usamos neutrófilos circulantes isolados de veias periféricas de pacientes UC.
Estritamente falando, a leucocitaférese (LCAP) deve ser chamada de leucocitofiltração porque pode não só remover os leucócitos, mas também ativá-los através do filtro. De facto, a LCAP não pode absorver e remover todas as células sanguíneas que nela entraram. O certo número de células sanguíneas pode passar através do filtro e depois voltar à circulação. Pensa-se que as células sanguíneas filtradas são activadas pela filtração de LCAP.
Neutrófilos são a população mais abundante de leucócitos e as células removidas de forma mais eficiente pelo LCAP. O número estimado de leucócitos filtrados é quase 1,1 × 1010 células por sessão única de LCAP , o que pode ser comparável à remoção de quase metade do número de neutrófilos circulantes (2 × 10-3 × 1010 células). Assim, investigamos a diferença funcional entre neutrófilos pré-LCAP e pós-LCAP em relação à resposta à E. coli para esclarecer os potenciais mecanismos de observação clínica de que o LCAP pós-operatório reduziu a incidência de SSI. No entanto, a LCAP usando Cellsorba pode remover e ativar não apenas os neutrófilos, mas também as outras células sanguíneas (monócitos, linfócitos e plaquetas) com diferente eficácia de remoção. Portanto, é necessário investigar a mudança da resposta à E. coli não só nos neutrófilos, mas também nas outras células sanguíneas entre pré e pós-LCAP, embora não tenham sido avaliadas neste estudo.
Um dos resultados mais significativos deste estudo foi o fato de que a porcentagem de neutrófilos necróticos foi significativamente reduzida quando os neutrófilos pós-LCAP foram co-cultivados com E. coli, em comparação com os neutrófilos pré-LCAP. Esta observação sugere que o LCAP diminui a proporção de neutrófilos que induzem à necrose por E. coli e aumenta a proporção de neutrófilos viáveis (provavelmente não cultivados) na circulação sistêmica.
Variação generalizada da porcentagem de viabilidade dos neutrófilos, apoptose ou necrose na co-cultura com E. coli foi observada. Em nossos dados recentes não publicados, a porcentagem de apoptose precoce (Annexin V+, PI-) em neutrófilos circulantes variou amplamente de aproximadamente 10% a 90% em pacientes com inflamação sistêmica, como a proteína C reativa elevada >0,3 mg/L. Estas observações sugerem que os neutrófilos já podem estar apoptóticos sem cocultura de E. coli devido a maiores insultos cirúrgicos.
Pensa-se que a necrose é morte celular incontrolada, e parece liberar espécies tóxicas de oxigênio e enzimas proteolíticas inesperadamente . A necrose neutrófila é conhecida por ser a causa primária de danos às vias aéreas e pulmões nos pulmões intensamente inflamados de pacientes com fibrose cística. A LCAP pós-operatória pode induzir o recrutamento de um subconjunto de neutrófilos resistente à morte inesperada ou incontrolada de células necróticas contra infecção bacteriana na circulação sistêmica, além da remoção de leucócitos ativados que causam inflamação sistêmica.
Em contraste com os resultados acima dos experimentos ex vivo, a NE sérica após a LCAP foi significativamente aumentada. A redução imediata do NE sérico por LCAP não foi observada. Uma possível explicação para isso é que uma única sessão de LCAP pode não suprimir suficientemente a liberação de NE de neutrófilos do corpo inteiro na inflamação sistêmica induzida por surtos
Circulando neutrófilos após LCAP isolados de pacientes com tempo de operação mais longo (>3 h) ou maior contagem de neutrófilos pós-operatória (>16.750/mm3; valor mediano) mostrou não apenas maior atividade de produção de NE ou TNF-α, mas também menor atividade fagocitária contra E. coli. Esses achados sugerem que neutrófilos isolados de pacientes com alto estresse cirúrgico mostram produção excessiva de citocinas pró-inflamatórias ou atividade fagocitária comprometida, mesmo após renovação de neutrófilos por LCAP pós-operatória.
Em 29 pacientes UC com LCAP pós-operatória, apenas quatro pacientes (13,8%) desenvolveram SSIs. O TNF-α sérico deles após LCAP foi maior do que aqueles sem SSI, embora a diferença não tenha alcançado significância estatística. Portanto, o TNF-α sérico pode ser útil para identificar os pacientes que desenvolverão LIS após a LCAP pós-operatória. Entretanto, não foi observada associação entre o desenvolvimento de SSIs e a viabilidade dos neutrófilos, apoptose ou necrose na co-cultura com E. coli, o que pode ser em parte devido ao pequeno tamanho da amostra.
Recentemente, os neutrófilos circulantes têm sido reconhecidos como uma população funcionalmente heterogênea e diferentemente primada contra vários insultos . Temos relatado a importância clínica dos neutrófilos circulantes na inflamação sistêmica . Pensamos que os neutrófilos circulantes podem ser o alvo primário para explorar o efeito sistêmico da LCAP no sistema imunológico do hospedeiro.
Outras vezes, alguns investigadores relataram que a leucodepleção, que remove as células polimorfonucleares da circulação sistêmica usando filtros de leucócitos, leva a uma melhora significativa na função pulmonar e renal de pacientes que desenvolvem síndrome de resposta inflamatória sistêmica (SIRS) após a circulação extracorpórea. A leucodepleção dirigida aos neutrófilos pode ser benéfica para prevenir a falência de órgãos devido à SIRS .
Em conclusão, acredita-se ser este o primeiro relatório que demonstra que a LCAP pós-operatória diminui o subconjunto de neutrófilos circulantes que induzem a necrose contra a infecção bacteriana. Pode ser benéfico para a prevenção de SSI reduzir a morte inesperada ou descontrolada de células necróticas causada pela liberação de substâncias tóxicas ou proteolíticas na circulação sistêmica.
Aprovação
Os autores agradecem Motoko Ueeda e Chihiro Hibi pela excelente assistência técnica.
Contribuição da Autoria
K.T., T.A., e M.K. desenharam e realizaram os experimentos, analisaram e interpretaram os dados, e escreveram o manuscrito. S.Y., Y.O., e S.K. realizaram os experimentos e analisaram os dados. Y.T., M.I., M.O., M.K., Y.I., K.U., e Y.M. desenharam os experimentos, analisaram e interpretaram os dados. C.M. e M.K. desenharam os experimentos e interpretaram os dados.
Apoio e divulgação de acordos financeiros
Este trabalho foi apoiado em parte por subsídios do Ministério da Educação, Cultura, Esportes, Ciência e Tecnologia do Japão (KAKENHI 23791523 para S.Y.., 25861181 para Y.O., e 24791887 para M.I.).
- Verões C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Tendências Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Viver e morrer por inflamação: neutrófilos, eosinófilos, basófilos. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrófilos em imunidade inata e adaptativa. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Estado actual e perspectivas futuras da leucocitaférese para a doença inflamatória intestinal. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factores que afectam os efeitos a curto e longo prazo da terapia de remoção de leucócitos na colite ulcerativa activa. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtertion leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytapheresis using a leukocyte removal filter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) Um novo paradigma na colite ulcerativa: as células T reguladoras são um factor chave que induz/exacerba a CU através de um desequilíbrio imunitário. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamamoto H, Yoshikawa T,et al. (2002)Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatments for patients with ulcerative colitis. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)Uma revisão sistemática dos fatores de risco associados a infecções de sítio cirúrgico entre pacientes cirúrgicos. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Fatores de risco para infecção do sítio cirúrgico em pacientes japoneses com colite ulcerativa: um estudo prospectivo multicêntrico. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent pós-opertoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming como fator de risco relacionado à cirurgia para complicações infecciosas pós-operatórias em pacientes com colite ulcerosa. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factores de previsão de complicações infecciosas pós-operatórias e indução precoce de mediadores inflamatórios em doentes com colite ulcerosa. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdose patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classificação da morte celular: recomendações do Comité de Nomenclatura da Morte Célula 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mecanismo de disfunção dos neutrófilos: as proteases serinas dos neutrófilos clivam e inativam o receptor C5a. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct evidence of secondary necrosis of neutrophils during intense lung inflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Heterogeneidade funcional e priming diferencial dos neutrófilos circulantes na endotoxemia experimental humana. J LeukocBiol88:211-220.
- Mócsai A (2013)Diversas novas funções dos neutrófilos na imunidade, inflamação e além. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusão. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depleção de neutrófilos sanguíneos de pacientes com sepse: tratamento para o futuro? IntImmunopharmacol17:1226-1232.