ANTECEDENTES
Princípio:
Salicilato de metila (óleo de wintergreen) é um éster orgânico. Quando um ácido (contendo o grupo -COOH) reage com um álcool (um composto contendo um grupo -OH) forma um éster. O tipo de reação pode ser conhecido como reação de condensação porque a pequena molécula de H2O é eliminada dos reagentes enquanto os pedaços restantes dos reagentes condensam juntos para dar o produto principal. Esta reação também é denominada como esterificação, uma vez que o produto da reação é um éster, um composto que contém o grupo COOR.1
Aim:
Para preparar salicilato de metilo a partir do ácido salicílico.
Reacção:
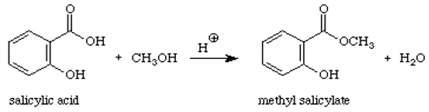
>
Mecanismo:
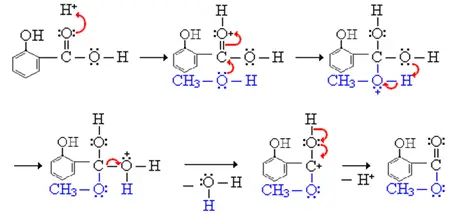
Uso:
É usado para tratar dores musculares e articulares.
Requisitos
Químicos: Ácido salicílico
Metanol seco
Ácido sulfúrico concentrado
Tetracloreto de carbono
Sulfato de magnésio etc.
Aparatus: Balão com fundo redondo – 500 ml,
Condensador de refluxo
Termómetro
Ampola separadora
Buchner funil
Cilindro de medição
Filtro de papel
PROCEDIMENTO
Pega uma mistura de 28 g (0.2 mol) de ácido salicílico, 64 g (81 ml, 2 mol) de metanol seco e 8 ml de ácido sulfúrico concentrado em um frasco de 500 ml de fundo redondo. Colocar algumas lascas pequenas de porcelana porosa, colocar um condensador de refluxo no frasco e ferver suavemente a mistura durante 5 h. Destilar o excesso de álcool num banho-maria e deixar arrefecer. Verter o resíduo em aproximadamente 250 ml de água contida num funil separador e enxaguar o frasco com alguns ml de água que também são vertidos no funil separador. Se, devido à diferença relativamente pequena entre a densidade do éster e da água, for difícil obter uma separação nítida da camada inferior do éster e da água, adicionar 10-15 ml de tetracloreto de carbono (2) e agitar vigorosamente a mistura de reacção nesse funil ao ficar de pé, a solução pesada de salicilato de metilo no tetracloreto de carbono separa-se de forma brusca e rápida no fundo da ampola de decantação. Escoar a camada inferior com cuidado, descartar a camada aquosa superior, devolver o salicilato de metilo ao funil e agitá-lo com uma solução forte de hidrogenocarbonato de sódio até que todo o ácido livre seja removido e não ocorra mais nenhuma evolução de dióxido de carbono. Lavar uma vez com água, e secar vertendo num pequeno frasco cónico seco contendo cerca de 5 g de sulfato de magnésio. Tapar o frasco, agitar por cerca de 5 min e deixar em pé por pelo menos meia hora com agitação ocasional. Filtrar a solução de salicilato de metilo através de um pequeno papel filtro canelado diretamente em um frasco de fundo redondo equipado com uma cabeça de destilador que carrega um termômetro de 360 °C e um condensador de ar. Coloque algumas lascas em ebulição e destile de um banho de ar; aumente a temperatura lentamente no início até que todo o tetracloreto de carbono tenha passado e depois aqueça mais fortemente. Recolha o salicilato de metilo (um óleo incolor de fragrância deliciosa, “óleo de wintergreen”) a 221- 224 °C; o rendimento é de 25 g (81%). O éster também pode ser destilado sob pressão reduzida; o p.b. é 115 °C/20 mmHg e uma fracção de 2 °C deve ser recolhida.
Cálculo:
Aqui o reagente limitador é o ácido salicílico; por isso o rendimento deve ser calculado a partir da sua quantidade recolhida.
Fórmula molecular do ácido salicílico = C7H6O3
Fórmula molecular do salicilato de metilo = C8H8O3
Peso molecular do ácido salicílico = 138 g/mole
Peso molecular do salicilato de metilo = 152 g/mole
>
Rendimento teórico:
>
138 g de ácido salicílico forma 152 g de salicilato de metilo
>
Por isso, 28 g de ácido salicílico irá formar …….? (X) g de salicilato de metila
X =( 152 ×28)/138 = 30,84 g
Rendimento teórico = 30.84 g
Rendimento prático = —– g
% Rendimento = (Rendimento prático)/(Rendimento teórico) × 100
CONCLUSÃO
Salicilato de metilo foi sintetizado e o rendimento percentual foi encontrado em………..%