US Pharm. 2008;33(3)(OTC suppl):4-7,
Asma é uma doença pulmonar caracterizada por obstrução reversível do fluxo aéreo e hiper-responsividade brônquica. A característica central da asma é a inflamação, que leva a episódios recorrentes de sibilância, tosse, falta de ar e aperto torácico.1,2 O objetivo da terapia é ganhar controle da doença para manter uma qualidade de vida normal.
A carga da asma tem aumentado de forma constante nas últimas três décadas. Em 1970, aproximadamente 3% da população tinha asma, contra 5,5% e 7,7% em 1995 e 2005, respectivamente.3 Esta última estimativa equivale a aproximadamente 22,2 milhões de americanos.2,3 Com o aumento da prevalência desta doença nos Estados Unidos, a morbidade e a mortalidade devido à asma também estão aumentando. Atribuídos à asma em 2004 foram 1,8 milhões de visitas a serviços de emergência, 497.000 hospitalizações e 4.055 mortes.3
>
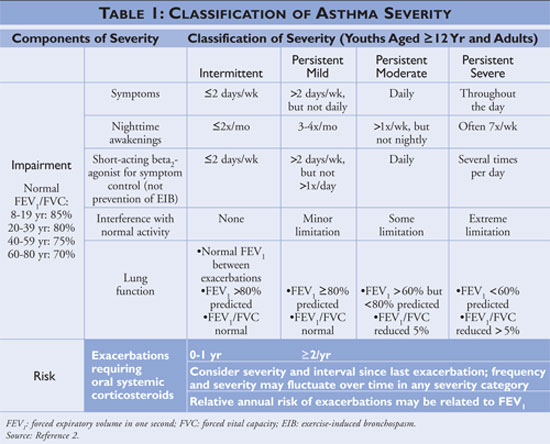
As diretrizes descrevem os fundamentos do manejo da asma como educação de autogestão, o uso de medicamentos de alívio rápido e o uso de medicamentos de controle a longo prazo em indivíduos com asma persistente. Os profissionais de saúde que oferecem educação de autogestão devem instruir os pacientes a identificar e evitar os ativadores da asma quando possível, usar terapias farmacológicas adequadamente e elaborar um plano de ação para a asma. A medicação de alívio rápido deve ser iniciada para todos os pacientes diagnosticados com asma e pode ser usada como monoterapia em indivíduos com asma intermitente; indivíduos diagnosticados com asma persistente, entretanto, devem ter uma ou mais medicações de controle a longo prazo adicionadas ao seu regime. As medicações de controle a longo prazo incluem corticosteróides inalatórios, modificadores de leucotrieno, beta-agonistas de ação prolongada e teofilina (ver tabela 2).

As diretrizes também observam que aproximadamente 30% da população norte-americana utiliza medicações e intervenções complementares e alternativas. Atualmente, no entanto, não existem evidências suficientes para recomendar essas modalidades de tratamento para a asma. As diretrizes desaconselham o uso de remédios fitoterápicos para tratar a asma com base na falta de dados de segurança e eficácia.
Produtos não sujeitos a receita médica para a asma e seu regulamento
Produtos não sujeitos a receita médica para a asma estão disponíveis desde os anos 50, embora alguns dos ingredientes ativos tenham mudado consideravelmente ao longo dos anos. Os princípios activos actualmente disponíveis sem receita médica são a efedrina – com ou sem guaifenesina – e a epinefrina. A teofilina e o fenobarbital eram anteriormente ingredientes ativos em produtos não sujeitos a receita médica para a asma; entretanto, ambos são agora classificados como produtos sujeitos a receita médica.4
Nas últimas três décadas, a FDA tomou medidas relativas à regulamentação de tratamentos não sujeitos a receita médica para a asma. Em 1976, a FDA concluiu que a epinefrina inalada fornecia alívio rápido e eficaz na asma leve a moderada. Em 1982, concluiu novamente em uma tentativa de monografia final: “Epinefrina, bitartrato de epinefrina e cloridrato de epinefrina (racémico; desde então renomeado cloridrato de racepinefrina) em formas de dosagem pressurizada de aerossol por inalação em dose calibrada pode ser geralmente reconhecido como seguro e eficaz para uso OTC na dosagem para adultos e crianças de 4 anos de idade ou mais de 1 a 2 inalações de uma dose calibrada equivalente a 0.Em 1986, a FDA revisou os produtos efedrina para broncodilatação e aprovou este ingrediente ativo como geralmente reconhecido como seguro e eficaz para uso sem receita médica. Naquele ano, a FDA decidiu que os dados eram insuficientes para limitar a epinefrina inalada apenas ao uso com prescrição médica e que os benefícios da disponibilidade sem prescrição médica compensavam os riscos. O FDA concluiu que a rotulagem expandida e revisada beneficiaria os consumidores.5,6
Após relatos de eventos que ameaçam a vida e mortes atribuíveis a produtos combinados sem prescrição médica contendo teofilina, o FDA emitiu uma decisão final em 1995 que esses produtos não eram seguros ou eficazes.7 Assim, produtos contendo uma combinação de efedrina e teofilina foram descontinuados e alguns foram reformulados para conter efedrina e guaifenesina. Também em 1995, a FDA propôs a remoção da efedrina do mercado sem prescrição médica devido ao seu papel na fabricação de metanfetamina e metanfetamina e seu uso indevido para controle de peso e aumento muscular.7
Em 1996, a FDA emendou a monografia final de 1986 para remover o status de monografia para os broncodilatadores OTC.6 Em vez disso, os fabricantes de qualquer novo inalador sem prescrição médica são obrigados a apresentar um pedido aprovado que contenha informações não encontradas na monografia.6 Os broncodilatadores sem prescrição médica comercializados atualmente não foram afetados por esta alteração.
Apesar da proposta da FDA de remover a efedrina do mercado sem prescrição médica devido ao seu uso como elemento base na produção de metanfetaminas, o produto permanece disponível sem prescrição médica. Em vez disso, a Lei de Combate à Epidemia de Metanfetamina de 2005, incorporada à Lei Patriótica em 2006, conferiu aos produtos sem prescrição médica o status de produto sem prescrição médica por trás do balcão.8 Os consumidores que desejam comprar produtos contendo efedrina agora devem apresentar identificação fotográfica emitida pelo governo em uma farmácia, pois esses produtos não são mais vendidos legalmente em lojas de conveniência ou armazéns sem uma farmácia registrada.
Como parte da proteção global da saúde pública, foi formado um acordo internacional para reduzir e eventualmente eliminar produtos que contêm substâncias que afetam a camada de ozônio (ODS), como clorofluorcarbonos (CFCs) encontrados em inaladores de dose calibrada (MDIs). Esse acordo deu origem ao Protocolo de Montreal de 1987 e, posteriormente, às Emendas à Lei de Ar Limpo de 1990.9-11 O acordo prevê uma isenção para o uso de CFCs em MDIs utilizados para o tratamento da asma se o uso do produto for determinado como essencial pela FDA.12 Medicamentos não prescritos para a asma permaneceram sob a designação de uso essencial. Entretanto, em 2007, a FDA anunciou uma proposta para remover a designação de uso essencial para epinefrina inalada, com efeito a partir de 31 de dezembro de 2010.13 A FDA utilizou os seguintes critérios, encontrados no 21 CFR 2.125(g)(2), para rever a designação de uso essencial para epinefrina inalada: “(i): Existem barreiras técnicas substanciais para a formulação do produto sem ODS; (ii): O produto proporcionará um importante benefício de saúde pública não disponível; e (iii): O uso do produto não libera cumulativamente quantidades significativas de ODSs na atmosfera ou a liberação é garantida em vista do importante benefício de saúde pública indisponível”.13 A FDA está atualmente recebendo comentários sobre este assunto antes de sua decisão final.
Segurança e Eficácia dos Produtos sem prescrição médica
Como evidenciado pelas várias propostas feitas e ações tomadas pelo FDA em relação ao status de não prescrição médica dos produtos para asma, nas últimas décadas tem havido muito debate sobre a segurança e eficácia dos ingredientes ativos desses produtos. Embora esses produtos não sejam promovidos ativamente, sua disponibilidade significa que sua segurança e eficácia são extremamente importantes para os consumidores.
Efedrina: Os produtos de efedrina com um único ingrediente para utilização como broncodilatadores têm sido considerados geralmente reconhecidos como seguros e eficazes pela FDA desde 1986.14 A efedrina liberta epinefrina dos tecidos, o que desencadeia a actividade dos receptores beta-adrenérgicos alfa-adrenérgicos e não selectivos. A eficácia da efedrina para a broncodilatação tem sido demonstrada em estudos que datam dos anos 50. As propriedades que tornam a efedrina menos desejável como broncodilatador incluem um início de acção mais lento do que os produtos inalados (15 minutos a uma hora) e a não selectividade da estimulação beta, o que poderia contribuir para eventos adversos cardiovasculares (EA).15-17 No entanto, estudos demonstraram resultados contraditórios relativamente a eventos adversos cardiovasculares atribuíveis ao uso de efedrina em doses rotuladas de 12,5 a 25 mg.16
Epinefrina: A epinefrina exibe a mesma atividade receptora alfa-adrenérgica e beta-adrenérgica da efedrina; portanto, existem as mesmas preocupações quanto à possibilidade de EAs cardiovasculares. O início da ação da epinefrina inalada (15 seg) é muito mais rápido do que o da efedrina oral, tornando-a uma escolha mais apropriada para o alívio imediato de uma exacerbação aguda da asma.6 Sua curta duração de ação (23 min), entretanto, pode exigir que o paciente use o produto repetidamente para alívio contínuo ao invés de seguir as instruções do rótulo de não mais do que duas inalações no prazo de três horas.6 Os inaladores epinefrina sem prescrição médica parecem ser seguros e eficazes para pacientes com asma leve e intermitente quando usados como rotulados.5 Isto continua sendo uma fonte de controvérsia, no entanto, já que muitos profissionais de saúde estão preocupados com o fato de que pacientes que dependem de inaladores sem prescrição médica podem não estar recebendo o tratamento adequado da doença de uma equipe de saúde, possivelmente levando a repercussões graves.
Guaifenesina: A guaifenesina é usada em combinação com efedrina para tratamento da asma e é reconhecida como segura e eficaz quando o produto é rotulado para tosse associada à asma.14 Embora a guaifenesina seja um mucolítico aprovado pelo FDA, ela não possui efeitos broncodilatadores. Assim, não contribui com nenhum benefício adicional ao produto efedrina para uma exacerbação aguda.17
Utilização de produtos de asma sem prescrição médica
Uma pesquisa da Wyeth Consumer Healthcare (WCH) realizada em 1999 descobriu que aproximadamente seis milhões (30%) de indivíduos com asma usam inaladores epinefrina.6 Os auto-relatos dos entrevistados sugerem que cerca de 20% desses seis milhões seriam classificados como tendo asma persistente leve a moderada, que não está no uso rotulado para este produto.5 As diretrizes da NAEPP promovem o uso de agonistas beta de ação curta, pelo menos conforme necessário, por todos os indivíduos que sofrem de asma; as diretrizes não mencionam especificamente a epinefrina inalada como opção de tratamento.
Em 2005, a WCH realizou uma pesquisa na Internet com 330 indivíduos a respeito do uso de broncodilatadores não prescritos para o tratamento de seus sintomas. A WCH determinou que, dos usuários sem prescrição médica, 92% tinham sido diagnosticados com asma, 91% usavam epinefrina inalatória somente quando apresentavam exacerbação aguda da asma, 31% não tinham seguro médico e 38% não tinham seguro de prescrição.6 A WCH extrapolou esses resultados para estimar que aproximadamente 5% a 10% dos indivíduos com asma usavam broncodilatadores sem prescrição médica como monoterapia.6 As principais razões apresentadas para o uso sem prescrição médica – facilidade de acesso e menor custo – correlacionam-se diretamente com as preocupações dos profissionais de saúde de que os indivíduos que usam produtos não sujeitos a prescrição médica para a asma podem não estar recebendo o manejo apropriado da doença.6
Discussão
As propriedades desejáveis no tratamento da asma aguda incluem eficácia como broncodilatador, segurança quando tomado como rotulado, início rápido da ação e longa duração da ação. Tanto a epinefrina inalada como a efedrina oral têm demonstrado eficácia em ensaios durante décadas. Dados os resultados cardiovasculares mistos em ensaios clínicos, no entanto, a segurança do uso de broncodilatadores não prescritos por indivíduos que podem não ser seguidos clinicamente é uma grande preocupação dos prestadores de cuidados de saúde. A epinefrina inalada tem um início de ação mais rápido do que a efedrina oral, mas sua curta duração de ação pode limitar sua eficácia.
A disponibilidade da efedrina oral tem sido limitada desde 2006 pelo seu status de “por trás do balcão”. A disponibilidade da epinefrina inalada depende da decisão da FDA quanto a se esta formulação irá manter sua designação de uso essencial. Não existem alternativas de não prescrição para os broncodilatadores não prescritos atualmente comercializados contendo CFC.12 Um fabricante tentou reformular seu produto sem prescrição inalatória com um propelente hidrofluoroalcano, com efeitos indesejáveis para o usuário; fez parceria com outra empresa farmacêutica para reformulação, antecipando o registro no FDA até 2011.6 As principais preocupações com os propelentes alternativos incluem a necessidade de fornecimento eficaz de epinefrina e dados de segurança e eficácia para o novo produto, como resultado das mudanças.18
Ao determinar se a designação de uso essencial da epinefrina inalada deve ser removida, a FDA não está examinando a segurança ou eficácia dos produtos que contêm CFC atualmente comercializados; ao contrário, está examinando o impacto sobre a saúde pública caso a designação seja removida. Em cartas da National Association of Chain Drug Stores e da American Pharmacists Association à FDA sobre a proposta de remoção da designação de uso essencial, a principal preocupação era o potencial impacto negativo sobre os usuários atuais de inaladores sem prescrição médica se os produtos não estivessem disponíveis.19,20 A FDA declarou que se a regra proposta para remover a designação de uso essencial se tornar final e não existirem alternativas de não prescrição médica, será necessário que os consumidores obtenham uma prescrição para um produto alternativo.12 Muitos consumidores que usam epinefrina inalada podem optar por renunciar ao tratamento da asma ou buscar alternativas de terapia sem prescrição médica.
É imperativo que a comunidade médica conscientize o público da gravidade das conseqüências da asma descontrolada e que qualquer pessoa que tenha dificuldade para respirar deve consultar um profissional de saúde para diagnóstico e tratamento. Um paciente que opta por usar broncodilatadores sem prescrição médica deve ser aconselhado a informar o seu profissional de saúde; o paciente também deve ser aconselhado sobre a diferença nas instruções do rótulo entre inaladores sem prescrição médica e inaladores com prescrição médica. A atual acessibilidade contínua dos broncodilatadores sem prescrição médica requer o aconselhamento informado dos pacientes para evitar o uso inadequado desses produtos e os efeitos adversos subsequentes.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Diretrizes para o Diagnóstico e Gerenciamento da Asma. Programa Nacional de Educação e Prevenção da Asma. Bethesda, MD: Instituto Nacional do Coração, Pulmão e Sangue, Institutos Nacionais de Saúde; 2007.
3. Akinbami L. Prevalência da asma, uso de cuidados de saúde e mortalidade: Estados Unidos, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Acesso em 10 de dezembro de 2007.
4. W. Steven Pray. Produtos OTC e terapia da asma. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalers for asthma: report of the Council on Scientific Affairs. Tórax. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N–0374. Use of ozone-depleting substance: essential-use determination of over-the-counter (OTC) epinefrine metered dose inhalers. Briefing document. 19 de dezembro de 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Acesso em 30 de dezembro de 2007.
7. Kupec IF. Broncodilatadores e efedrina contendo teofilina. Respostas T95-40. 27 de julho de 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Acesso em 10 de dezembro de 2007.
8. Drug Enforcement Administration. Informações gerais sobre a Lei de Combate à Epidemia de Metanfetaminas de 2005. Maio de 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Acesso em 4 de fevereiro de 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Análise de risco. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economia de “isenções de uso essencial” para inaladores de dose calibrada sob o Protocolo de Montreal. J Environ Manage.2007;85:1-8.
11. D’Souza S. O Protocolo de Montreal e isenções de uso essencial. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Administração de Alimentos e Drogas. FDA News. FDA propondo a eliminação progressiva dos CFCs em inaladores de dose calibrada para epinefrina. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Acesso em 10 de dezembro de 2007.
13. Administração de Alimentos e Drogas. Código do Regulamento Federal 21 CFR parte 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Acesso em 6 de fevereiro de 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, agendamento internacional de drogas; Convenção sobre Substâncias Psicotrópicas. 16 de abril de 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Acesso em 30 de dezembro de 2007.
15. Lexi-Comp Online. www.crlonline.com. Acessado em 28 de dezembro de 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Comparação duplo-cego dos efeitos agudos brônquicos e cardiovasculares da terbutalina oral e da efedrina. Tórax. 1975;68:155-161.
17. Dulfano MJ. Os novos broncodilatadores orais . Chest.1975;68:133-134.
18. Frio, tosse, alergia, broncodilatador e produtos antiasmáticos para uso humano de venda livre; emenda da monografia para os produtos broncodilatadores OTC. Registro Fed. 1996; 61:25142-25147.
19. Associação Nacional de Lojas de Drogas em Cadeia. Assunto: uso de propulsores que empobrecem a camada de ozônio; remoção da designação de uso essencial para inaladores de epinefrina de venda livre (IDCs). 6 de janeiro de 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Acesso 6 de fevereiro de 2008.
20. Declaração da Associação Americana de Farmacêuticos (APhA) para o Comitê Consultivo de Medicamentos Isentos de Receita Médica da Food and Drug Administration e para o Comitê Consultivo de Medicamentos Isentos de Receita Médica da Pulmonary-Allergy Drugs Advisory Committee. Uso de substância que empobrece a camada de ozono: determinação do uso essencial de inaladores de dose calibrada de epinefrina OTC. 24 de janeiro de 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Acesse 6 de fevereiro de 2008.
Para comentar este artigo, entre em contato com [email protected].