- Cavidades sem cromatina axial aparecem em plantas com conteúdo médio de DNA 2C superior a 0.8 pg por cromossomo
- Condensação/descondensação cromossômica pode ser visualizada em seções semi-finas de N. células damascena após 4′,6-diamidino-2-fenilindole (DAPI) coloração
- Condensação/descondensação cromossômica durante a mitose analisada após incorporação de 5-etinyl-2′-deoxiuridina (EdU)
- Condensação/descondensação cromossômica durante a mitose analisada por microscopia eletrônica
Cavidades sem cromatina axial aparecem em plantas com conteúdo médio de DNA 2C superior a 0.8 pg por cromossomo
Cromatídeos anafásicos e telófase de algumas plantas contêm cavidades isentas de cromatina nas regiões axiais, que distinguem estas plantas da maioria das outras plantas e animais investigados até o momento (Fig. 1a, b). Para nosso conhecimento, relatórios descrevendo tal organização cromossômica são restritos a plantas com grandes genomas, e pode ser assumido que tal organização morfológica é uma característica específica para estas plantas. Para verificar esta sugestão, também analisamos cromatídeos anáfase e telófase de 12 espécies usando microscopia eletrônica (Tabela 1; Fig. 1a, b; Arquivo adicional 1: Figura S1). A Figura 1c demonstra que cavidades sem cromossomos axiais foram claramente vistas apenas dentro dos cromossomos de plantas com grandes genomas e com grandes cromossomos, mas parecia que o tamanho médio dos cromossomos se correlacionava melhor com a presença ou ausência destas cavidades. Entre as plantas com cavidades axiais, Hordeum vulgare tinha o menor genoma e o menor conteúdo médio de DNA 2C por cromossomo (0,79 pg). Assim, essa organização cromossômica é uma marca registrada dos cromossomos de plantas cujo conteúdo de DNA 2C pode ser estimado como excedendo 0,8 pg por cromossomo.
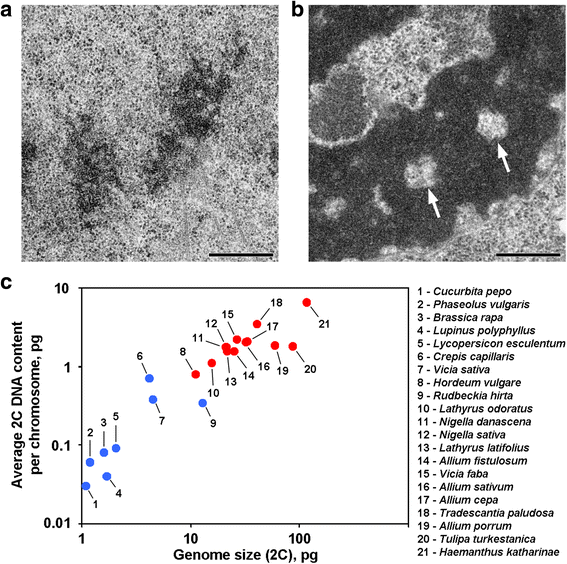
Duas variantes de organização cromossômica em plantas. a Cromossomos Telophase do feijão comum (Phaseolus vulgaris) como um exemplo de cromossomos sem cavidades axiais livres de cromatina. b Cromossomos Telophase de N. damascena com cavidades axiais livres de cromatina (setas) claramente visíveis. c A presença de cavidades axiais livres de cromatina depende do genoma e do tamanho do cromossomo. Pontos azuis representam plantas nas quais os cromossomos não contêm cavidades axiais isentas de cromatina; pontos vermelhos representam plantas nas quais os cromossomos contêm cavidades axiais isentas de cromatina. Barra de escamas: 0,5 μm
Condensação/descondensação cromossômica pode ser visualizada em seções semi-finas de N. células damascena após 4′,6-diamidino-2-fenilindole (DAPI) coloração
O objeto mais conveniente para o estudo dos cromossomos de plantas, meristema apical radicular, não permite a aquisição de imagens de alta resolução por causa da fluorescência desfocada. Aqui, utilizamos um método baseado na aplicação de secções semi-finas (200-250 nm) de raízes embutidas em meio LR White. A espessura destes cortes foi significativamente menor do que a dos cortes ópticos, mesmo que tenha sido utilizado um microscópio confocal. Para encontrar as características morfológicas que nos permitiram identificar células em diferentes estágios mitóticos, analisamos a morfologia das células coradas com DAPI.
Existiram várias transformações da organização cromossômica de N. damascena que foram facilmente visíveis mesmo sob o microscópio de fluorescência. Dentro dos núcleos iniciais da prófase, partes dos cromossomos finos (aproximadamente 0,6 μm em diâmetro) eram visíveis (Fig. 2a). Na prófase média, foram formados cromossomos prófase mais espessos (aproximadamente 1,2 μm), dentro dos quais foi possível distinguir a presença de fibras mais finas, que provavelmente correspondiam a cromossomos prófase precoce dobrados (Fig. 2b). Cromossomos de prófase tardia (Fig. 2c), metáfase (Fig. 2d) e anáfase (Fig. 2e) foram densamente condensados, não tendo sido detectada nenhuma organização interna. Durante a descondensação na telófase, a separação das fibras de cromatina com um diâmetro de aproximadamente 0,4 μm levou ao aparecimento de cavidades sem cromatina nas regiões axiais dos cromatídeos (Fig. 2f), cujo tamanho foi gradualmente aumentado durante a telófase (Fig. 2g e h). O diâmetro das fibras de cromatina nos cromossomos telophase era comparável ao tamanho dos cromossomos prófase precoce. Assim, todos os estágios mitóticos de N. damascena foram facilmente detectados em cortes semi-finos corados com DAPI.
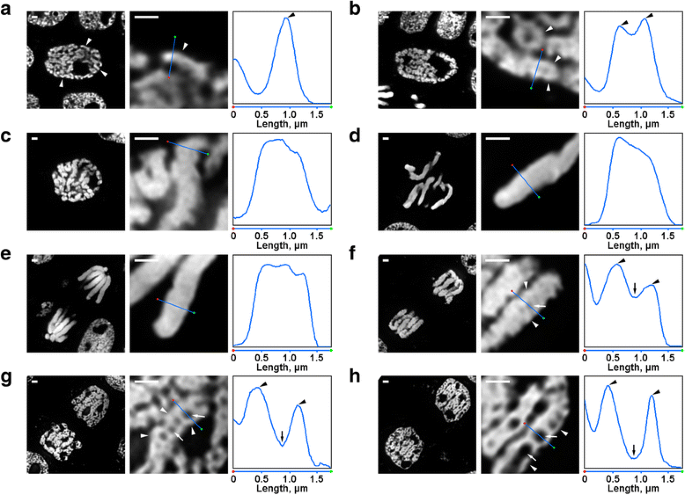
Morfologia dos cromossomos mitóticos de N. damascena. Os painéis esquerdo e central representam imagens de microscopia de fluorescência dos cortes semi-finos corados DAPI (vista geral e fragmento); o painel direito representa um gráfico de densidade através da linha nos painéis centrais. uma Profase precoce (os cromossomos são indicados por pontas de seta). b Prófase média (fibras formando cromossomos, que parecem corresponder a cromossomos prófase precoce, são indicadas por pontas de flechas). c Prófase tardia. d Metáfase. e Anáfase. f Prófase precoce (cavidades axiais sem cromatina são indicadas por setas, fibras formando cromossomos telófase são indicadas por pontas de flechas). g Prófase tardia. h G1-fase. Barras de escamas: 1 μm
Condensação/descondensação cromossômica durante a mitose analisada após incorporação de 5-etinyl-2′-deoxiuridina (EdU)
Durante a prófase, os cromossomos de prófase precoce e fina foram transformados em cromossomos de prófase tardia espessa. O espessamento dos cromossomos pró-fase pode ser resultado de dobramento dos cromossomos pró-fase precoces ou um resultado do seu espessamento gradual. Para investigar esses dois possíveis mecanismos, foi necessário marcar os focos cromossômicos discretos que foram dispostos linearmente dentro dos cromossomos pró-fase precoces e então analisar seus rearranjos espaciais durante a condensação da fase. Como diagramado na Fig. 3a, durante a transição da fase inicial para a fase final, tais focos ou perderiam a disposição linear (dobramento) ou manteriam a disposição linear e esticariam os focos em bandas finas (espessamento). Para rotular as regiões cromossômicas, incorporamos o nucleotídeo sintético, EdU, que pode ser detectado por click-chemistry, na cromatina durante a replicação.
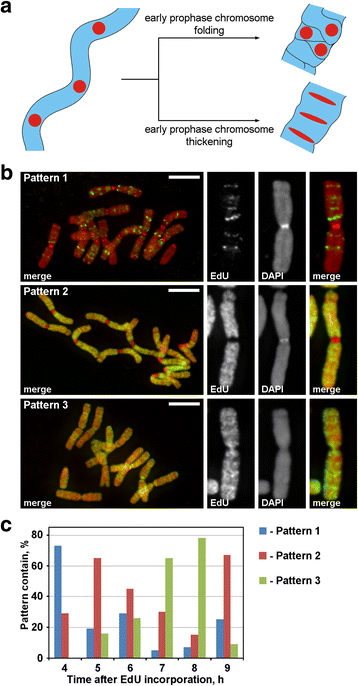
Etiquetagem dos cromossomos com EdU. a Labeled region localization and morphology revealed the principle of prophase chromosome condensation. Regiões cromossômicas marcadas linearmente durante a transição da fase inicial para a fase final perderiam a disposição de linearidade (dobramento) ou manteriam a disposição linear (espessamento). b Três padrões de incorporação do EdU foram detectados nos cromossomos: marcação de regiões discretas (padrão 1), marcação de braços cromossômicos mas não centrômeros (padrão 2) e marcação de braços e centrômeros cromossômicos (padrão 3). c Freqüências de diferentes padrões de marcação em diferentes pontos de tempo após a incorporação do EdU. Barras de escalas: 5 μm
EdU foi incorporado por 30 min nas raízes de N. damascena, e após diferentes períodos de perseguição (de 2 a 14 h), foram feitas as espáduas cromossômicas. Três padrões de marcação cromossômica foram detectados: marcação de regiões discretas (padrão 1), marcação de braços cromossômicos mas não centrômeros (padrão 2) e marcação de braços e centrômeros cromossômicos (padrão 3) (Fig. 3b). O padrão 1 foi observado mais frequentemente às 4 h após a incorporação do EdU, indicando que tal rotulagem era típica para a fase S tardia (Fig. 3c; arquivo adicional 2: Figura S2). No caso do padrão 1, a etiquetagem dos cromossomos homólogos foi semelhante (arquivo adicional 3: Figura S3), indicando um padrão específico de incorporação do EdU. Os braços cromossômicos foram rotulados durante o restante da fase S (padrões 2 e 3), mas as regiões centrômicas também foram rotuladas aproximadamente na fronteira entre a fase S precoce e a fase S tardia (padrão 3) (Fig. 3c).
Analisamos as transições da fase inicial para a fase tardia utilizando cromossomos nos quais a cromatina replicante tardia foi rotulada (padrão 3). Nos cromossomos da prófase inicial, as regiões rotuladas foram distribuídas linearmente ao longo dos cromossomos finos (Fig. 4a). Nos cromossomos de prófase tardia, que eram aproximadamente duas vezes mais espessos que os cromossomos de prófase precoce, as regiões rotuladas perderam a linearidade de distribuição (Fig. 4b). Esta observação não foi completamente válida, pois os cromossomos prófase e metafase consistem em dois cromossomos, que gradualmente se segregam, o que pode levar a uma perda na linearidade da distribuição das regiões rotuladas. Portanto, analisamos ainda os cromossomos anáfase (ou seja, cromossomos totalmente compactados após a segregação cromatídica). Nos cromossomos anafásicos com um diâmetro aproximadamente igual ao diâmetro dos cromossomos prófase tardia, as regiões cromatadas rotuladas não foram dispostas linearmente, mas distribuídas ao longo do volume dos cromossomos (Fig. 4c). Na telophase, as cavidades livres de cromatina eram claramente visíveis nas regiões axiais dos cromatídeos, permitindo a detecção das fibras cromatinosas dentro das quais as regiões rotuladas estavam dispostas linearmente (Fig. 4d). Assim, durante a transição da prófase precoce para a tardia, ocorreu a dobra dos cromossomos da prófase precoce. Este resultado está de acordo com as observações dos cromossomos da prófase média manchados com DAPI (Fig. 2b), dentro dos quais as fibras finas dobradas eram claramente visíveis.
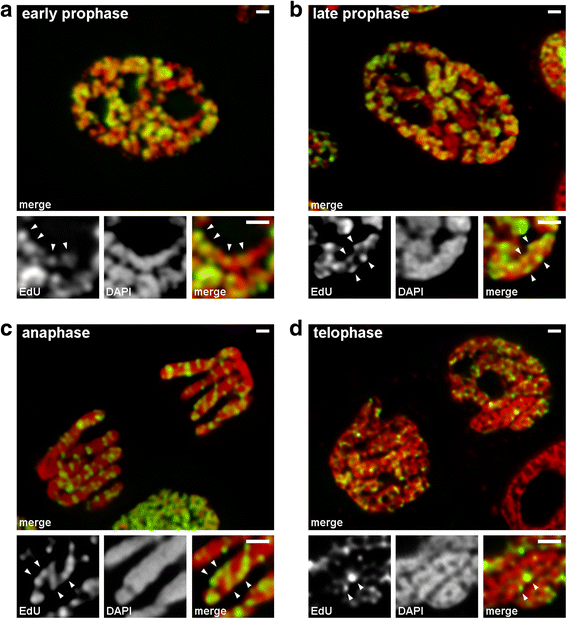
Condensação/descondensação cromossômica durante a mitose de N. damascena (células mitóticas cujos cromossomos incluíam EdU durante a fase S tardia). a Na fase inicial da prófase, as regiões rotuladas foram linearmente distribuídas em cromossomos finos, abrangendo a largura do cromossomo quase que inteiramente. b Na fase final da prófase, as regiões rotuladas foram espalhadas pelo volume do cromossomo. c Na anáfase, o padrão de rotulagem foi similar ao dos cromossomos da fase final da prófase. d Na fase final da telófase, a descondensação revelou fibras finas formando cromatídeos no interior dos quais as regiões rotuladas foram distribuídas de forma similar àquelas dentro dos cromossomos da fase inicial da prófase. Barras de escamas: 1 μm
Condensação/descondensação cromossômica durante a mitose analisada por microscopia eletrônica
Para a detecção da organização interna das fibras cromatinosas, cuja dobra foi descrita usando microscopia leve, usamos microscopia eletrônica. Para detectar e medir as subestruturas fibrilares de cromatina, analisamos as cavidades livres de cromatina, que separavam as fibras cromatinosas como assumimos (arquivo adicional 4: Figura S4; Tabela 2).
Núcleos interfásicos foram preenchidos com uma malha de fibras espessas de 234 ± 49 nm (média ± S.D.) (Fig. 5a), que podem ser referidas como ‘cromonematos interfásicos’, como discutido em outro lugar . A microscopia eletrônica permitiu a detecção de três estágios de condensação do cromossomo profásico, o primeiro dos quais não foi possível detectar usando microscopia de luz, e será referido aqui como “pré-profase”. O segundo e o terceiro estágios correspondem à fase inicial e a fase final, conforme descrito acima (Fig. 2a e c, respectivamente).
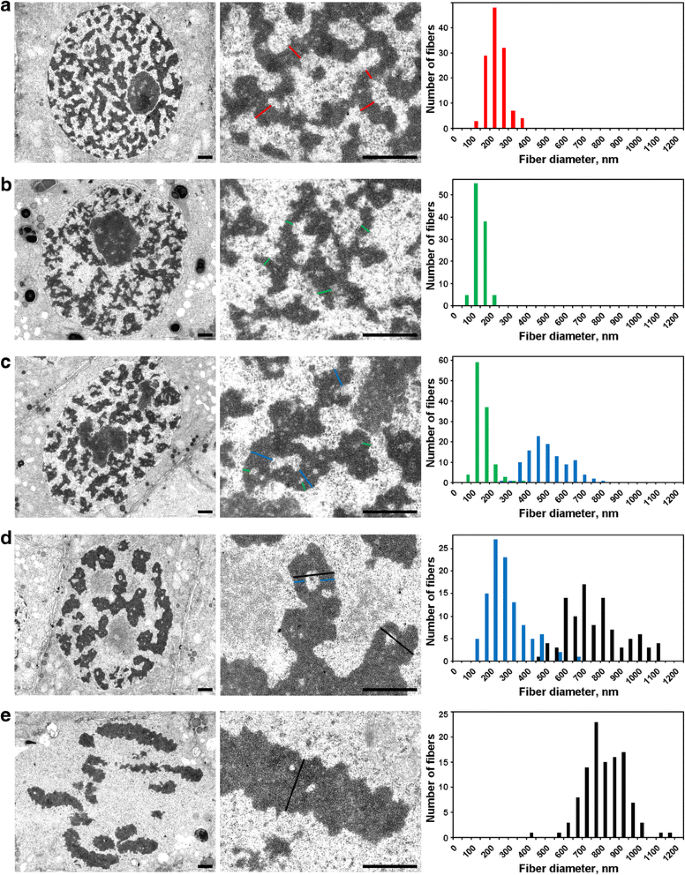
Morfometria por microscopia eletrônica dos cromossomos N. damascena: condensação cromossômica da interfase para a metáfase. Os painéis esquerdo e central mostram a organização ultra-estrutural (visão geral e fragmento), os painéis direito mostram histogramas representando as distribuições dos cromossomos e da largura das fibras cromatinosas. a Interfase. b Pré-profase. c Prófase precoce. d Prófase tardia. e Metáfase. As secções transversais típicas dos cromossomas e/ou fibrilas de cromatina são indicadas com linhas coloridas: vermelho – cromonemata interfase (heterocromatina), verde – cromonemata; azul – ‘fibras de 300 nm’; preto – cromossomas. Barras de escamas: 1 μm
(1) Na pré-profase, os cromossomos estavam mal separados uns dos outros, e não podíamos medir com precisão o seu diâmetro (Fig. 5b). Os cromossomos pré-profase foram formados por fibras com diâmetro de 148 ± 30 nm (Tabela 2), que muito provavelmente corresponderam às fibras com diâmetro de 100-130 nm (cromonema), que são a principal subestrutura cromossômica da prófase e dos cromossomos telófase em células animais . Os dados não nos permitiram estabelecer a identidade dos cromossomos interfásicos e mitóticos, mas os dados relatados anteriormente indicam que os cromossomos interfásicos são complexos formados por cromossomos dobrados .
(2) Na fase inicial da prófase, a separação dos cromossomos ocorreu (Fig. 5c). O diâmetro dos cromossomos foi de 527 ± 107 nm, e esses cromossomos também foram formados por cromossomos com diâmetro de 158 ± 46 nm.
(3) Finalmente, analisamos células profásicas tardias, que continham cromossomos espessados com diâmetro de 809 ± 185 nm (Fig. 5d). Alguns cromossomos de prófase tardia continham cavidades nas regiões axiais que nos permitiram distinguir as fibras com um diâmetro de 285 ± 102 nm (“fibra de 300 nm”). A análise utilizando os segmentos cromossômicos marcados demonstrou que os cromossomos prófase precoce dobraram para formar cromossomos prófase tardia mais espessos (Fig. 4). Portanto, é possível assumir que as fibras de 285 ± 102 nm e os cromossomos prófase precoce de 527 ± 107 nm eram as mesmas fibras. O diâmetro reduzido das fibras pode estar associado à compactação dos cromossomos prófase precoce, o que também foi indicado pelo desaparecimento dos cromossomos visíveis.
Cromatina dentro dos cromossomos metafásicos (Fig. 5e) e dos cromossomos anafásicos (Fig. 6a) foi altamente compactada, e, embora raras cavidades livres de cromatina dentro delas fossem visíveis, uma distinção precisa de qualquer substrutura fibrilar era impossível. Nos cromossomos telophase iniciais, dois tipos de cavidades foram claramente detectados (Fig. 6b). Grandes cavidades foram localizadas na região axial dos cromossomos, permitindo identificar e medir fibras com diâmetro de 422 ± 78 nm. Nas regiões centrais dessas fibras, detectamos pequenas cavidades que permitiram a identificação de um segundo tipo de fibra com diâmetro de 182 ± 47 nm. O primeiro tipo de fibras pode corresponder às ‘fibras de 300 nm’ dentro dos cromossomos da fase final da prófase, o segundo tipo pode corresponder aos cromonematos.

Morfometria por microscopia electrónica dos cromossomas de N. damascena: descondensação cromossómica da anáfase para a fase G1. Os painéis esquerdo e central mostram a organização ultra-estrutural (vista geral e fragmento), o painel direito mostra histogramas representando a distribuição da cromatídeo e da largura da fibra cromatina. a Anáfase. b Telófase precoce. c Telófase tardia. d Fase G1. As secções transversais típicas dos cromossomas e/ou fibrilas de cromatina são indicadas com linhas coloridas: vermelho – cromonemata interfase, verde – cromonemata; azul – ‘fibras de 300 nm’; preto – cromatídeos. Barras de escamas: 1 μm
No telófase tardia (Fig. 6c) e na fase G1 (Fig. 6c). 6d), os cromossomos foram descondensados em domínios cromossômicos em núcleos filhas, onde não podem ser facilmente observados. No entanto, foi possível identificar fragmentos cromatídeos separados. Nesta fase, os cromossomas foram formados por fibras com um diâmetro de aproximadamente 250 nm, que corresponde aproximadamente ao diâmetro dos cromonematos interfásicos. Esta observação, além do desaparecimento das fibras cromossômicas, indicou que, nesta fase da mitose, as fibras cromatinosas foram redobradas para formar complexos interfásicos de cromatina condensada.