Introducere
Cancerul de prostată este cea mai frecventă formă de malignitate și a doua cauză principală de deces prin cancer în rândul bărbaților.1 Studiile pe cadavru arată că posibilitatea de a dezvolta microfocare a cancerului de prostată crește odată cu vârsta (30% în decada a patra de viață, 40% în decada a cincea etc.).2
În timp ce unele cancere sunt agresive, altele au un potențial metastatic redus sau inexistent.3 Mulți bărbați cu cancer de prostată cu risc scăzut nu vor evolua sau nu vor deveni simptomatici din punct de vedere clinic pe parcursul vieții.4 Din cauza acestei variabilități, au fost introduse diferite opțiuni de tratament, care oferă efecte terapeutice comparabile cu prostatectomia radicală (RP), păstrând în același timp funcția sexuală și continența. În acest scenariu, supravegherea activă (AS) poate oferi o morbiditate redusă și o îmbunătățire a calității vieții.5 Tumorile mici, neagresive, sunt candidații ideali pentru AS, deși nu s-a ajuns la un consens. Boala cu risc scăzut este definită ca fiind scorul Gleason (GS) 6 și antigenul prostatic specific (PSA)
ng/ml. Pacienții cu stadiu clinic >T2a sunt de obicei excluși.6
Gradul histologic este un determinant independent al prognosticului bolii și al supraviețuirii.7 Sistemul de clasificare GS este cea mai larg acceptată clasificare,8 dar multe studii au arătat că GS obținut în urma biopsiei prostatei nu se corelează întotdeauna cu gradul patologic final al specimenelor chirurgicale. Upgrade-ul GS (creșterea GS cu cel puțin un punct) a fost raportat în până la 57% din cazuri.9,10 Erorile în atribuirea GS pot duce la supravegherea necorespunzătoare a tumorilor agresive din punct de vedere biologic sau la selectarea unor tratamente cu rate de vindecare inferioare în cazul bolilor cu risc ridicat, ceea ce poate avea, în cele din urmă, un impact negativ asupra rezultatelor pacienților.11 Prin urmare, mai multe studii recente au căutat factori care ar putea prezice actualizarea GS.12
Un volum scăzut al prostatei (PV) și, mai precis, o densitate ridicată a antigenului specific prostatic (PSAD) s-au dovedit a fi factori predictivi ai progresiei riscului în multe studii, reflectând posibilitatea unui cancer agresiv nedetectat.6 Mai multe studii au arătat o relație puternică între PSAD și agresivitatea cancerului de prostată.13 PSAD a fost propus ca un predictor puternic al îmbunătățirii GS la pacienții cu boală Gleason 6 confirmată prin biopsie, dar nu există un consens general cu privire la valoarea limită.11-17
Scopul principal al studiului nostru a fost de a identifica predictorii independenți pentru upgrade-ul GS și de a determina cea mai bună valoare cut-off pentru PSAD pentru a identifica pacienții cu risc.
Materiale și metode
Am colectat informațiile studiului din baza de date menținută prospectiv de centrul nostru spitalicesc. Au fost selectați pacienții cu cancer de prostată localizat clinic care au fost supuși unei prostatectomii radicale (RP) și au avut o biopsie preoperatorie a prostatei în intervalul de timp cuprins între ianuarie 2004 și februarie 2015. Detectarea GS 3+3 la biopsia de prostată a fost luată ca și criteriu de includere. Toate informațiile clinice, imagistice, de laborator și patologice au fost obținute din baza de date și au fost coroborate cu fișele clinice ale pacienților.
Am inclus vârsta pacientului preoperator, stadiul clinic al bolii, PSA pre-biopsie, PSAD preoperator, GS la biopsie, numărul total de carote de biopsie prelevate și numărul de carote de biopsie cu cancer și am analizat asocierea acestor factori cu ameliorarea GS după RP. Pentru fiecare variabilă au fost utilizate diferite valori cut-off pentru a identifica și cuantifica o potențială relație cu upgrade-ul Gleason. Am analizat, de asemenea, asocierea upgrade-ului GS cu variabilele sindromului metabolic, cum ar fi diabetul zaharat (DM), hipertensiunea arterială (HBP) și obezitatea, care au fost obținute din dosarele clinice ale pacienților. Ultimele variabile au fost incluse deoarece studiile anterioare au arătat asocierea lor cu un prognostic mai prost și o rată de recurență mai mare.18,19
PSAD a fost calculat prin împărțirea valorii PSA preoperator la PV. PV a fost calculat prin ecografie transrectală folosind diametrul transversal maxim (D1), diametrul anteroposterior maxim (D2) și diametrul longitudinal maxim (D3), folosind formula D1×D2×D3×ϖ/6 bazată pe teoria dimensiunii elipsei prostatei.14 Biopsia prostatică a fost efectuată folosind protocolul descris anterior de spitalul nostru. Toți pacienții au fost ușor sedați și s-a administrat o singură doză i.v. de piperacilină/tazobactam cu 15 minute înainte de procedură.20 Am utilizat un ac de calibrul 18 cu un pistol de biopsie automat pentru a obține țesutul prostatic. Pentru prima biopsie, au fost prelevate 12-18 carote, în funcție de dimensiunea prostatei și de prezența nodulilor suspecți.21 Toate probele au fost plasate într-un recipient separat care a identificat locul corespunzător și au fost trimise la serviciul de patologie al spitalului nostru.
Statisticile descriptive au fost prezentate ca medie±deviație standard (DS) și mediană/IQR pentru variabilele continue și ca frecvență absolută și procent de distribuție pentru variabilele categorice. Pacienții upgradați postoperator la GS 7 sau mai mare au fost comparați cu cei care nu au fost upgradați. Pentru a determina diferențele medii și asemănările, variabilele categorice au fost comparate cu ajutorul testului chi-pătrat Pearson, iar variabilele continue cu testul median și testul t Student. Un test de regresie univariată a fost utilizat pentru detectarea predictorilor independenți semnificativi ai modernizării. A fost utilizată o curbă a caracteristicilor de funcționare a receptorului (ROC) și a fost calculată aria de sub curbă (AUC) pentru a arăta valoarea limită optimă pentru variabilele cu semnificație predictivă pentru upgrade-ul GS. Am estimat sensibilitatea, specificitatea, valoarea predictivă pozitivă și valoarea predictivă negativă a diferitelor puncte de cut-off propuse de alți autori, le-am aplicat la populația noastră și apoi le-am comparat cu valoarea noastră de cut-off. Toate testele au fost bilaterale și o valoare p de
Rezultate
Dintr-un total de 342 de pacienți din baza noastră de date, 144 (42,1%) au fost excluși deoarece au avut un GS ≥4 la biopsia de prostată. Au rămas 198 (57,9%) pacienți care au îndeplinit criteriile noastre de includere de GS 6 (3+3). Șaptezeci și trei dintre acești pacienți au fost excluși din cauza informațiilor clinice incomplete din fișele medicale.
Vârsta medie a pacienților a fost de 65,1±6,3 ani, indicele de masă corporală (IMC) a fost de 26,7±3,6kg/m2, numărul de carote prelevate a fost de 13,4±3,5, numărul de carote pozitive a fost de 2,5±2, iar PSAD preoperator a fost de 0,26±0,23ng/ml2. Mediana preoperatorie a PSA a fost de 7,2 IQR 5,67-10,05, iar PV a fost de 38 IQR 26,5-55,5. Stadiul clinic bazat pe examinarea rectală digitală a fost T1c la 86 (69,6%) pacienți, T2a la 28 (22,4%), T2b la 7 (5,6%), T2c la 2 (1,6%) și T3 la un pacient (0,8%).
PSA preoperator a fost clasificat după cum urmează: 6 (4,8%) pacienți au avut valori ale PSA
ng/ml, 88 (70,4%) au avut valori cuprinse între 4 și 9,9ng/ml, 23 (18,4%) au avut valori cuprinse între 10 și 19,9ng/ml, iar 8 (6,4%) au avut PSA ≥20ng/ml. GS la biopsie și GS chirurgical au rămas aceleași la 71 (56,8%) pacienți cu GS 3+3, în timp ce la 54 (43,2%) pacienți a avut loc un upgrade. Dintre pacienții cu upgrade, 70% au crescut la un GS de 7 și 30% au crescut la ≥8.
Tabelul 1 prezintă caracteristicile demografice și clinice ale pacienților cu și fără upgrade de GS. Am constatat o corelație semnificativă din punct de vedere statistic între upgrade-ul postoperator și valoarea PSAD preoperator (p0,001), PSA preoperator (p=0,039), PV (p=0,004) și vârsta pacientului ≥70 de ani (p=0.011).
Caracteristicile pacienților cu și fără upgrade al scorului Gleason după prostatectomia radicală.
| Caracteristici | Actualizare | Fără actualizare | Fără actualizare | p-Valoare |
|---|---|---|---|---|
| Nu. de pacienți (%) | 54 (43,2%) | 71 (56.8%) | ||
| Vârsta (ani) | ||||
| Medie±SD | 66.22±6,5 | 64,28±6,0 | 0,092b | |
| Vârsta (nr.) | ||||
| >70 de ani | 20 | 12 | 0.011*,a | |
| 34 | 59 | |||
| IMC (kg/m2) | ||||
| Medie±SD | 26.22±4,0 | 27,14±3,1 | 0,178c | |
| PSA (ng/ml) | ||||
| Mediană/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c | |
| Volumul prostatic (ml) | ||||
| Mediană/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c | |
| PSAD (ng/ml2) | ||||
| Medie±SD | .36±.27 | .19±.16 | *,c | |
| Core de biopsie (nr.) | ||||
| Media±SD | 12,9±3,4 | 13,7±3,7 | 0.240c | |
| Core pozitive (nr.) | ||||
| Medie±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c | |
| Obezitate (nr.) | ||||
| Pozitivă | 9 (16,6%) | 16 (22,5%) | 0.500a | |
| Negativ | 45 (83,4%) | 55 (77.5%) | ||
| DM (nr.) | ||||
| Pozitiv | 16 (29,6%) | 14 (19.7%) | 0,150a | |
| Negativ | 38 (70,4%) | 57 (80.3%) | ||
| HBP (nr.) | ||||
| Pozitiv | 21 (38.9%) | 30 (42,2%) | 0,775a | |
| Negativ | 33 (61,1%) | 41 (57.8%) | ||
IQR: interval interquartil; IMC: indice de masă corporală; PSA: antigen specific prostatic; PSAD: densitatea antigenului specific prostatic; DM: diabet zaharat; HBP: tensiune arterială ridicată.
Test X2.
Testul t al studentului.
Testul mediei.
Semnificativ din punct de vedere statistic cu o valoare p
Am estimat un punct de tăiere PSAD optim de 0.17ng/ml2 prin analiza ROC, cu o AUC de 0,675 (p=0,001, 95%CI .580-.770), iar apoi am analizat valorile cut-off propuse de alți autori și le-am comparat. Tabelul 2 și Fig. 1 prezintă aceste rezultate.
Analiză a diferitelor valori de cutoff ale PSAD ca predictor al îmbunătățirii GS.
| Upgrade | Nu upgrade | p | Odds raport | Sens % | Spec % | PPV % | NPV % | |||
|---|---|---|---|---|---|---|---|---|---|---|
| PSAD (nr.) | ||||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | ||
| 10 (18.5%) | 29 (40.8%) | |||||||||
| PSAD (nr.) | ||||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | ||
| 11 (20.4%) | 36 (50.7%) | |||||||||
| PSAD (nr.) | ||||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | ||
| 13 (24.1%) | 42 (59.2%) | |||||||||
| PSAD (nr.) | ||||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | ||
| 18 (33.4%) | 49 (69%) | |||||||||
PSAD: antigen specific prostatic.
Test X2.
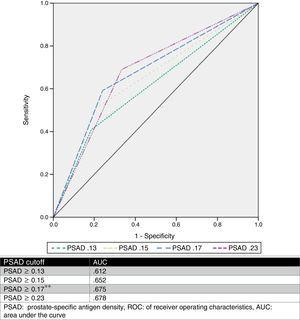
CurbaROC.
Tabelul 3 prezintă rezultatele regresiei univariate pentru detectarea predictorilor independenți ai modernizării.
Predictori independenți ai modernizării (regresie univariată).
| Caracteristici | HR | 95 CI | p value | |
|---|---|---|---|---|
| Vârsta | 0.5 | 0,99-1,11 | 0,09 | |
| >70 de ani | 1.06 | 1.26-6.63 | 0.039* | |
| BMI | 0.072 | 0.97-1.18 | 0,166 | |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* | |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* | |
| PSAD ≥0.17 | 1.51 | 2.98-9.99 | ||
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | ||
| PSA | 0,05 | 0,99-1,11 | 0,059 | |
| Volumul prostatei | 0.02 | 1,01-1,04 | 0,008* | |
| Carote pozitive la biopsie | 0.06 | 0,98-1,18 | 0,24 | |
| Obezitate | 0,31 | 0,31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0.152 | |
| HBP | 0.10 | 0.53-2.29 | 0.53-2.29 | 0.775 |
BMI: indice de masă corporală; PSA: antigen specific prostatic; PSAD: densitatea antigenului specific prostatic; DM: diabet zaharat; HBP: tensiune arterială ridicată.
Discuție
Diverse studii au constatat o lipsă de concordanță între raportul GS din biopsia prostatică și raportul de prostatectomie radicală. Într-o meta-analiză recentă care a inclus 14.839 de pacienți, autorii au estimat o îmbunătățire a GS la 30% dintre pacienți, doar 63% rămânând neschimbată după prostatectomie.22 Upgrade-ul Gleason a fost constatat în 29-58% din cazuri,23 și este mai rău în subgrupul de pacienți cu un GS 3+3 la biopsie (până la 63,3%).14 În centrul nostru spitalicesc, am constatat un upgrade GS la 42,1% din toți pacienții care au fost supuși prostatectomiei radicale și la 43,2% din pacienții cu un scor Gleason la biopsie de 3+3.
Mai mulți autori au încercat să găsească predictori ai upgrade-ului GS, în special în contextul popularității în creștere în prezent a protocoalelor AS. Predictorii descriși anterior sunt vârsta >60 de ani, valoarea PSA >5,0ng/ml și >25% de nuclee pozitive în timpul biopsiei.24
PSAD a fost analizat și au fost descrise mai multe valori cut-off (cum ar fi ≥0,13ng/ml, ≥0,15ng/ml și ≥0,23ng/ml).11,13,16,17 Cu toate acestea, nu există un consens cu privire la utilizarea acestei valori pentru a prezice cu exactitate un upgrade GS. Pe baza rezultatelor noastre, am propus o valoare cut-off de ≥0,17ng/ml, care a avut o ASC de 0,675, o sensibilitate de 75,9%, o specificitate de 59,2%, o VPP de 58,5% și o VNI de 76,3% pentru prezicerea upgrade-ului GS. Am selectat acest punct de tăiere, deoarece atunci când am analizat alte valori propuse în raport cu seria noastră de cazuri, cea mai bună AUC a fost obținută cu o valoare ≥0,23ng/ml (0,678), dar a avut o sensibilitate mai slabă și o rată ridicată de fals negativ (33,33%). Pe de altă parte, atunci când am utilizat valorile ≥0,13ng/ml și ≥0,15ng/ml, acestea au avut o rată fals pozitivă de 59% și, respectiv, 49%. Rata fals-negativă și rata fals-pozitivă a cut-off-ului propus de echipa noastră a fost de 24% și, respectiv, 41%, pe care le-am considerat cele mai utile. Fig. 2 prezintă un grafic al populației noastre.

Populația studiată, arătând diferitele densități ale antigenului specific prostatic și datele de actualizare.
Studiul nostru a inclus numai pacienți cu un GS la biopsie de 3+3, din cauza importanței acestei variabile atunci când se ia în considerare un pacient pentru SA. Având în vedere că există și alți factori luați în considerare pentru supravegherea activă, nu putem declara că riscul de îmbunătățire a GS și PSAD sunt variabile determinante pentru a propune o strategie terapeutică, dar credem cu siguranță că acestea ar trebui discutate înainte de a lua o decizie. O a doua biopsie ar putea fi indicată pentru pacienții cu un PSAD ≥0,17ng/ml, având în vedere riscul de subclasificare, pentru a corobora GS. RMN-ul prostatic și biopsiile de fuziune ghidate prin RMN au demonstrat o sensibilitate și o specificitate ridicate pentru localizarea cancerului semnificativ neidentificat.25 Cu toate acestea, aceste opțiuni nu sunt disponibile pe scară largă în Mexic, astfel încât biopsia de saturație sau biopsia șablon ghidată prin ecografie transrectală ar putea fi o opțiune mai viabilă pentru a crește acuratețea diagnosticului.
Dovezile recente au sugerat o asociere între diferitele componente ale sindromului metabolic și cancerul de prostată, crescând riscul de a prezenta boala și de a muri din cauza acesteia,21 precum și o rată mai mare de recidivă biochimică după tratamentul radical.22 Cu toate acestea, în studiul nostru nu am putut demonstra o asociere cu actualizarea scorului Gleason.
Volumul prostatei, care este direct legat de vârstă, ar putea fi un element de distragere a atenției. Atunci când se efectuează o biopsie aleatorie ghidată ecografic într-o prostată mare, există un risc potențial de a lăsa zone mai mari subeșantionate, ceea ce reprezintă un risc mai mare de a rata o tumoare semnificativă.
AS a oferit rezultate promițătoare la pacienții cu cancer de prostată cu risc scăzut, cu îmbunătățiri în ceea ce privește calitatea vieții, conservarea funcției erectile și a continenței urinare, precum și în ceea ce privește alte complicații asociate cu tratamentele radicale.6 Cu toate acestea, există riscul de a diagnostica greșit un cancer agresiv și de a întârzia tratamentul oportun, afectând prognosticul pacientului. Există numeroase criterii de selecție a candidaților la SA, iar clasificarea riscului D’Amico26 și criteriile Epstein27 sunt cele mai utilizate în acest scop. Prima nu include PSAD, dar în criteriile Epstein se sugerează utilizarea unei valori limită ≥0,15ng/ml. În spitalul nostru, folosim criterii foarte stricte, iar valoarea cut-off PSAD ≥0,17ng/ml va fi inclusă ca parte a discuției atunci când se selectează un posibil candidat pentru SA.
Caracterul retrospectiv al studiului nostru a fost principala sa limitare. Eșantionul potențial a fost redus și mai mult din cauza datelor incomplete din dosarele clinice. O altă limitare a fost faptul că nu am dispus de toate datele din probele de biopsie, astfel încât nu am putut analiza pacienții cu toate criteriile AS. Cu toate acestea, având în vedere numărul de pacienți incluși în studiu, s-au obținut rezultate semnificative, iar acestea pot fi folosite pentru a lua în considerare riscul de upgrade GS la pacienții cu GS 3+3.
Concluzii
Concludem că este important să folosim cât mai multe instrumente posibile pentru a lua decizii corecte și pentru a identifica pacienții cu risc ridicat de upgrade patologic care ar putea beneficia de o evaluare mai meticuloasă și/sau de un tratament agresiv. PSAD ar trebui să fie utilizat de rutină pentru a identifica pacienții cu cancer aparent cu risc scăzut care prezintă un risc de upgrade GS, ceea ce duce la o selecție mai precisă a candidaților pentru AS. Conform datelor noastre, putem evita o stadializare GS potențial incorectă în aproximativ 43% din cazuri.
Am constatat o frecvență ridicată de upgrade GS în populația noastră. În studiul nostru, valorile PSAD au fost asociate în mod semnificativ cu upgrade-ul, iar cea mai precisă valoare cut-off a fost de 0,17ng/ml2. Recomandăm ca în toate centrele spitalicești să se efectueze o analiză locală a riscului de upgrade GS și a potențialilor predictori ai acestuia înainte de a oferi supraveghere activă potențialilor candidați.
Declarații eticeProtecția subiecților umani și a animalelor
Autorii declară că nu au fost efectuate experimente pe oameni sau animale pentru acest studiu.
Confidențialitatea datelor
Autorii declară că în acest articol nu apar date despre pacienți.
Dreptul la confidențialitate și consimțământul informat
Autorii declară că în acest articol nu apar date despre pacienți.
Finanțare
Nu s-a primit niciun fel de sponsorizare pentru realizarea acestui articol.
Conflict de interese
Autorii declară că nu au niciun conflict de interese, nici nu au primit vreo sponsorizare pentru acest studiu.
.