Când o substanță își schimbă faza, adică trece fie din solid în lichid, fie din lichid în gaz, energia, are nevoie de energie pentru a face acest lucru. Energia potențială stocată în forțele interatomice dintre molecule trebuie să fie învinsă de energia cinetică mișcarea particulelor înainte ca substanța să poată schimba faza.
Dacă măsurăm temperatura substanței care este inițial solidă pe măsură ce o încălzim, obținem un grafic ca cel din figura 1.
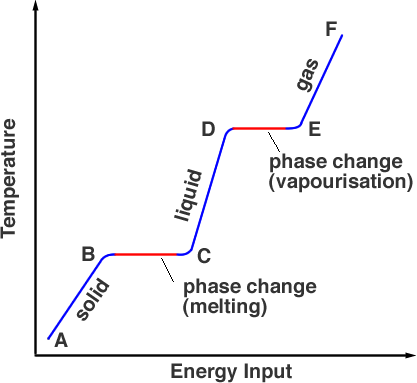
Începând dintr-un punct A, substanța se află în faza solidă, încălzirea acesteia aduce temperatura până la punctul de topire, dar materialul este încă solid în punctul B. Pe măsură ce este încălzit în continuare, energia de la sursa de căldură intră în ruperea legăturilor care țin atomii la locul lor. Acest lucru are loc de la B la C. În punctul C, toată faza solidă a fost transformată în fază lichidă. Încă o dată, pe măsură ce se adaugă energie, aceasta se transformă în energie cinetică a particulelor, ceea ce duce la creșterea temperaturii (de la C la D). În punctul D, temperatura a atins punctul de fierbere, dar se află încă în faza lichidă. De la punctul D la punctul E, energia termică învinge legăturile și particulele au suficientă energie cinetică pentru a scăpa din lichid. Substanța intră în faza gazoasă. Dincolo de punctul E, încălzirea suplimentară sub presiune poate crește și mai mult temperatura, acesta este modul în care funcționează o oală sub presiune.
Căldura latentă de fuziune și vaporizare
Energia necesară pentru a schimba faza unei substanțe este cunoscută sub numele de căldură latentă. Cuvântul latent înseamnă ascuns. Când schimbarea de fază este de la solid la lichid trebuie să folosim căldura latentă de fuziune, iar când schimbarea de fază este de la lichid la gaz, trebuie să folosim căldura latentă de vaporizare.
Energia necesară este Q= m L, unde m este masa substanței și L este căldura latentă specifică de fuziune sau de vaporizare care măsoară energia termică pentru a schimba 1 kg de solid în lichid.
Tabelul 1. prezintă
| Substanța | Căldura latentă specifică de fuziune kJ.kg-1 |
°C | Căldura latentă specifică de vaporizare kJ.kg-1 |
°C |
|---|---|---|---|---|
| Apă | 334 | 0 | 2258 | 100 |
| Etanol | 109 | -.114 | 838 | 78 |
| Acidul etanoic | 192 | 17 | 395 | 118 |
| Cloroformul | 74 | -.64 | 254 | 62 |
| Mercur | 11 | -.39 | 294 | 357 |
| Sulfur | 54 | 115 | 1406 | 445 |
| Hidrogen | 60 | -.259 | 449 | -253 |
| Oxigen | 14 | -219 | 213 | -183 |
| Nitrogen | 25 | -210 | 199 | -.196 |
Conducte de căldură
Cum crește densitatea de tranzitori într-un microprocesor, cantitatea de căldură disipată crește. Un procesor Pentium 4 (180 nm care funcționează la 2GHz) disipă, 55 de wați de energie sub formă de căldură. Suprafața sa este de numai 131 mm2. Acest lucru dă o putere de 55 W/(131/(102)) = 42 W cm-2. În comparație, un fier de călcat cu aburi are 5 Wcm-2.
O soluție este conducta de căldură. După cum sugerează și numele său, aceasta transferă căldura din regiunile cu temperaturi ridicate în regiunile cu temperaturi mai scăzute, unde există mai mult spațiu pentru radiatoare sau ventilatoare de răcire.
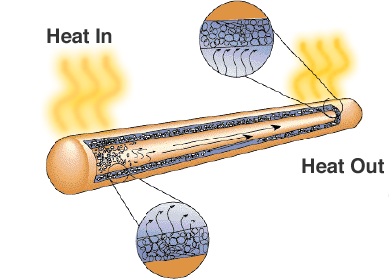
Deși arată doar ca o țeavă metalică etanșă, există un fitil sau un material poros și un lichid cu o căldură latentă mare de vaporizare. Când conducta este încălzită, lichidul folosește căldura pentru a se evapora și se transformă în gaz, gazul se deplasează într-o regiune mai rece a conductei de căldură unde se condensează și folosește căldura latentă pentru a se transforma din nou în lichid. Conductele de căldură reprezintă o soluție fiabilă și rentabilă pentru computerele portabile, unde ventilatoarele ar reduce durata de viață a bateriei.