
Succesul de lămâie are un gust acru deoarece conține între 5% și 6% acid citric și are un pH de 2,2. (aciditate ridicată)
pH (potențialul de hidrogen) este o scală de aciditate de la 0 la 14. Ea indică cât de acidă sau alcalină este o substanță. Soluțiile mai acide, au un pH mai mic. Soluțiile mai alcaline, au un pH mai mare. Substanțele care nu sunt acide sau alcaline (adică soluțiile neutre) au, de obicei, un pH de 7. Acizii au un pH mai mic de 7. Alcalinele au un pH care este mai mare de 7.
pH este o măsură a concentrației de protoni (H+) într-o soluție. S.P.L. Sørensen a introdus acest concept în anul 1909. P vine de la germanul potenz, însemnând putere sau concentrație, iar H de la ionul de hidrogen (H+).
Substanțele alcaline au, în loc de ioni de hidrogen, o concentrație de ioni de hidroxid (OH-).
Indicatori de pH
Un indicator de pH este un compus chimic adăugat în cantități mici la o soluție, astfel încât pH-ul (aciditatea sau bazicitatea) soluției să poată fi văzut. Indicatorul de pH este un detector chimic de ioni de hidroniu (H3O+) sau de ioni de hidrogen (H+). În mod normal, indicatorul face ca culoarea soluției să se schimbe în funcție de pH.
Indicatorii tipici sunt fenolftaleina, portocaliul de metil, roșul de metil, albastrul de bromotimol și albastrul de timol. Fiecare dintre aceștia își schimbă culoarea în puncte diferite de pe scara pH-ului și pot fi folosiți împreună ca indicator universal.
O altă modalitate este folosirea hârtiei de turnesol, care se bazează pe un indicator natural de pH. Hârtia vă poate spune cât de puternică este substanța chimică, dacă este un acid mai puternic sau o bază mai puternică.
Câteva valori comune ale pH-ului
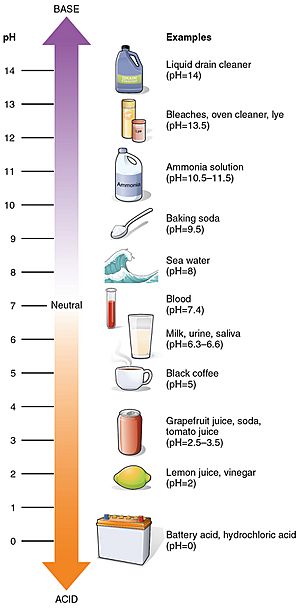
Valorile pH-ului unor substanțe comune
Neutralizarea
Neutralizarea poate fi rezumată prin ecuația:
Neutralizarea poate fi rezumată prin ecuația:
H+ + OH- → H2O
(acid + bază → apă)
Pagini înrudite
- Acid
- Bază
- Alcalin
- Titratare
- Transpirație(Sreekanta Das).
Imagini pentru copii
-
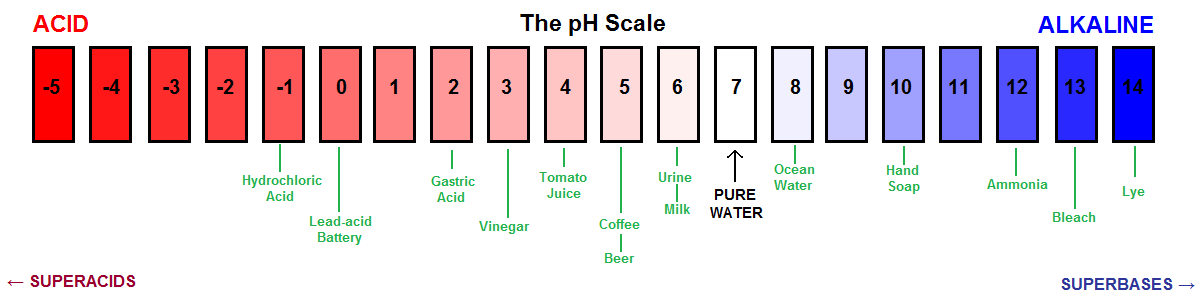
O altă reprezentare vizuală a scalei pH.
-

Intervale de referință pentru analizele de sânge, arătând concentrația de protoni (violet) în stânga. Se poate observa că intervalele sunt menținute într-un interval îngust și că protonii liberi sunt printre compușii cu cele mai mici concentrații masice.
-

Graficul care arată variația culorii hârtiei indicatoare universale în funcție de pH
.