Introducere
Neutrofilele sunt cea mai abundentă populație de celule albe circulante din sânge și prima linie de apărare a gazdei împotriva agenților patogeni invadatori . În condiții normale, neutrofilele circulante au un timp de înjumătățire de 6-12 h și sunt quiescente din punct de vedere funcțional. În timpul inflamației, neutrofilele ajung rapid la locurile de infecție și leziune, sporesc activitatea antimicrobiană și mor în țesutul infiltrat . Acestea joacă roluri importante în sistemul imunitar înnăscut, iar răspunsuri semnificative ale neutrofilelor sunt observate în inflamațiile sistemice, cum ar fi traumatismele, arsurile, sepsisul și intervențiile chirurgicale majore .
Cu toate acestea, dereglarea răspunsurilor neutrofilelor, cum ar fi eliberarea excesivă sau necontrolată de citokine proinflamatorii, poate provoca leziuni ale țesutului gazdă sau ale organelor în timpul sepsisului sever și al bolilor autoimune .
Terapia de îndepărtare a leucocitelor (LRT), leucocitafereza (LCAP) sau afereza de granulocite/monocite (GMA) este o metodă de afereză terapeutică care îndepărtează leucocitele periferice prin intermediul circulației extracorporale. A fost utilizată ca tratament non-farmacologic în colita ulcerativă (UC) și în boala Crohn (CD) și a demonstrat o eficacitate excelentă pe termen scurt.
S-a raportat că LCAP folosind Cellsorba, o coloană de fibre de polietilenă teleftalată (Asahi-Kasei Medical, Tokyo, Japonia), elimină ~100% din granulocite/monocite, ~60% din limfocite și ~50% din trombocite atât la intrarea cât și la ieșirea din aparatul Cellsorba . Deși mecanismele exacte ale LRT nu au fost pe deplin explorate, au fost raportate mecanismele lor potențiale, care includ o reducere a numărului de leucocite activate sau de citokine proinflamatorii, cum ar fi factorul de necroză tumorală (TNF)-α, interleukina (IL)-1β, IL-6 și IL-8 .
Infecția locului de operație (SSI) rămâne una dintre cele mai frecvente cauze de morbiditate în intervențiile chirurgicale majore, care prelungește spitalizarea și crește costurile medicale . Supravegherea prospectivă multicentrică japoneză a arătat că 19,5% dintre pacienții cu UC au dezvoltat SSI după intervenția chirurgicală .
Într-un studiu caz-control, am comparat retrospectiv incidența SSI între pacienții care au suferit o proctocolectomie cu anastomoză ileală pouch-anal (IPAA) (n=29) și cei care au suferit IPAA cu LCAP postoperatorie (n=43). LCAP postoperatorie a redus semnificativ SSI la pacienții cu UC supuși proctocolectomiei cu IPAA (p<0,01) . Într-un studiu prospectiv multicentric pe care l-am efectuat, incidența SSI-urilor a fost comparată între pacienții cu UC supuși unei intervenții chirurgicale (grup de control; n=103) și cei supuși unei intervenții chirurgicale cu LCAP postoperatorie (n=40). SSI au apărut la 4 din 37 de pacienți (10,8%) în grupul LCAP, în timp ce au apărut la 29 din 103 pacienți (28,2%) în grupul de control, deși diferența nu a atins semnificația statistică (p=0,069) .
Aceste observații clinice sugerează că LCAP elimină leucocitele activate producătoare de citokine proinflamatorii în inflamația sistemică postoperatorie datorată unei intervenții chirurgicale colorectale majore și ar putea suprima apariția SSI. Am raportat o asociere între disfuncția neutrofilelor și complicațiile infecțioase postoperatorii .
Neutrofilele sunt cele mai abundente celule dintre leucocitele circulante și pot fi cel mai frecvent eliminate de LCAP . Astfel, ne-am concentrat asupra funcțiilor neutrofilelor circulante izolate înainte și după LCAP, pentru a clarifica mecanismele terapeutice ale LCAP postoperatorii asupra apariției SSI la pacienții cu UC după intervenția chirurgicală.
Materiale și metodă
Pacienți
Patruzeci și trei de pacienți cu UC supuși IPAA au primit LCAP postoperatorie la Departamentul de Chirurgie Gastrointestinală și Pediatrică al Școlii de Medicină Absolventă a Universității Mie din 2004 până în 2008. Diagnosticul de UC s-a bazat pe datele clinice, radiografice, endoscopice, chirurgicale și histopatologice. Înainte de intervenția chirurgicală, pacienții au primit diverse tratamente medicale, inclusiv medicamente antiinflamatoare (aminosalicilați, corticosteroizi) sau medicamente imunosupresoare (azatioprină, mercaptopurină, ciclosporină), sau ambele. LCAP postoperatorie a fost efectuată o dată în decurs de 2 ore după operație. Pacienții cu simptome clinice de sepsis au fost excluși din studiu. Pacienții cu hemodinamică instabilă în urma intervenției chirurgicale au fost, de asemenea, excluși în conformitate cu protocolul. Consimțământul informat în scris a fost obținut de la toți pacienții înainte de începerea acestui studiu, care au fost efectuate în conformitate cu Declarația de la Helsinki și au fost aprobate de către Institutional Review Board (nr. 474).
Izolarea neutrofilelor
Neutrofilele pre- și post-LCAP au fost izolate de la aceiași pacienți înainte și după operație. Izolarea neutrofilelor s-a bazat pe o procedură descrisă anterior . Probele de sânge (10 ml) au fost diluate cu un volum egal de soluție salină tamponată cu fosfat (PBS), stratificate peste un volum de Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canada) și centrifugate la 600 × g timp de 30 min la temperatura camerei. După îndepărtarea celulelor mononucleare, a plasmei și a Ficoll-Paque PLUS, peleta a fost resuspendată în 12 ml de soluție de clorură de amoniu pentru a liza globulele roșii, spălată de două ori în PBS și resuspendată în PBS. Neutrofilele au fost spălate de două ori cu PBS și resuspendate în TCM-10 . Preparatele de celule au fost testate pentru viabilitate (>99%) prin excludere cu albastru tripan și pentru puritate (>95% granulocite CD13+, CD33+) prin citometrie de flux.
Activitatea fagocitară
Activitatea fagocitară ex vivo a neutrofilelor circulante împotriva Escherichia coli a fost comparată între neutrofilele pre- și post-LCAP izolate de la pacienți identici.
Fagocitoza neutrofilelor a fost măsurată folosind bioparticule fluorescente . Pentru a opsoniza bioparticulele bacteriene, reactivul de opsonizare reconstituit și bioparticulele bacteriene (5 × 105) au fost amestecate, vortexate și incubate timp de 1 h la 37°C într-un incubator umidificat cu 5% CO2. După două spălări cu PBS, separate prin centrifugare cu viteză redusă (1500 × g, 15 min, 4°C), peleții au fost incubați cu neutrofile (5 × 105) în 1 ml de mediu fără antibiotice timp de 3 h la 37°C într-un incubator umidificat cu 5% CO2. După 3 h de incubație, activitatea fagocitară a neutrofilelor împotriva E. coli a fost analizată cu ajutorul unui FACScan (Becton-Dickinson, San Jose, CA, SUA) și au fost numărate 10.000 de evenimente pentru fiecare probă.
Prepararea E. coli. coli
Escherichia coli (ATCC25922) a fost achiziționată de la American Type Culture Collection (Manassas, VA, SUA) și cultivată în Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokyo, Japonia) timp de 10 h la 37°C. Mediul de cultură a fost centrifugat la 1 700 × g timp de 10 minute la temperatura camerei pentru a se obține un granuleț, care a fost spălat de două ori și resuspendat în soluție salină normală sterilă. O parte aliquotă (100 μL) din suspensie a fost diluată în serie cu soluție salină sterilă, a fost plasată pe Agar-B (Qbiogene, Carlsbad, CA, SUA) și incubată timp de 18 ore pentru a determina concentrația bacteriană. Restul a fost păstrat la -80°C până la utilizare.
Co-cultură de neutrofile cu E. coli
Cu puțin înainte de utilizare, suspensia de E. coli a fost diluată în mediu pentru a se obține o concentrație finală de 2,5 × 106 ufc/mL. După opsonizarea E. coli cu ajutorul serului autolog timp de 30 min la 37°C, neutrofilele (2,5 × 105 /mL) au fost cocultivate în 1 ml de mediu fără antibiotice timp de 3 h la 37°C într-un incubator umidificat cu 5% CO2. După centrifugarea celulelor la 600 × g timp de 10 min la 4°C, supranatantele au fost colectate pentru a analiza producția de citokine, elastază neutrofilă (NE) și viabilitatea neutrofilelor.
Viabilitatea neutrofilelor
Viabilitatea ex vivo a neutrofilelor circulante împotriva E. coli a fost comparată între neutrofilele pre- și post-LCAP izolate de la pacienți identici. Pentru a evalua viabilitatea neutrofilelor după co-cultura cu E. coli, s-a efectuat un test de apoptoză .
Apoptoza neutrofilelor după co-cultura cu E. coli a fost cuantificată prin citometrie în flux cu ajutorul unui kit de detectare a apoptozei Annexin V (BioVision Research Products, Palo Alto, CA, SUA). Neutrofilele au fost incubate în soluție tampon de legare 1X la care s-au adăugat 5 μL de Annexin V-fluoresceină izotiocianat (FITC) și 5 μL de iodură de propidiu (PI). După incubare la temperatura camerei timp de 5 minute la întuneric, celulele au fost analizate cu ajutorul unui FACScan și s-au numărat 10 000 de evenimente pentru fiecare probă.
Combinația de Annexin V-FITC și PI a fost capabilă să facă distincția între celulele apoptotice timpurii (Annexin V+, PI-), celulele necrotice (Annexin V-, PI+), celulele apoptotice târzii sau necrotice secundare (Annexin V+, PI+) și celulele viabile (Annexin V-, PI-).
Dezvoltarea imunoenzimatică (ELISA)
Citokinele din serul pacienților înainte și după LCAP și din supernatantele după co-cultura neutrofilelor pre- și post-LCAP cu E. coli au fost măsurate prin ELISA în conformitate cu instrucțiunile producătorului. Citokinele au inclus TNF-α, antagonistul receptorului IL-1 (IL-1Ra), IL-6, IL-8 și NE. Kiturile ELISA TNF-α, IL-1Ra, IL-6 și IL-8 au fost achiziționate de la R&D Systems (Minneapolis, MN, SUA). Kitul ELISA NE a fost achiziționat de la Immundiagnostik (Bensheim, Germania). Limitele de detecție ale TNF-α, IL-1Ra, IL-6, IL-8 și NE au fost de 1, 2, 0,01, și 2 pg/mL și, respectiv, 0,12 ng/mL, iar nivelurile sub aceste limite au fost considerate nedetectabile. Nivelul fiecărei citokine a fost evaluat în dublu exemplar și a fost calculată valoarea medie a citokinei.
Analiză statistică
Toate analizele statistice au fost efectuate utilizând JMP versiunea 5 (SAS Institute, Cary, NC, SUA). Asociațiile dintre variabilele continue și categorice au fost evaluate utilizând testul U Mann-Whitney sau testul t împerecheat atunci când a fost cazul. P<0,05 a fost considerat semnificativ din punct de vedere statistic.
Rezultate
Caracteristicile pacienților
Vreo 29 de pacienți cu UC supuși IPAA au primit LCAP postoperator. Caracteristicile pacienților sunt prezentate în tabelul 1. Vârsta medie la diagnostic a fost de 27 de ani (interval 15-54 de ani), iar vârsta medie la intervenția chirurgicală a fost de 33 de ani (interval 16-61 de ani). Durata bolii a fost de 6,9 ani (interval 0,1-28 ani). Colita stângă a fost prezentă la 6/29 (21%) pacienți, iar colita pan-colită la 23/29 (79%) pacienți. severitatea bolii a fost clasificată ca fiind ușoară (7; 24%), moderată (11; 38%) și severă (4; 38%).
| Caracteristicile pacienților | |
|---|---|
| Variabile | Pacienți (n=29) Număr |
| Gender | |
| Bărbat | 19 |
| Femeie | 10 |
| Vârsta la diagnostic | 27( 15-54) |
| Vârsta la intervenția chirurgicală | 33(16-61) |
| Durata bolii | 6.9 (0.1-28) |
| Severitatea bolii | |
| frumoasă | 7 |
| moderată | 11 |
| severe | 4 |
| Dispariția bolii | |
| Stâng.colită laterală | 6 |
| Pan. colită | 23 |
| Sistem de clasificare a malților | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Doza totală de steroizi (mg) | 17285 (800-70000) |
| Utilizarea de imunosupresoare | |
| Da | 5 |
| Nu | 24 |
| Timp de operație (min) | 262.4 (118-496) |
| Pierdere de sânge (ml) | 307,9 (17-826) |
Tabelul 1: Caracteristicile pacienților.
Schimbarea în timp a numărului de WBC, neutrofile și trombocite
WBC, neutrofile și trombocite au fost numărate înainte de operație, înainte de LCAP (după operație) și, respectiv, după LCAP (în decurs de 12 ore după LCAP). După cum se arată în figura 1, numărul de WBC, neutrofile și trombocite a fost semnificativ mai mic după LCAP decât înainte de LCAP. Toți pacienții cărora li s-a administrat LCAP postoperator nu au avut niciun efect advers hematologic.
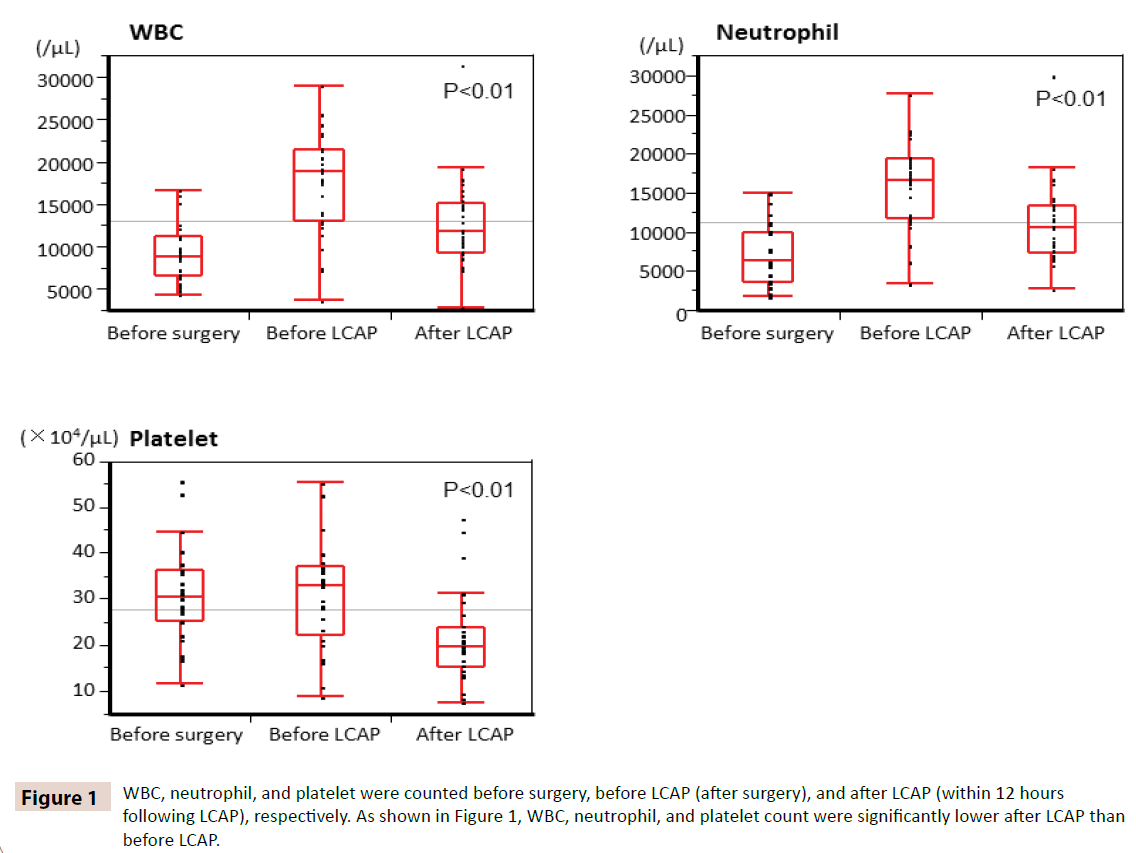
Figura 1: WBC, neutrofilele și trombocitele au fost numărate înainte de operație, înainte de LCAP (după operație) și, respectiv, după LCAP (în decurs de 12 ore după LCAP). După cum se arată în figura 1, numărul de WBC, neutrofile și trombocite a fost semnificativ mai mic după LCAP decât înainte de LCAP.
Activitatea fagocitară a neutrofilelor față de E. coli
Pentru a clarifica dacă LCAP influențează activitatea fagocitară a neutrofilelor circulante, activitatea fagocitară față de E. coli a fost comparată între neutrofilele pre- și post-LCAP. După cum se arată în figura 2, nu s-a observat nicio diferență semnificativă în activitatea fagocitară a neutrofilelor (intensitatea fluorescentă medie) împotriva E. coli între neutrofilele pre-LCAP (mediana 1259,4, interval 50,8-3505,6) și cele post-LCAP (mediana 1077,6, interval 24,4-4152,1) (P=0,72). Aceste rezultate sugerează că LCAP nu afectează activitatea fagocitară a neutrofilelor circulante împotriva E. coli.
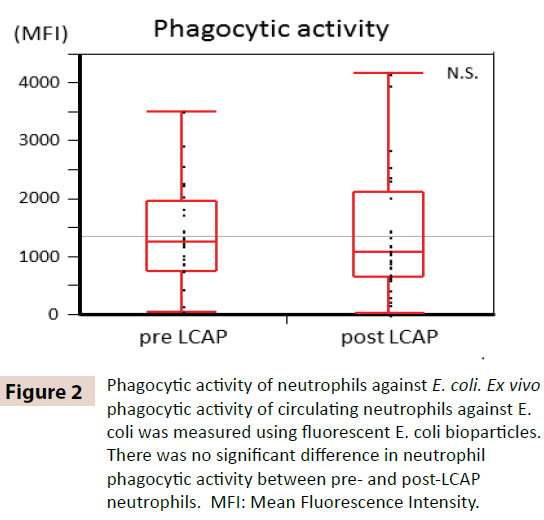
Figura 2: Activitatea fagocitară a neutrofilelor împotriva E. coli. Activitatea fagocitară ex vivo a neutrofilelor circulante împotriva E. coli a fost măsurată cu ajutorul bioparticulelor fluorescente de E. coli. Nu a existat nicio diferență semnificativă în ceea ce privește activitatea fagocitară a neutrofilelor între neutrofilele pre- și post-LCAP. MFI: Mean Fluorescence Intensity.
Viabilitatea neutrofilelor după co-cultura cu E. coli
Pentru a clarifica dacă LCAP influențează răspunsul neutrofilelor împotriva infecției bacteriene, viabilitatea neutrofilelor împotriva E. coli a fost comparată între neutrofilele pre- și post-LCAP. Procentele de celule viabile (Annexin V-, PI-), de celule apoptotice timpurii (Annexin V+, PI-), de celule necrotice (Annexin V-, PI+) și de celule apoptotice târzii sau necrotice secundare (Annexin V+, PI+) au fost comparate între neutrofilele pre- și post-LCAP. După cum se arată în figura 3, procentul median de neutrofile viabile în cocultură cu E. coli a fost mai mare la neutrofilele post-LCAP (mediana 34,2%, interval 1,16- 77,7%) decât la cele pre-LCAP (mediana 27,9%, interval 0,53-89,7%), deși diferența nu a atins semnificația statistică (P=0,82). Procentul de neutrofile necrotice din cocultura cu E. coli a fost semnificativ mai mic la neutrofilele post-LCAP (mediana 0,73%, interval 0,0-26,0%) decât la neutrofilele pre-LCAP (mediana 1,14%, interval 0,0-26,0%) (P=0,0232).
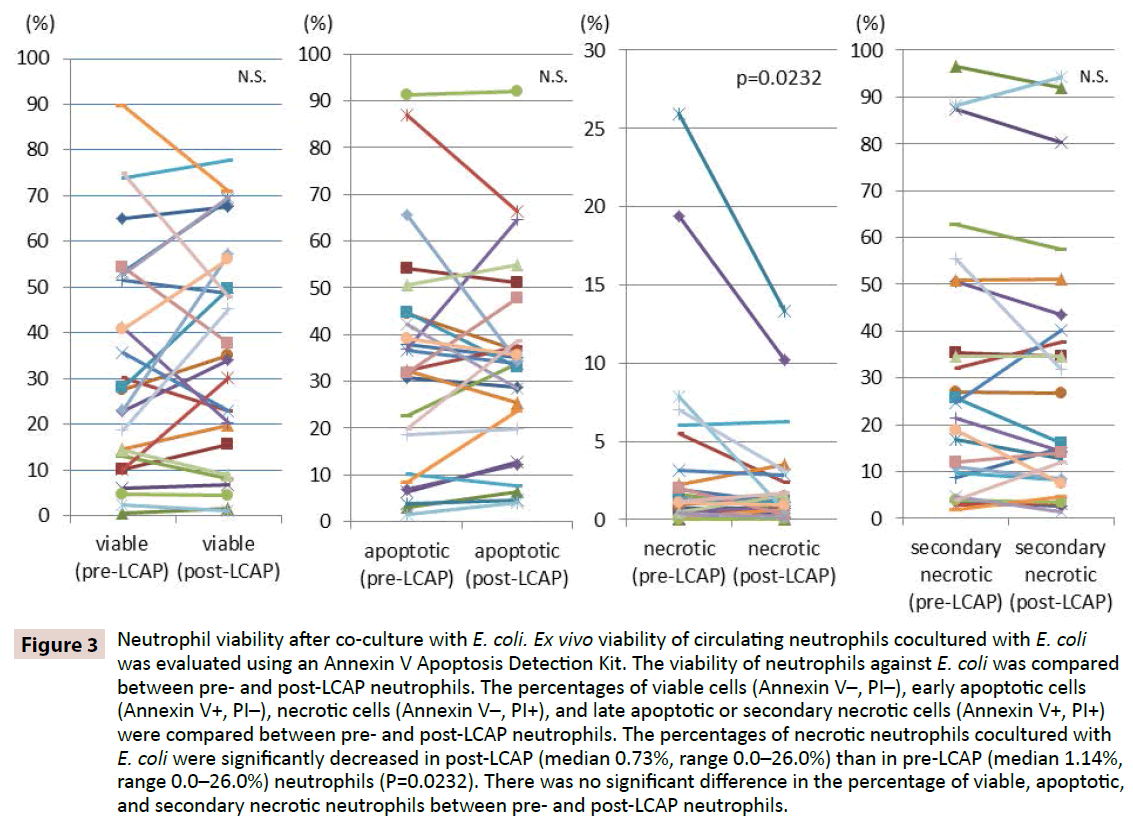
Figura 3: Viabilitatea neutrofilelor după cocultura cu E. coli. Viabilitatea ex vivo a neutrofilelor circulante în cocultură cu E. coli a fost evaluată cu ajutorul unui kit de detectare a apoptozei Annexin V. Viabilitatea neutrofilelor împotriva E. coli a fost comparată între neutrofilele pre- și post-LCAP. Procentajele de celule viabile (Annexin V-, PI-), de celule apoptotice timpurii (Annexin V+, PI-), de celule necrotice (Annexin V-, PI+) și de celule apoptotice târzii sau necrotice secundare (Annexin V+, PI+) au fost comparate între neutrofilele pre- și post-LCAP. Procentajele de neutrofile necrotice cocultivate cu E. coli au fost semnificativ mai mici la neutrofilele post-LCAP (mediana 0,73%, interval 0,0-26,0%) decât la cele pre-LCAP (mediana 1,14%, interval 0,0-26,0%) (P=0,0232). Nu a existat nicio diferență semnificativă în ceea ce privește procentul de neutrofile viabile, apoptotice și necrotice secundare între neutrofilele pre- și post-LCAP.
Nu a fost observată nicio diferență semnificativă în ceea ce privește procentul de neutrofile apoptotice cocultivate cu E. coli între neutrofilele pre-LCAP (mediana 32,3%, interval 1,51-91,2%) și post-LCAP (mediana 33,8%, interval 4,0-92,1%) (P=0,57). De asemenea, nu s-a observat nicio diferență semnificativă în ceea ce privește procentul de neutrofile apoptotice târzii sau necrotice secundare cocultivate cu E. coli între neutrofilele pre- LCAP (mediana 23,1%, interval 1,81-96,5%) și post- LCAP (mediana 16,1%, interval 1,44-94,3%) (P=0.13).
Aceste rezultate sugerează că LCAP poate scădea subsetul distinct de neutrofile circulante care induc necroza împotriva infecției bacteriene și crește numărul de neutrofile viabile (probabil neamorsate) în circulația sistemică.
Producția de citokine de către neutrofile după cocultura cu E. coli
Pentru a clarifica dacă LCAP influențează producția de citokine de către neutrofilele circulante, nivelurile de citokine din supernatantele de cultură după cocultura cu E. coli au fost comparate între neutrofilele pre și post LCAP. După cum se arată în figura 4, nu a existat nicio diferență semnificativă în ceea ce privește nivelurile de NE, TNF-α, IL-6, IL-8 și IL-1Ra în supernatantele de cultură între neutrofilele pre- și post-LCAP. Aceste rezultate sugerează că LCAP nu afectează producția de citokine a neutrofilelor circulante împotriva E. coli.
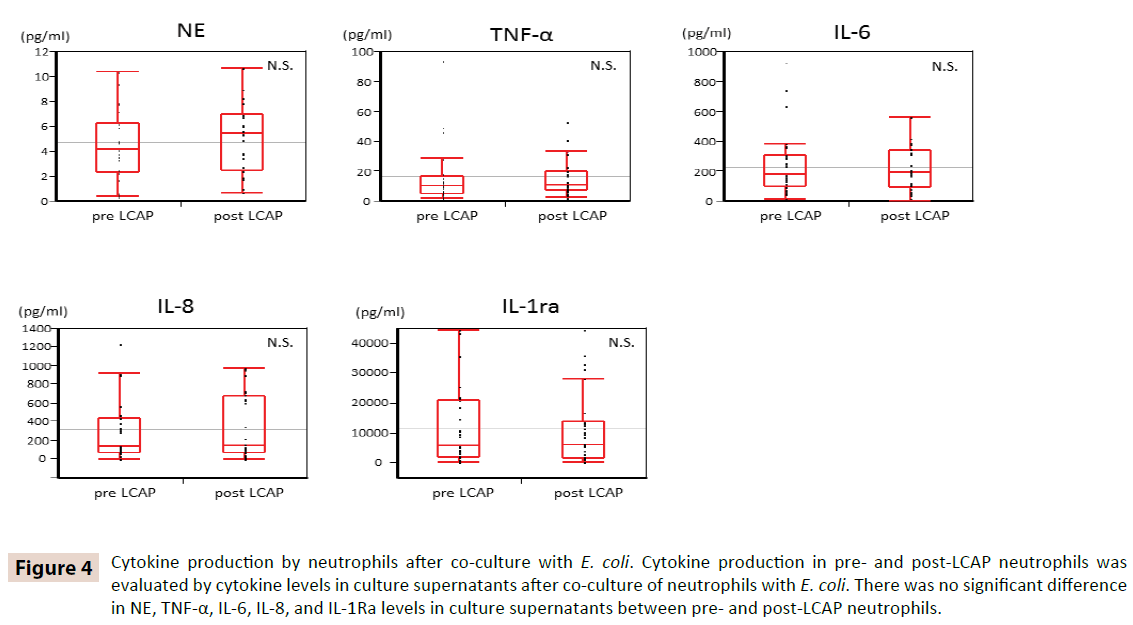
Figura 4: Producția de citokine de către neutrofile după co-cultura cu E. coli. Producția de citokine în neutrofilele pre- și post-LCAP a fost evaluată prin nivelurile de citokine din supernatantele de cultură după co-cultura neutrofilelor cu E. coli. Nu a existat nicio diferență semnificativă în ceea ce privește nivelurile de NE, TNF-α, IL-6, IL-8 și IL-1Ra în supernatantele de cultură între neutrofilele pre- și post-LCAP.
Citokine serice înainte și după LCAP
Pentru a clarifica dacă LCAP influențează răspunsul inflamator sistemic al gazdei, citokinele serice au fost măsurate folosind probe de sânge prelevate înainte și după LCAP. După cum se arată în figura 5, NE seric după LCAP (mediana 5,62 pg/mL, interval 0,16-10,4 pg/mL) a fost semnificativ mai mare decât cea de dinainte de LCAP (mediana 2,87 pg/mL, interval 0,15-7,61 pg/mL) (P=0,0251). Nu s-au constatat diferențe semnificative în ceea ce privește nivelurile serice de TNF-α, IL-6, IL-8 și IL-1Ra înainte și după LCAP.
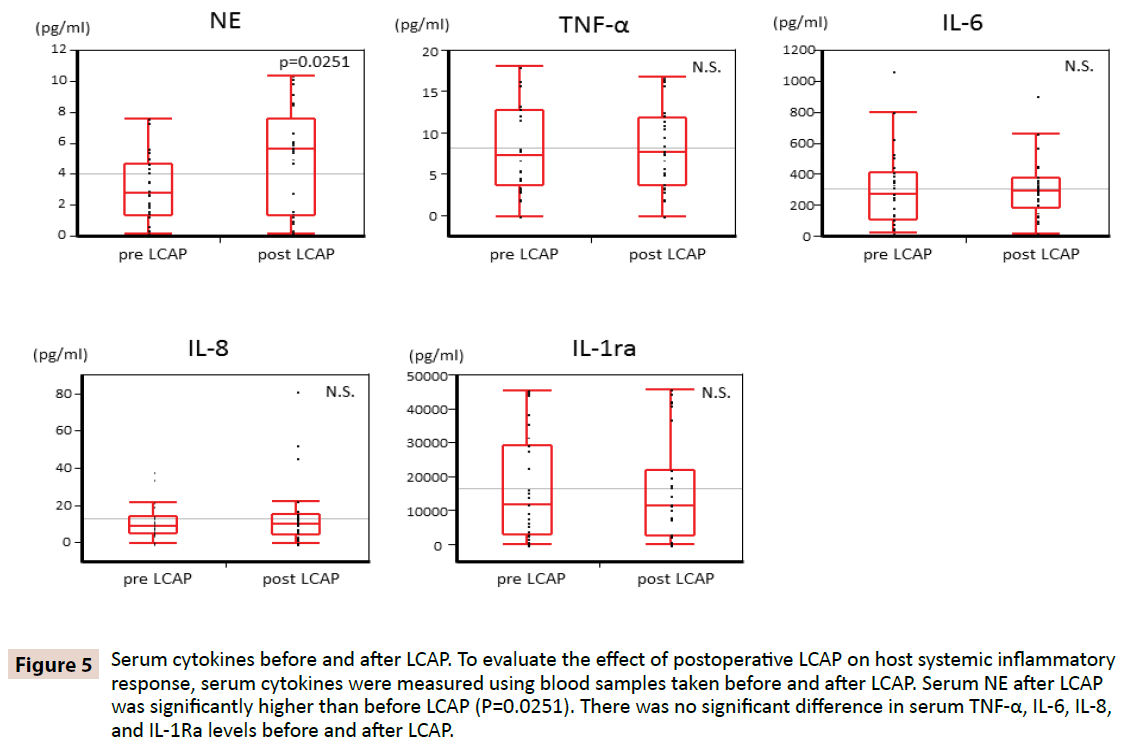
Figura 5: Citokine serice înainte și după LCAP. Pentru a evalua efectul LCAP postoperator asupra răspunsului inflamator sistemic al gazdei, citokinele serice au fost măsurate folosind probe de sânge prelevate înainte și după LCAP. NE seric după LCAP a fost semnificativ mai mare decât înainte de LCAP (P=0,0251). Nu a existat nicio diferență semnificativă în ceea ce privește nivelurile serice de TNF-α, IL-6, IL-8 și IL-1Ra înainte și după LCAP.
Asociații ale funcțiilor neutrofilelor post-LCAP cu timpul de operație sau cu numărul neutrofilelor postoperatorii
Pentru a clarifica dacă funcțiile neutrofilelor circulante după LCAP influențează apariția SSI, am examinat asocierea dintre activitatea fagocitară sau producția de citokine a neutrofilelor post-LCAP și factorii de risc ai SSI legați de stresul chirurgical, cum ar fi timpul de operație, pierderea de sânge și numărul neutrofilelor postoperatorii.
Așa cum se arată în figura 6, NE în supernatantele după co-cultura neutrofilelor post-LCAP cu E. coli a fost semnificativ mai mare la pacienții cu timp operator >3 h (mediana 5,65 pg/mL, interval 0,97-10.7 pg/mL) decât la cei cu timp operator <3 h (mediana 1,05 pg/mL, interval 0,72-2,44 pg/mL) (P=0,0158).
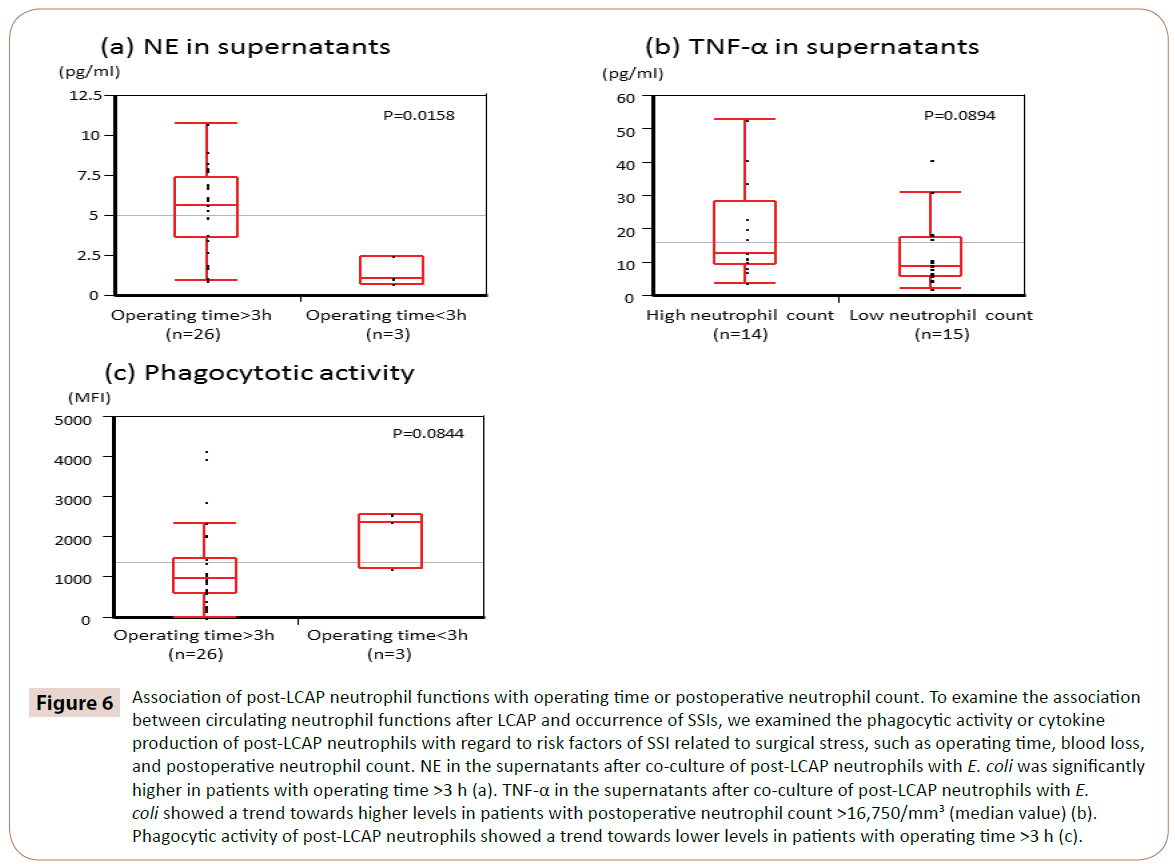
Figura 6: Asocierea funcțiilor neutrofilelor post-LCAP cu timpul operator sau cu numărul de neutrofile postoperatorii. Pentru a examina asocierea dintre funcțiile neutrofilelor circulante după LCAP și apariția SSI, am examinat activitatea fagocitară sau producția de citokine a neutrofilelor post-LCAP în ceea ce privește factorii de risc ai SSI legați de stresul chirurgical, cum ar fi timpul de operație, pierderea de sânge și numărul neutrofilelor postoperatorii. NE în supernatantele după co-cultura neutrofilelor post-LCAP cu E. coli a fost semnificativ mai mare la pacienții cu timp operator >3 h (a). TNF-α în supernatantele după co-cultura neutrofilelor post-LCAP cu E. coli a arătat o tendință spre niveluri mai ridicate la pacienții cu un număr postoperator de neutrofile >16.750/mm3 (valoare mediană) (b). Activitatea fagocitară a neutrofilelor post-LCAP a arătat o tendință spre niveluri mai scăzute la pacienții cu timp operator >3 h (c).
TNF-α în supranaturile după co-cultura neutrofilelor post-LCAP cu E. coli a arătat o tendință spre niveluri mai ridicate la pacienții cu un număr de neutrofile postoperatorii >16.750/mm3 (valoare mediană) (P=0,0894).
Activitatea fagocitară a neutrofilelor post-LCAP împotriva E. coli a arătat o tendință spre niveluri mai scăzute la pacienții cu timp operator >3 h (P=0,0844).
Asocieri între TNF-α seric după LCAP și SSI
Pentru a clarifica dacă răspunsul inflamator sistemic al gazdei după LCAP influențează apariția SSI, am examinat asocierea dintre nivelurile citokinelor serice după LCAP și apariția SSI.
Cum se arată în figura 7, TNF-α seric după LCAP a arătat o tendință spre niveluri mai ridicate la pacienții care au dezvoltat SSI decât la cei care nu au dezvoltat SSI (P=0,0714).
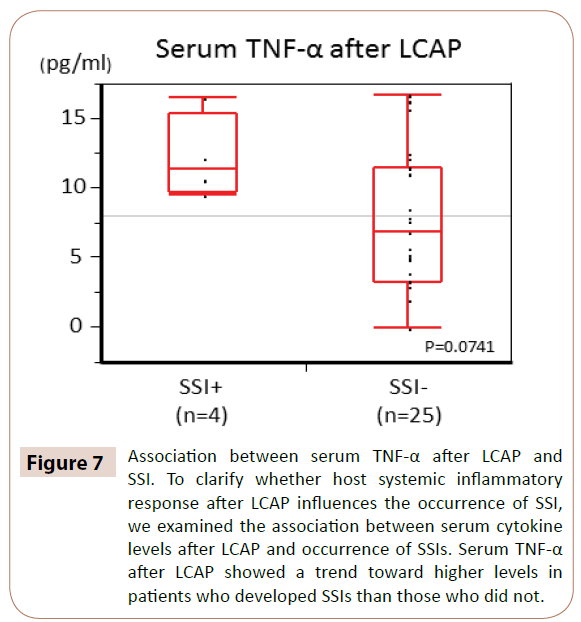
Figura 7: Asocierea dintre TNF-α seric după LCAP și SSI. Pentru a clarifica dacă răspunsul inflamator sistemic al gazdei după LCAP influențează apariția SSI, am examinat asocierea dintre nivelurile citokinelor serice după LCAP și apariția SSI. TNF-α seric după LCAP a arătat o tendință spre niveluri mai ridicate la pacienții care au dezvoltat SSI decât la cei care nu au dezvoltat SSI.
Nu a existat nicio diferență semnificativă între nivelurile serice de IL-6, IL-8 și IL-1Ra după LCAP și apariția SSI.
Discuție
Au fost raportate mai multe mecanisme posibile de acțiune ale LCAP sau GMA , deși mecanismele lor exacte nu au fost investigate pe deplin. Variabilitatea rezultatelor părea să depindă de diferențele dintre celulele sanguine utilizate pentru analize (granulocite, monocite sau limfocite), metodele de prelevare a sângelui (prelevate din linia de intrare sau de ieșire, sau din vena periferică) și subiecții studiului (voluntari sănătoși sau pacienți bolnavi).
Cei mai mulți cercetători au utilizat leucocite precum neutrofile, monocite sau limfocite prelevate din liniile de intrare și de ieșire ale unui dispozitiv de circulație extracorporală . Leucocitele din liniile de ieșire sunt celulele rămase filtrate de LCAP. Acestea sunt readuse imediat în circulația sistemică a pacienților și remixate cu leucocitele circulante. Leucocitele din liniile de ieșire reprezintă proporția mică a tuturor leucocitelor circulante după LCAP. Pentru a clarifica efectul sistemic al LCAP asupra sistemului imunitar al gazdei, am folosit neutrofile circulante izolate din venele periferice ale pacienților cu UC.
Strict vorbind, leucocitotafereza (LCAP) ar trebui să fie denumită leucocitafiltrare, deoarece poate nu numai să elimine leucocitele, ci și să le activeze prin intermediul filtrului. De fapt, LCAP nu poate absorbi și elimina toate celulele sanguine care au intrat în ea. Un anumit număr de celule sanguine pot trece prin filtru și apoi se pot întoarce în circulație. Se crede că celulele sanguine filtrate sunt activate prin filtrarea LCAP.
Neutrofilele sunt cea mai abundentă populație de leucocite și cele mai eficient eliminate de LCAP. Numărul estimat de leucocite filtrate este de aproape 1,1 × 1010 celule la o singură sesiune de LCAP , ceea ce ar putea fi comparabil cu eliminarea a aproape jumătate din numărul de neutrofile circulante (2 × 10-3 × 1010 celule). Astfel, am investigat diferența funcțională dintre neutrofilele pre-LCAP și post-LCAP în ceea ce privește răspunsul la E. coli pentru a clarifica mecanismele potențiale ale observației clinice conform căreia LCAP postoperatorie a redus incidența SSI. Cu toate acestea, LCAP utilizând Cellsorba poate elimina și activa nu numai neutrofilele, ci și celelalte celule sanguine (monocite, limfocite și trombocite) cu o eficacitate de eliminare diferită. Prin urmare, este necesar să se investigheze modificarea răspunsului la E. coli asupra nu numai a neutrofilelor, ci și a celorlalte celule sanguine între pre și post-LCAP, deși acestea nu au fost evaluate în acest studiu.
Unul dintre cele mai semnificative rezultate ale prezentului studiu a fost faptul că procentul de neutrofile necrotice a fost semnificativ redus atunci când neutrofilele post-LCAP au fost co-cultivate cu E. coli, în comparație cu neutrofilele pre-LCAP. Această observație sugerează că LCAP scade proporția de neutrofile care induc necroza de către E. coli și crește proporția de neutrofile viabile (probabil neamorsate) în circulația sistemică.
Au fost observate variații largi ale procentului de viabilitate, apoptoză sau necroză a neutrofilelor în co-cultivare cu E. coli. În datele noastre recente nepublicate, procentul de apoptoză timpurie (Annexin V+, PI-) în neutrofilele circulante a variat foarte mult, de la aproximativ 10% la 90% la pacienții cu inflamație sistemică, cum ar fi proteina C reactivă ridicată >0,3 mg/L. Aceste observații sugerează că neutrofilele pot fi deja apoptotice fără cocultură de E. coli din cauza unor insulte chirurgicale mai mari.
Necroza este considerată a fi moarte celulară necontrolată și pare să elibereze în mod neașteptat specii toxice de oxigen și enzime proteolitice . Se știe că necroza neutrofilelor este cauza principală a leziunilor căilor respiratorii și pulmonare în plămânii intens inflamați ai pacienților cu fibroză chistică . LCAP postoperatorie poate induce recrutarea în circulația sistemică a unui subset de neutrofile care este rezistent la moartea neașteptată sau necrotică necontrolată a celulelor împotriva infecției bacteriene, în plus față de eliminarea leucocitelor activate care provoacă inflamația sistemică.
În contrast cu rezultatele de mai sus ale experimentelor ex vivo, NE serică după LCAP a fost semnificativ crescută. Reducerea imediată a NE serice prin LCAP nu a fost observată. O posibilă explicație pentru acest lucru este că o singură sesiune de LCAP poate să nu suprime suficient eliberarea de NE de la neutrofilele din întregul corp în inflamația sistemică indusă de intervenția chirurgicală
Nutrofilele circulante după LCAP izolate de la pacienții cu un timp de operație mai lung (>3 h) sau cu un număr mai mare de neutrofile postoperatorii (>16.750/mm3; valoare mediană) au prezentat nu numai o activitate mai mare de producere de NE sau TNF-α, ci și o activitate fagocitară mai scăzută împotriva E. coli. Aceste constatări sugerează că neutrofilele izolate de la pacienții cu stres chirurgical ridicat prezintă o producție excesivă de citokine proinflamatorii sau o activitate fagocitară deficitară, chiar și după reînnoirea neutrofilelor prin LCAP postoperatorie.
Dintre cei 29 de pacienți cu UC cu LCAP postoperatorie, doar patru pacienți (13,8%) au dezvoltat SSI. TNF-α seric al acestora după LCAP a fost mai mare decât al celor fără SSI, deși diferența nu a atins semnificația statistică. Prin urmare, TNF-α seric poate fi util pentru identificarea pacienților care vor dezvolta SSI după LCAP postoperatorie. Cu toate acestea, nu a fost observată nicio asociere între dezvoltarea SSI-urilor și viabilitatea neutrofilelor, apoptoza sau necroza în co-cultivare cu E. coli, ceea ce se poate datora parțial dimensiunii mici a eșantionului.
Recent, neutrofilele circulante au fost recunoscute ca o populație eterogenă din punct de vedere funcțional și diferențiat amorsate împotriva diferitelor insulte . Noi am raportat semnificația clinică a neutrofilelor circulante în inflamația sistemică . Credem că neutrofilele circulante pot fi ținta principală pentru a explora efectul sistemic al LCAP asupra sistemului imunitar al gazdei.
În plus, unii cercetători au raportat că leucodepleția, care elimină celulele polimorfonucleare din circulația sistemică folosind filtre de leucocite, duce la o îmbunătățire semnificativă a funcției pulmonare și renale a pacienților care dezvoltă sindromul de răspuns inflamator sistemic (SIRS) după bypass-ul cardiopulmonar . Leucodepleția care vizează neutrofilele poate fi benefică pentru a preveni insuficiența de organ datorată SIRS .
În concluzie, se crede că acesta este primul raport care demonstrează că LCAP postoperator scade subgrupul de neutrofile circulante care induc necroza împotriva infecției bacteriene. Poate fi benefică pentru prevenirea SSI reducerea morții necrotice neașteptate sau necontrolate a celulelor necrotice cauzate de eliberarea de substanțe toxice sau proteolitice în circulația sistemică.
Recunoștință
Autorii mulțumesc lui Motoko Ueeda și Chihiro Hibi pentru asistența tehnică excelentă.
Contribuția autorilor
K.T., T.A. și M.K. au proiectat și realizat experimentele, au analizat și interpretat datele și au scris manuscrisul. S.Y., Y.O. și S.K. au efectuat experimentele și au analizat datele. Y.T., M.I., M.O., M.K., Y.I., K.U. și Y.M. au conceput experimentele și au analizat și interpretat datele. C.M. și M.K. au conceput experimentele și au interpretat datele.
Sprijin financiar și dezvăluirea aranjamentelor financiare
Această lucrare a fost sprijinită parțial prin granturi de la Ministerul Educației, Culturii, Sportului, Științei și Tehnologiei din Japonia (KAKENHI 23791523 pentru S.Y., 25861181 pentru Y.O., și 24791887 pentru M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrofilele în imunitatea înnăscută și adaptivă. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Tendințe actuale în mediatorii inflamatori și imunomodulatori în sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Disfuncția neutrofilelor circulante în insuficiența hepatică acută. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Starea actuală și perspectivele viitoare ale leucocitaferezei pentru boala inflamatorie intestinală. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factorii care afectează efectele pe termen scurt și lung ale terapiei de îndepărtare a leucocitelor în colita ulcerativă activă. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluarea leucocitoferezei de filtrare pentru utilizarea în tratamentul pacienților cu poliartrită reumatoidă. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leucocitofereza cu ajutorul unui filtru de eliminare a leucocitelor. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) O nouă paradigmă în colita ulcerativă: celulele T reglatoare sunt un factor cheie care induce/exacerbează UC printr-un dezechilibru imunitar. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Efectele imunomodulatoare ale aferezei de adsorbție a granulocitelor și monocitelor ca tratament pentru pacienții cu colită ulcerativă. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) Evaluarea in vitro și in vivo a Adacolumncytaferei la subiecți sănătoși. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)O revizuire sistematică a factorilor de risc asociați cu infecțiile de la locul intervenției chirurgicale în rândul pacienților chirurgici. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Factori de risc pentru infecția locului intervenției chirurgicale la pacienții japonezi cu colită ulcerativă: un studiu prospectiv multicentric. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Aplicarea postoperatorie timpurie a aferezei extracorporeale de leucocite la pacienții cu colită ulcerativă: rezultatele unui studiu pilot pentru a preveni complicațiile septice postoperatorii. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Eficacitatea leucocitaferezei în suprimarea apariției infecțiilor de la locul intervenției chirurgicale în urma unei intervenții chirurgicale pentru colită ulcerativă. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factorii care prezic complicațiile infecțioase postoperatorii și inducerea precoce a mediatorilor inflamatori la pacienții cu colită ulcerativă. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Disfuncția neutrofilelor la pacienții supradotați cu steroizi cu colită ulcerativă: relevanța potențială a factorului inhibitor al migrației macrofagilor pentru creșterea morbidității postoperatorii. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Clasificarea morții celulare: recomandări ale Comitetului de nomenclatură privind moartea celulară 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014) Mecanismul disfuncției neutrofile: serina proteazele neutrofile clivează și inactivează receptorul C5a. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Dovada directă a necrozei secundare a neutrofilelor în timpul inflamației pulmonare intense. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Necroza neutrofilelor și degradarea anexinei 1 asociate cu inflamația căilor respiratorii la beneficiarii de transplant pulmonar cu fibroză chistică. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Eterogenitatea funcțională și amorsarea diferențială a neutrofilelor circulante în endotoxemia experimentală umană. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse funcții noi ale neutrofilelor în imunitate, inflamație și dincolo de acestea. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfuzie. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depleția neutrofilelor din sângele pacienților cu sepsis: un tratament pentru viitor? IntImmunopharmacol17:1226-1232.