4.3 Legături covalente multiple
Obiectiv de învățare
- Recunoașteți moleculele care sunt susceptibile de a avea legături covalente multiple.
În multe molecule, regula octetului nu ar fi satisfăcută dacă fiecare pereche de atomi legați împarte doi electroni. Luați în considerare dioxidul de carbon (CO2). Dacă fiecare atom de oxigen împarte câte un electron cu atomul de carbon, obținem următoarele:
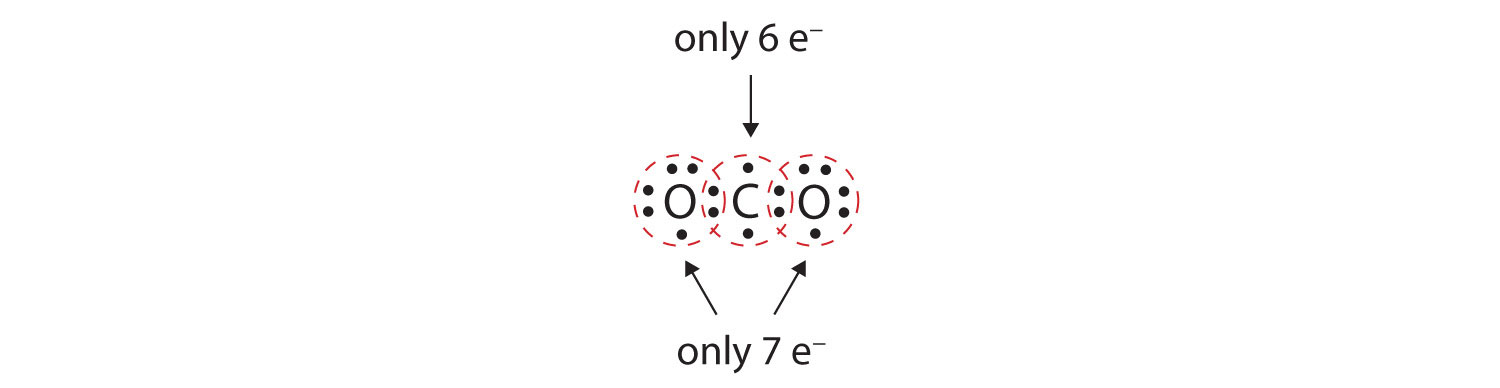
Aceasta nu conferă atomului de carbon un octet complet; veți găsi doar șase electroni în învelișul său de valență. În plus, fiecare atom de oxigen are doar șapte electroni în învelișul său de valență. În cele din urmă, niciun atom nu realizează numărul de legături pe care le formează în mod obișnuit (Figura 4.2 „Câte legături covalente se formează?”). Această dispunere a electronilor partajați este departe de a fi satisfăcătoare.
Uneori, mai mult de o pereche de electroni trebuie să fie partajată între doi atomi pentru ca ambii atomi să aibă un octet. În dioxidul de carbon, un al doilea electron de la fiecare atom de oxigen este, de asemenea, împărțit cu atomul de carbon central, iar atomul de carbon mai împarte încă un electron cu fiecare atom de oxigen:
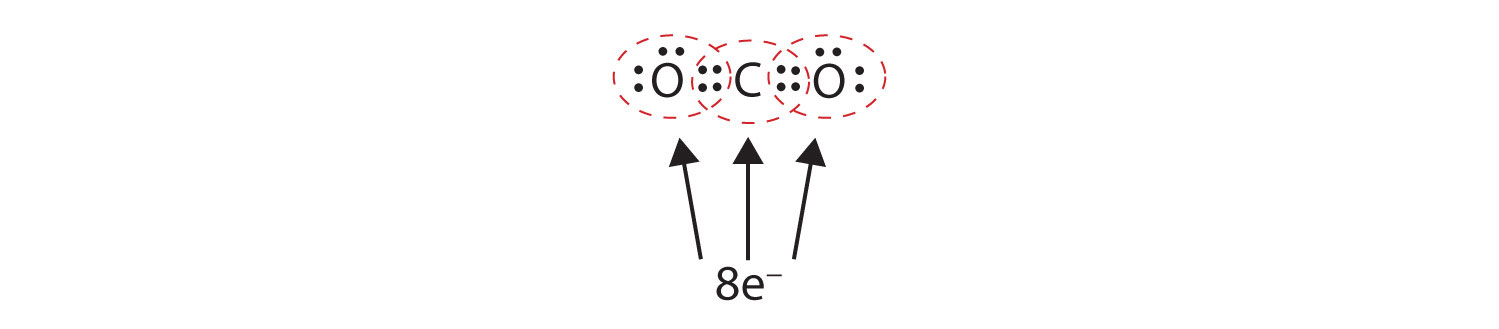
În acest aranjament, atomul de carbon împarte patru electroni (două perechi) cu atomul de oxigen din stânga și patru electroni cu atomul de oxigen din dreapta. Există acum opt electroni în jurul fiecărui atom. Două perechi de electroni împărțite între doi atomi formează o legătură dublăDouă perechi de electroni fiind împărțite de doi atomi într-o moleculă. între atomi, care este reprezentată printr-o liniuță dublă:
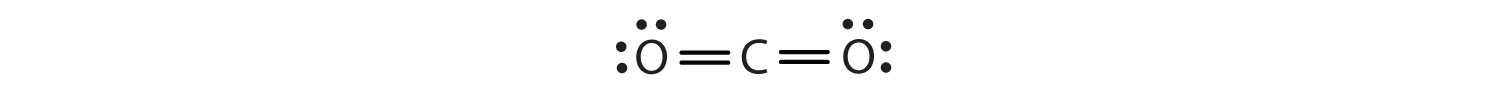
Câteva molecule conțin legături tripleTrei perechi de electroni fiind împărțite de doi atomi într-o moleculă, legături covalente în care trei perechi de electroni sunt împărțite de doi atomi. Un compus simplu care are o legătură triplă este acetilena (C2H2), a cărei diagramă Lewis este următoarea:

Exemplul 5
Desenați diagrama Lewis pentru fiecare moleculă.
- N2
- CH2O (Atomul de carbon este atomul central.)
Soluție
-
Legătura dintre cei doi atomi de azot este o legătură triplă. Diagrama Lewis pentru N2 este următoarea:

-
În CH2O, atomul central este înconjurat de două tipuri diferite de atomi. Diagrama Lewis care umple învelișul de electroni de valență al fiecărui atom este următoarea:

Nota
O aplicație a CH2O, numit și formaldehidă, este conservarea specimenelor biologice. Soluțiile apoase de CH2O se numesc formalină și au un miros ascuțit, caracteristic (înțepător).
Exercițiu de dezvoltare a abilităților
-
O2
-
C2H4
Desenați diagrama Lewis pentru fiecare moleculă.
Exercițiu de recapitulare a noțiunilor
-
Care este un indiciu că o moleculă are o legătură multiplă?
Răspuns
-
Dacă legăturile simple dintre toți atomii nu dau tuturor atomilor (cu excepția hidrogenului) un octet, este posibil să fie prezente legături covalente multiple.
Înțelesul principal
- Câteva molecule trebuie să aibă legături covalente multiple între atomi pentru a satisface regula octetului.
Exerciții
-
Care moleculă conține legături multiple. Desenați diagrama Lewis pentru fiecare dintre ele. Primul element este atomul central.
- CS2
- C2F4
- COCl2
-
Care moleculă conține legături duble. Desenați diagrama Lewis pentru fiecare dintre ele. Presupuneți că primul element este atomul central, dacă nu se specifică altfel.
- N2
- HCN (Atomul de carbon este atomul central.)
- POCl (Atomul de fosfor este atomul central.)
- POCl (Atomul de fosfor este atomul central.)
-
Explicați de ce atomii de hidrogen nu formează legături duble.
-
De ce nu este corect să se deseneze o legătură dublă în diagrama Lewis pentru MgO?
Răspunsuri
-
-
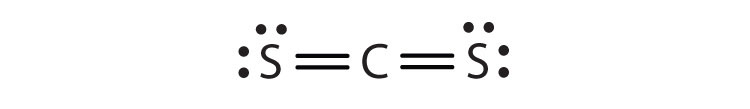
-
.
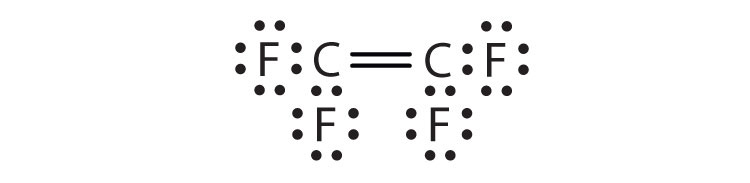
-
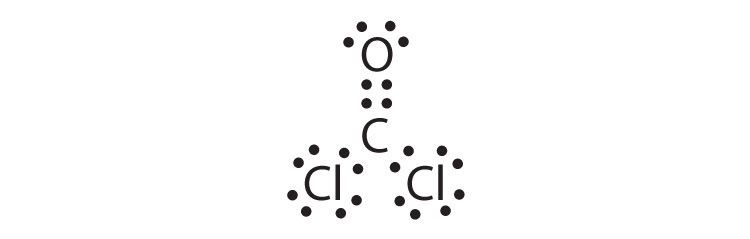
-
-
Hidrogenul mai poate accepta doar un singur electron; legăturile multiple necesită mai mult de o pereche de electroni pentru a fi partajate.