US Pharm. 2008;33(3)(OTC suppl):4-7.
Astmul este o boală pulmonară caracterizată prin obstrucția reversibilă a fluxului de aer și hiperreactivitate bronșică. Caracteristica centrală a astmului este inflamația, care duce la episoade recurente de respirație șuierătoare, tuse, dificultăți de respirație și senzație de apăsare toracică.1,2 Scopul terapiei este de a obține controlul bolii pentru a menține o calitate normală a vieții.
Povara astmului a crescut în mod constant în ultimele trei decenii. În 1970, aproximativ 3% din populație suferea de astm, comparativ cu 5,5% și 7,7% în 1995 și, respectiv, 2005.3 Această din urmă estimare echivalează cu aproximativ 22,2 milioane de americani.2,3 Odată cu creșterea prevalenței acestei boli în Statele Unite, morbiditatea și mortalitatea datorate astmului sunt, de asemenea, în creștere. Atribuite astmului în 2004 au fost 1,8 milioane de vizite la serviciile de urgență, 497.000 de spitalizări și 4.055 decese.3
Tratament bazat pe controlul astmului
Programul Național de Educație și Prevenire a Astmului (National Asthma Education and Prevention Program – NAEPP), o divizie a Institutului Național pentru Inimă, Plămâni și Sânge (National Heart, Lung, and Blood Institute), publică Guidelines for the Diagnosis and Management of Asthma (Ghidul pentru diagnosticarea și managementul astmului), cel mai recent actualizat în 2007.2 Ghidul clasifică severitatea astmului ca fiind intermitent sau persistent, pe baza simptomelor și a frecvenței de utilizare a medicamentelor de ameliorare rapidă. Persoanele cu astm intermitent au simptome puțin frecvente, în consecință, utilizarea puțin frecventă a medicamentelor de ameliorare rapidă și nu interferează cu activitatea normală. Dacă astmul este mai puțin controlat, atunci severitatea astmului este clasificată ca fiind persistentă (a se vedea TABELUL 1).
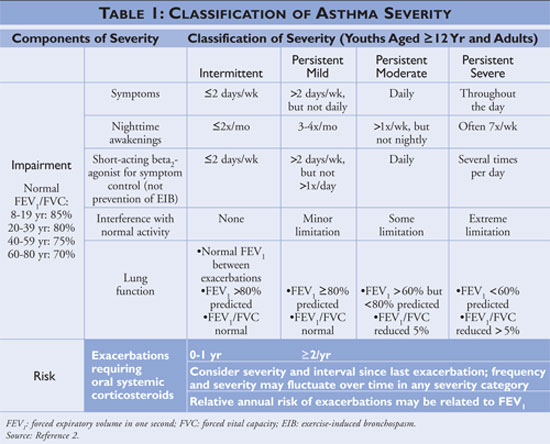
Ghidurile descriu pietrele de temelie ale managementului astmului ca fiind educația pentru autocontrol, utilizarea medicamentelor de ameliorare rapidă și utilizarea medicamentelor de control pe termen lung la persoanele cu astm persistent. Furnizorii de servicii medicale care oferă educație pentru autogestionare ar trebui să instruiască pacienții să identifice și să evite factorii declanșatori ai astmului atunci când este posibil, să utilizeze corect terapiile farmacologice și să elaboreze un plan de acțiune pentru astm. Medicația de ameliorare rapidă ar trebui inițiată pentru toți pacienții diagnosticați cu astm și poate fi utilizată ca monoterapie la persoanele cu astm intermitent; persoanelor diagnosticate cu astm persistent, cu toate acestea, ar trebui să li se adauge în regim unul sau mai multe medicamente de control pe termen lung. Medicamentele de control pe termen lung includ corticosteroizii inhalatori, modificatorii de leucotriene, beta-agoniștii cu acțiune îndelungată și teofilina (vezi TABELUL 2).

Legitimările menționează, de asemenea, că aproximativ 30% din populația SUA utilizează medicamente și intervenții complementare și alternative. În prezent, însă, nu există suficiente dovezi pentru a recomanda aceste modalități de tratament pentru astm. Liniile directoare sfătuiesc împotriva utilizării remediilor pe bază de plante pentru tratarea astmului, pe baza lipsei de date privind siguranța și eficacitatea.
Produsele pentru astm eliberate fără prescripție medicală și reglementarea acestora
Produsele pentru astm eliberate fără prescripție medicală sunt disponibile încă din anii 1950, deși unele dintre ingredientele active s-au schimbat considerabil de-a lungul anilor. Ingredientele active fără prescripție medicală disponibile în prezent sunt efedrina – cu sau fără guaifenesină – și epinefrina. Teofilina și fenobarbitalul au fost anterior ingrediente active în produsele pentru astm eliberate fără prescripție medicală; cu toate acestea, ambele sunt acum clasificate ca produse eliberate numai pe bază de prescripție medicală.4
În ultimele trei decenii, FDA a luat măsuri în ceea ce privește reglementarea tratamentelor pentru astm eliberate fără prescripție medicală. În 1976, FDA a concluzionat că epinefrina inhalată oferea o ameliorare rapidă și eficientă în cazul astmului ușor până la moderat. În 1982, aceasta a concluzionat din nou într-o monografie finală provizorie: „Epinefrina, bitartratul de epinefrină și clorhidrat de epinefrină (racemic; redenumit între timp clorhidrat de racepinefrină) în forme presurizate de aerosoli de inhalare cu doză măsurată pot fi recunoscute în general ca fiind sigure și eficiente pentru utilizarea OTC la doze pentru adulți și copii cu vârsta de 4 ani și mai mari de 1 până la 2 inhalări de o doză măsurată echivalentă cu 0,5 ml de clorhidrat de epinefrină.16 până la 0,25 mg de epinefrină per inhalare, nu mai des decât la fiecare 3 ore. „5,6
În 1986, FDA a revizuit produsele cu efedrină pentru bronhodilatație și a aprobat acest ingredient activ ca fiind general recunoscut ca fiind sigur și eficient pentru utilizare fără prescripție medicală. În acel an, FDA a decis că datele erau insuficiente pentru a limita utilizarea epinefrinei inhalate numai pe bază de prescripție medicală și că beneficiile disponibilității fără prescripție medicală depășesc riscurile. FDA a concluzionat că o etichetare extinsă și revizuită ar fi benefică pentru consumatori.5,6
După ce au fost raportate evenimente care au pus viața în pericol și decese atribuibile produselor combinate eliberate fără prescripție medicală care conțin teofilină, FDA a emis o decizie finală în 1995 conform căreia aceste produse nu sunt sigure sau eficiente.7 Astfel, produsele care conțin o combinație de efedrină și teofilină au fost întrerupte, iar unele au fost reformulate pentru a conține efedrină și guaifenesină. Tot în 1995, FDA a propus eliminarea efedrinei de pe piața medicamentelor eliberate fără prescripție medicală, din cauza rolului său în fabricarea metamfetaminei și a mecatinonei și a utilizării sale abuzive pentru controlul greutății și creșterea masei musculare.7
În 1996, FDA a modificat monografia finală din 1986 pentru a elimina statutul de monografie pentru bronhodilatatoarele OTC.6 În schimb, producătorii oricărui nou inhalator cu doză măsurată fără prescripție medicală trebuie să prezinte o cerere aprobată care să conțină informații care nu se regăsesc în monografie.6 Bronhodilatatoarele fără prescripție medicală comercializate în prezent nu au fost afectate de acest amendament.
În ciuda propunerii FDA de a elimina efedrina de pe piața medicamentelor fără prescripție medicală din cauza utilizării sale ca element de bază în producția de metamfetamină, produsul rămâne disponibil fără prescripție medicală. În schimb, Legea privind combaterea epidemiei de metamfetamină din 2005, încorporată în Patriot Act în 2006, a conferit statutul de produse eliberate fără prescripție medicală care conțin efedrină.8 Consumatorii care doresc să cumpere produse care conțin efedrină trebuie acum să prezinte la o farmacie un act de identitate cu fotografie emis de guvern, deoarece aceste produse nu mai sunt vândute legal în magazinele de proximitate sau în magazinele de depozitare fără o farmacie înregistrată.
În cadrul protecției sănătății publice la nivel mondial, a fost încheiat un acord internațional pentru reducerea și, în cele din urmă, eliminarea produselor care conțin substanțe care epuizează stratul de ozon (ODS), cum ar fi clorofluorocarburile (CFC) care se găsesc în inhalatoarele cu doză măsurată (MDI). Acest acord a dat naștere Protocolului de la Montreal din 1987 și, ulterior, amendamentelor din 1990 la Clean Air Act Amendments.9-11 Acordul prevede o scutire pentru utilizarea CFC în inhalatoarele MDI utilizate pentru tratamentul astmului în cazul în care utilizarea produsului este considerată esențială de către FDA.12 Medicamentele pentru astm eliberate fără prescripție medicală au rămas sub denumirea de utilizare esențială. Cu toate acestea, în 2007, FDA a anunțat o propunere de eliminare a denumirii de utilizare esențială pentru epinefrina inhalată începând cu 31 decembrie 2010.13 FDA a utilizat următoarele criterii, care se găsesc în 21 CFR 2.125(g)(2), pentru a revizui denumirea de utilizare esențială pentru epinefrina inhalată: „(i): Există bariere tehnice substanțiale în calea formulării produsului fără SAO; (ii): Produsul va oferi un beneficiu important pentru sănătatea publică indisponibil; și (iii): Utilizarea produsului nu eliberează în atmosferă cantități semnificative cumulative de substanțe care diminuează stratul de ozon în atmosferă sau eliberarea este justificată având în vedere beneficiul important pentru sănătatea publică care nu este disponibil. „13 În prezent, FDA primește comentarii pe această temă înainte de a lua o decizie finală.
Siguranța și eficacitatea produselor care nu se eliberează pe bază de prescripție medicală
După cum reiese din diversele propuneri făcute și acțiuni întreprinse de FDA cu privire la statutul produselor pentru astm care nu se eliberează pe bază de prescripție medicală, în ultimele decenii au existat multe dezbateri cu privire la siguranța și eficacitatea ingredientelor active din aceste produse. Deși aceste produse nu sunt promovate în mod activ, disponibilitatea lor înseamnă că siguranța și eficacitatea lor sunt de o importanță critică pentru consumatori.
Efedrina: Produsele cu un singur ingredient de efedrină pentru utilizare ca bronhodilatatoare au fost considerate în general recunoscute ca fiind sigure și eficiente de către FDA încă din 1986.14 Efedrina eliberează efedrină din țesuturi, care declanșează activitatea receptorilor alfa-adrenergici și beta-adrenergici neselectivi. Eficacitatea efedrinei pentru bronhodilatație a fost demonstrată în studii care datează din anii 1950. Proprietățile care fac ca efedrina să fie mai puțin dezirabilă ca bronhodilatator includ un debut de acțiune mai lent decât produsele inhalate (15 minute până la o oră) și neselectivitatea stimulării beta, ceea ce ar putea contribui la apariția evenimentelor adverse (EA) cardiovasculare.15-17 Cu toate acestea, studiile au demonstrat rezultate contradictorii în ceea ce privește evenimentele adverse cardiovasculare atribuibile utilizării efedrinei la dozele indicate pe etichetă de 12,5 până la 25 mg.16
Epinefrina: Epinefrina prezintă aceeași activitate a receptorilor alfa- și beta-adrenergici ca și efedrina; prin urmare, există aceleași preocupări în ceea ce privește posibilitatea apariției de efecte adverse cardiovasculare. Debutul acțiunii epinefrinei inhalate (15 sec) este mult mai rapid decât cel al efedrinei orale, ceea ce o face o alegere mai potrivită pentru ameliorarea imediată a unei exacerbări acute a astmului.6 Cu toate acestea, durata sa scurtă de acțiune (23 min) poate necesita ca pacientul să utilizeze produsul în mod repetat pentru o ameliorare continuă, mai degrabă decât să urmeze instrucțiunile de pe etichetă de a nu face mai mult de două inhalări în decurs de trei ore.6 Inhalatoarele cu epinefrină eliberate fără prescripție medicală par a fi sigure și eficiente pentru pacienții cu astm ușor, intermitent, atunci când sunt utilizate conform indicațiilor de pe etichetă.5 Totuși, acest lucru rămâne o sursă de controverse, deoarece mulți furnizori de asistență medicală sunt îngrijorați de faptul că pacienții care se bazează pe inhalatoarele eliberate fără prescripție medicală ar putea să nu beneficieze de un management adecvat al bolii din partea unei echipe de asistență medicală, ceea ce ar putea duce la repercusiuni grave.
Guaifenesin: Guaifenesina este utilizată în combinație cu efedrina pentru tratamentul astmului și este recunoscută ca fiind sigură și eficientă atunci când produsul este etichetat pentru tusea asociată cu astmul.14 Deși guaifenesina este un mucolitic aprobat de FDA, nu posedă efecte bronhodilatatoare. Astfel, nu contribuie cu nici un beneficiu suplimentar față de produsul cu efedrină pentru o exacerbare acută.17
Utilizarea produselor pentru astm eliberate fără prescripție medicală
Un sondaj Wyeth Consumer Healthcare (WCH) efectuat în 1999 a constatat că aproximativ șase milioane (30%) de persoane cu astm utilizează inhalatoare cu epinefrină.6 Rapoartele proprii ale respondenților sugerează că aproximativ 20% din aceste șase milioane de persoane ar fi clasificate ca având astm persistent de la ușor la moderat, ceea ce nu se regăsește în utilizarea indicată pe etichetă pentru acest produs.5 Orientările NAEPP promovează utilizarea beta-agoniștilor cu durată scurtă de acțiune, cel puțin la nevoie, de către toate persoanele care suferă de astm; cu toate acestea, orientările nu menționează în mod specific epinefrina inhalată ca fiind o alegere de tratament.
În 2005, WCH a efectuat un sondaj pe internet în rândul a 330 de persoane cu privire la utilizarea bronhodilatatoarelor fără prescripție medicală pentru tratarea simptomelor lor. WCH a stabilit că, dintre utilizatorii de bronhodilatatoare fără prescripție medicală, 92% fuseseră diagnosticați cu astm, 91% foloseau epinefrina inhalată doar atunci când se confruntau cu o exacerbare acută a astmului, 31% nu aveau asigurare medicală, iar 38% nu aveau asigurare cu prescripție medicală.6 WCH a extrapolat aceste rezultate pentru a estima că aproximativ 5% până la 10% dintre persoanele cu astm folosesc bronhodilatatoarele fără prescripție medicală ca monoterapie.6 Motivele principale invocate pentru utilizarea fără prescripție medicală – ușurința accesului și costul mai mic – se corelează în mod direct cu preocupările furnizorilor de asistență medicală conform cărora persoanele care utilizează produse pentru astm fără prescripție medicală ar putea să nu beneficieze de un management adecvat al bolii.6
Discuție
Proprietățile dezirabile în tratamentul astmului acut includ eficacitatea ca bronhodilatator, siguranța atunci când sunt administrate conform indicațiilor de pe etichetă, un debut rapid al acțiunii și o durată lungă de acțiune. Atât epinefrina inhalată, cât și efedrina orală și-au demonstrat eficacitatea în cadrul unor studii de zeci de ani. Cu toate acestea, având în vedere rezultatele cardiovasculare mixte din studiile clinice, siguranța utilizării bronhodilatatoarelor eliberate fără prescripție medicală de către persoane care ar putea să nu fie urmărite din punct de vedere medical este o preocupare majoră a furnizorilor de asistență medicală. Epinefrina inhalată are un debut de acțiune mai rapid decât efedrina orală, dar durata sa scurtă de acțiune îi poate limita eficacitatea.
Disponibilitatea efedrinei orale a fost limitată începând cu 2006 de statutul său de medicament care se eliberează fără prescripție medicală. Disponibilitatea epinefrinei inhalate depinde de decizia FDA cu privire la menținerea sau nu a denumirii de utilizare esențială a acestei formulări. Nu există alternative fără prescripție medicală pentru bronhodilatatoarele fără prescripție medicală care conțin CFC comercializate în prezent.12 Un producător a încercat să reformuleze produsul său de epinefrină inhalată fără prescripție medicală cu un propulsor hidrofluoroalcanic, cu efecte nedorite pentru utilizator; acesta a încheiat un parteneriat cu o altă firmă farmaceutică pentru reformulare, anticipând depunerea cererii la FDA până în 2011.6 Principalele preocupări cu privire la propulsoarele alternative includ necesitatea unei administrări eficiente a epinefrinei și datele de siguranță și eficacitate pentru noul produs ca urmare a modificărilor.18
Pentru a determina dacă să elimine sau nu denumirea de utilizare esențială pentru epinefrina inhalată, FDA nu examinează siguranța sau eficacitatea produselor cu conținut de CFC comercializate în prezent; mai degrabă, aceasta examinează impactul asupra sănătății publice în cazul în care denumirea ar fi eliminată. În scrisorile adresate de National Association of Chain Drug Stores și de American Pharmacists Association către FDA cu privire la propunerea de eliminare a denumirii de utilizare esențială, principala preocupare a fost potențialul impact negativ asupra utilizatorilor actuali de inhalatoare eliberate fără prescripție medicală, în cazul în care produsele nu ar mai fi disponibile.19,20 FDA a declarat că, în cazul în care norma propusă de eliminare a denumirii de utilizare esențială devine definitivă și nu există alternative eliberate fără prescripție medicală, va fi necesar ca consumatorii să obțină o rețetă pentru un produs alternativ.12 Mulți consumatori care utilizează epinefrină inhalată pot alege să renunțe la tratamentul astmului sau să caute o terapie alternativă fără prescripție medicală.
Este imperativ ca comunitatea medicală să conștientizeze publicul cu privire la gravitatea consecințelor astmului necontrolat și că orice persoană care întâmpină dificultăți de respirație ar trebui să consulte un furnizor de servicii medicale pentru diagnostic și tratament. Un pacient care alege să utilizeze bronhodilatatoare eliberate fără prescripție medicală trebuie sfătuit să își informeze furnizorul de asistență medicală; pacientul trebuie, de asemenea, să fie sfătuit cu privire la diferența dintre instrucțiunile de pe etichetă dintre inhalatoarele eliberate fără prescripție medicală și cele eliberate pe bază de prescripție medicală. Accesibilitatea actuală continuă a bronhodilatatoarelor fără prescripție medicală necesită consilierea informată a pacienților pentru a preveni utilizarea necorespunzătoare a acestor produse și efectele adverse ulterioare.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Raport al grupului de experți 3. Expert Panel Report: Orientări pentru diagnosticul și managementul astmului. Programul național de educație și prevenire a astmului. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Statele Unite ale Americii, 2003-05. Centrul Național pentru Statistici de Sănătate. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Accesat la 10 decembrie 2007.
4. W. Steven Pray. OTCproducts and asthma therapy. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Siguranța inhalatorilor fără prescripție medicală pentru astm: raport al Consiliului pentru Afaceri Științifice. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Utilizarea substanțelor care epuizează stratul de ozon: determinarea utilizării esențiale a inhalatoarelor cu doză măsurată de epinefrină eliberate fără prescripție medicală (OTC). Document de informare. 19 decembrie 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01_01-Wyeth-Backgrounder.pdf. Accesat la 30 decembrie 2007.
7. Kupec IF. Bronhodilatatoare care conțin teofilină și produse medicamentoase cu efedrină. Răspunsuri T95-40. 27 iulie 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Accesat la 10 decembrie 2007.
8. Drug Enforcement Administration. General information regarding the Combat Methamphetamine Epidemic Act of 2005 (Informații generale privind Legea privind combaterea epidemiei de metamfetamină din 2005) . Mai 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Accesat la 4 februarie 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economia „scutirilor de utilizare esențială” pentru inhalatoarele cu doză măsurată în cadrul Protocolului de la Montreal. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions (Protocolul de la Montreal și scutirile pentru utilizări esențiale). J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Administrația pentru alimente și medicamente. Știri FDA. FDA propune eliminarea treptată a CFC în inhalatoarele cu doză măsurată de epinefrină. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Accesat la 10 decembrie 2007.
13. Administrația pentru alimente și medicamente. Codul de reglementare federală 21 CFR partea 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Accesat la 6 februarie 2008.
14. Whitehall-Robins. RE: docket nr. 98N-0148; Fed. Reg. 13258, programarea internațională a medicamentelor; Convenția privind substanțele psihotrope. 16 aprilie 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Accesat la 30 decembrie 2007.
15. Lexi-Comp Online. www.crlonline.com. Accesat la 28 decembrie 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Comparația dublu-orb a efectelor bronșice și cardiovasculare acute ale terbutalinei și efedrinei orale. Chest. 1975;68:155-161.
17. Dulfano MJ. Noile bronhodilatatoare orale . Chest.1975;68:133-134.
18. Produse medicamentoase pentru răceală, tuse, alergii, bronhodilatatoare și antiasmatice pentru uz uman fără prescripție medicală; modificarea monografiei pentru produsele medicamentoase bronhodilatatoare fără prescripție medicală. Fed Regist. 1996; 61:25142-25147.
19. Asociația națională a lanțurilor de farmacii. Obiectul: utilizarea de propulsoare care epuizează stratul de ozon; eliminarea denumirii de utilizare esențială pentru inhalatoarele cu doză măsurată de epinefrină (MDI) eliberate fără prescripție medicală. 6 ianuarie 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Accesat la 6 februarie 2008.
20. Declarația Asociației Farmaciștilor Americani (American Pharmacists Association – APhA) către Comitetul consultativ pentru medicamente eliberate fără prescripție medicală și Comitetul consultativ pentru medicamente pentru alergii pulmonare (Pulmonary-Allergy Drugs Advisory Committee) din cadrul Food and Drug Administration. Utilizarea unei substanțe care epuizează stratul de ozon: determinarea utilizării esențiale a inhalatoarelor cu doză măsurată de epinefrină OTC. 24 ianuarie 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Accesat la 6 februarie 2008.
Pentru a comenta acest articol, contactați [email protected].