- Cavități axiale fără cromatină apar la plantele cu un conținut mediu de ADN 2C mai mare de 0.8 pg pe un cromozom
- Condensarea/decondensarea cromozomilor poate fi vizualizată în secțiuni semi-subțiri de N. damascena după colorarea cu 4′,6-diamidino-2-fenilindol (DAPI)
- Condensarea/decondensarea cromozomilor în timpul mitozei, analizată după încorporarea de 5-ethynyl-2′-deoxyuridine (EdU)
- Condensarea/decondensarea cromozomilor în timpul mitozei analizată prin microscopie electronică
Cavități axiale fără cromatină apar la plantele cu un conținut mediu de ADN 2C mai mare de 0.8 pg pe un cromozom
Cromatidele din nafaze și telofaze ale unor plante conțin cavități fără cromatină în regiunile axiale, care disting aceste plante de majoritatea celorlalte plante și animale investigate până în prezent (Fig. 1a, b). Din câte știm, rapoartele care descriu o astfel de organizare a cromozomilor se limitează la plantele cu genomuri mari și se poate presupune că o astfel de organizare morfologică este o caracteristică specifică pentru aceste plante. Pentru a verifica această sugestie, am analizat, de asemenea, cromatidele anafazice și telofazice de la 12 specii cu ajutorul microscopiei electronice (Tabelul 1; Fig. 1a, b; Fișier suplimentar 1: Figura S1). Figura 1c demonstrează că cavitățile axiale lipsite de cromatină au fost clar observate doar în interiorul cromozomilor plantelor cu genom mare și cu cromozomi mari, dar se pare că dimensiunea medie a cromozomilor s-a corelat mai bine cu prezența sau absența acestor cavități. Printre plantele cu cavități axiale, Hordeum vulgare a avut cel mai mic genom și cel mai mic conținut mediu de ADN 2C pe cromozom (0,79 pg). Astfel, această organizare cromozomială este un semn distinctiv al cromozomilor plantelor al căror conținut de ADN 2C poate fi estimat aproximativ ca depășind 0,8 pg pe cromozom.
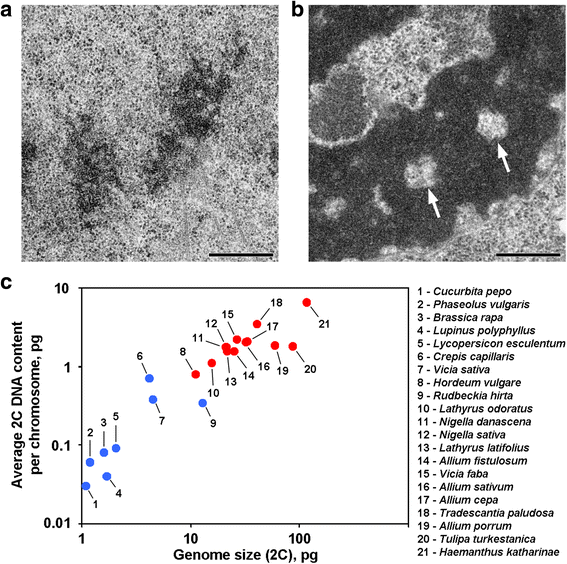
Două variante de organizare cromozomială la plante. a Cromozomii telofazici ai fasolei comune (Phaseolus vulgaris) ca exemplu de cromozomi fără cavități axiale lipsite de cromatină. b Cromozomii telofazici ai N. damascena cu cavități axiale lipsite de cromatină clar vizibile (săgeți). c Prezența cavităților axiale lipsite de cromatină depinde de genom și de dimensiunea cromozomului. Punctele albastre reprezintă plantele la care cromozomii nu conțin cavități fără cromatină axială; punctele roșii reprezintă plantele la care cromozomii conțin cavități fără cromatină axială. Bară de scară: 0,5 μm
Condensarea/decondensarea cromozomilor poate fi vizualizată în secțiuni semi-subțiri de N. damascena după colorarea cu 4′,6-diamidino-2-fenilindol (DAPI)
Obiectul cel mai convenabil pentru studiul cromozomilor din plante, meristemul apical al rădăcinilor, nu permite achiziționarea de imagini de înaltă rezoluție din cauza fluorescenței în afara focalizării. Aici, am folosit o metodă bazată pe aplicarea de secțiuni semi-subțiri (200-250 nm) de rădăcini încorporate în mediul LR White. Grosimea acestor secțiuni a fost semnificativ mai mică decât cea a secțiunilor optice, chiar dacă s-a utilizat un microscop confocal. Pentru a găsi caracteristicile morfologice care ne-au permis să identificăm celulele în diferite stadii mitotice, am analizat morfologia celulelor colorate cu DAPI.
Au existat mai multe transformări ale organizării cromozomiale din N. damascena care au fost ușor vizibile chiar și la microscopul cu fluorescență. În interiorul nucleelor din profaza timpurie, au fost vizibile părți de cromozomi subțiri (aproximativ 0,6 μm în diametru) (Fig. 2a). La profaza mijlocie, s-au format cromozomi de profază mai groși (aproximativ 1,2 μm), în interiorul cărora a fost posibilă distingerea prezenței unor fibre mai subțiri, care probabil corespundeau cromozomilor de profază timpurie pliați (Fig. 2b). Cromozomii din profaza târzie (Fig. 2c), metafaza (Fig. 2d) și anafază (Fig. 2e) erau dens condensați și nu s-a detectat nicio organizare internă. În timpul decondensării la telofază, separarea fibrelor de cromatină cu un diametru de aproximativ 0,4 μm a dus la apariția unor cavități fără cromatină în regiunile axiale ale cromatidelor (Fig. 2f), a căror dimensiune a crescut treptat în timpul telofazei (Fig. 2g și h). Diametrul fibrelor de cromatină din cromozomii din telofaza a fost comparabil cu dimensiunea cromozomilor din profaza timpurie. Astfel, toate etapele mitotice ale N. damascena au fost ușor de detectat în secțiuni semi-subțiri colorate cu DAPI.
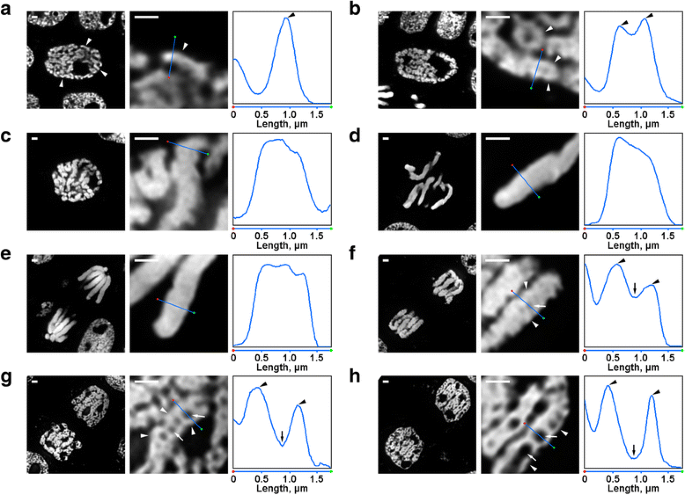
Morfologia cromozomilor mitotici de N. damascena. Panourile din stânga și central reprezintă imagini de microscopie cu fluorescență ale secțiunilor semi-subțiri colorate cu DAPI (vedere generală și fragment); panoul din dreapta reprezintă un grafic de densitate prin linia din panourile centrale. a Profaza timpurie (cromozomii sunt indicați prin vârfuri de săgeată). b Profaza mijlocie (fibrele care formează cromozomi, care par să corespundă cromozomilor din profaza timpurie, sunt indicate prin vârfuri de săgeată). c Profaza târzie. d Metafaza. e Anafaza. f Telofaza timpurie (cavitățile axiale fără cromatină sunt indicate prin săgeți, fibrele care formează cromozomi din telofaza sunt indicate prin vârfuri de săgeată). g Telofaza târzie. h Faza G1. Barele de scară: 1 μm
Condensarea/decondensarea cromozomilor în timpul mitozei, analizată după încorporarea de 5-ethynyl-2′-deoxyuridine (EdU)
În timpul profazei, cromozomii subțiri din profaza timpurie s-au transformat în cromozomi groși din profaza târzie. Îngroșarea cromozomilor din profaza timpurie poate fi rezultatul fie al replierii cromozomilor din profaza timpurie, fie al îngroșării treptate a acestora. Pentru a investiga aceste două mecanisme posibile, a fost necesar să se marcheze focarele cromozomiale discrete care au fost dispuse liniar în interiorul cromozomilor din profaza timpurie și apoi să se analizeze rearanjările lor spațiale în timpul condensării profazei. După cum este ilustrat în Fig. 3a, în timpul tranziției de la profaza timpurie la profaza târzie, astfel de focare fie ar pierde aranjamentul liniar (pliere), fie ar păstra aranjamentul liniar și ar întinde focarele în benzi subțiri (îngroșare). Pentru a marca regiunile cromozomiale, am încorporat nucleotidul sintetic, EdU, care poate fi detectat prin click-chemistry, în cromatină în timpul replicării.
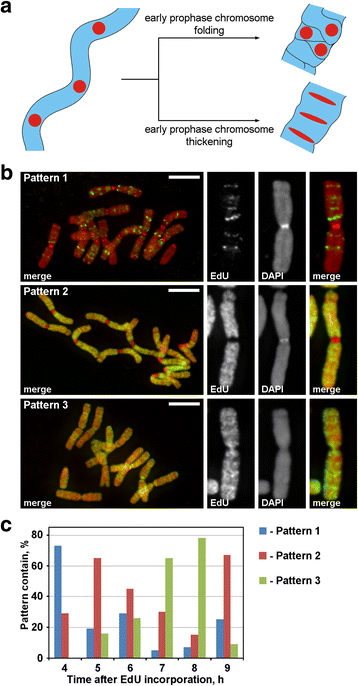
Etichetarea cromozomilor cu EdU. a Localizarea regiunii marcate și morfologia au dezvăluit principiul condensării cromozomilor în profază. Regiunile cromozomiale marcate, dispuse liniar, în timpul tranziției de la profaza timpurie la profaza târzie, fie și-ar pierde dispunerea liniară (pliere), fie și-ar păstra dispunerea liniară (îngroșare). b Au fost detectate trei modele de încorporare a EdU în cromozomi: marcarea regiunilor discrete (modelul 1), marcarea brațelor cromozomiale, dar nu și a centromerilor (modelul 2) și marcarea atât a brațelor cromozomiale, cât și a centromerilor (modelul 3). c Frecvențele diferitelor modele de marcare la diferite momente de timp după încorporarea EdU. Barele de scară: 5 μm
EdU a fost încorporat timp de 30 de minute în rădăcinile de N. damascena, iar după diferite perioade de urmărire (de la 2 la 14 h), s-au făcut întinderi de cromozomi. S-au detectat trei modele de marcare a cromozomilor: marcarea regiunilor discrete (modelul 1), marcarea brațelor cromozomiale, dar nu și a centromerilor (modelul 2) și marcarea atât a brațelor cromozomiale, cât și a centromerilor (modelul 3) (Fig. 3b). Modelul 1 a fost observat mai des la 4 ore după încorporarea EdU, ceea ce indică faptul că o astfel de etichetare este tipică pentru faza S târzie (Fig. 3c; Fișier suplimentar 2: Figura S2). În cazul modelului 1, marcarea cromozomilor omologi a fost similară (Fișier suplimentar 3: Figura S3), ceea ce indică un model specific de încorporare a EdU. Brațele cromozomilor au fost marcate în timpul restului fazei S (modelele 2 și 3), dar regiunile centromerice au fost, de asemenea, marcate aproximativ la granița dintre faza S timpurie și cea târzie (modelul 3) (figura 3c).
Am analizat tranzițiile de la profaza timpurie la cea târzie folosind cromozomi în care a fost marcată cromatina de replicare târzie (modelul 3). În cromozomii din profaza timpurie, regiunile marcate au fost distribuite liniar de-a lungul cromozomilor subțiri (Fig. 4a). În cromozomii din profaza târzie, care erau de aproximativ două ori mai groși decât cei din profaza timpurie, regiunile marcate și-au pierdut liniaritatea distribuției (Fig. 4b). Această observație nu a fost complet valabilă, deoarece cromozomii din profaza și metafaza constau din două cromatide, care se segregă treptat , iar acest lucru poate duce la o pierdere a linearității distribuției regiunilor marcate. Prin urmare, am analizat în continuare cromatidele din anafază (adică cromozomi complet compactați după segregarea cromatidelor). În cromatidele anafazice cu un diametru aproximativ egal cu diametrul cromozomilor din profaza târzie, regiunile de cromatină marcate nu au fost dispuse liniar, ci au fost distribuite în întregul volum al cromatidelor (Fig. 4c). La telofaza, cavitățile fără cromatină erau clar vizibile în regiunile axiale ale cromatidelor, permițând detectarea fibrelor de cromatină în interiorul cărora regiunile marcate erau dispuse liniar (Fig. 4d). Prin urmare, în timpul tranziției de la profaza timpurie la profaza târzie, a avut loc plierea cromozomilor din profaza timpurie. Acest rezultat este în concordanță cu observațiile cromozomilor din profaza mijlocie colorați cu DAPI (Fig. 2b), în interiorul cărora au fost clar vizibile fibre subțiri pliate.
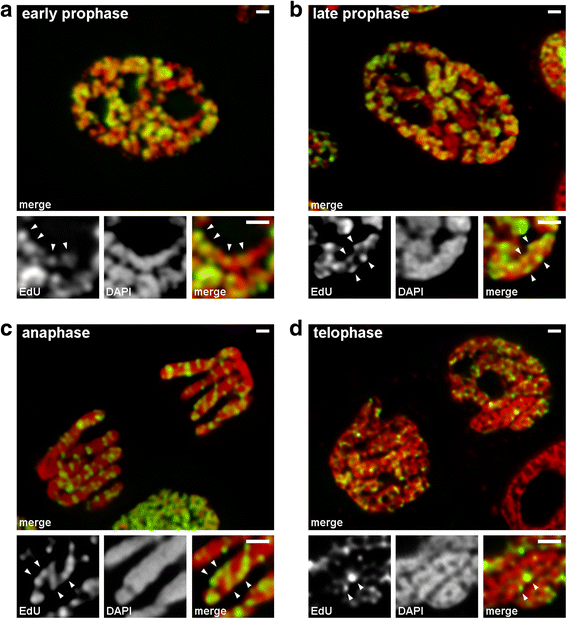
Condensarea/decondensarea cromozomilor în timpul mitozei la N. damascena (celule mitotice ai căror cromozomi au inclus EdU în timpul fazei S târzii). a La profaza timpurie, regiunile marcate au fost distribuite liniar în cromozomi subțiri, acoperind aproape în întregime lățimea cromozomului. b La profaza târzie, regiunile marcate au fost împrăștiate în tot volumul cromozomului. c La anafază, modelul de marcare a fost similar cu cel al cromozomilor din profaza târzie. d La telofaza târzie, decondensarea a evidențiat fibre subțiri care formează cromatide în interiorul cărora regiunile marcate au fost distribuite în mod similar cu cel din interiorul cromozomilor din profaza timpurie. Barele de scară: 1 μm
Condensarea/decondensarea cromozomilor în timpul mitozei analizată prin microscopie electronică
Pentru detectarea organizării interne a fibrelor de cromatină, a căror pliere a fost descrisă cu ajutorul microscopiei optice, am folosit microscopia electronică. Pentru a detecta și măsura substructurile fibrilare ale cromatinei, am analizat cavitățile fără cromatină, care au separat fibrele de cromatină așa cum am presupus (Fișier suplimentar 4: Figura S4; Tabelul 2).
Nucleii interfazici au fost umpluți cu o plasă de fibre groase de 234 ± 49 nm (medie ± S.D.) (Fig. 5a), care pot fi denumite „cromonemate interfazice”, așa cum s-a discutat în altă parte . Microscopia electronică a permis detectarea a trei stadii de condensare a cromozomilor în profază, dintre care cel mai timpuriu nu a putut fi detectat cu ajutorul microscopiei optice și va fi denumit aici „preprofază”. Al doilea și al treilea stadiu au corespuns profazelor timpurie și târzie, așa cum au fost descrise mai sus (Fig. 2a și, respectiv, c).
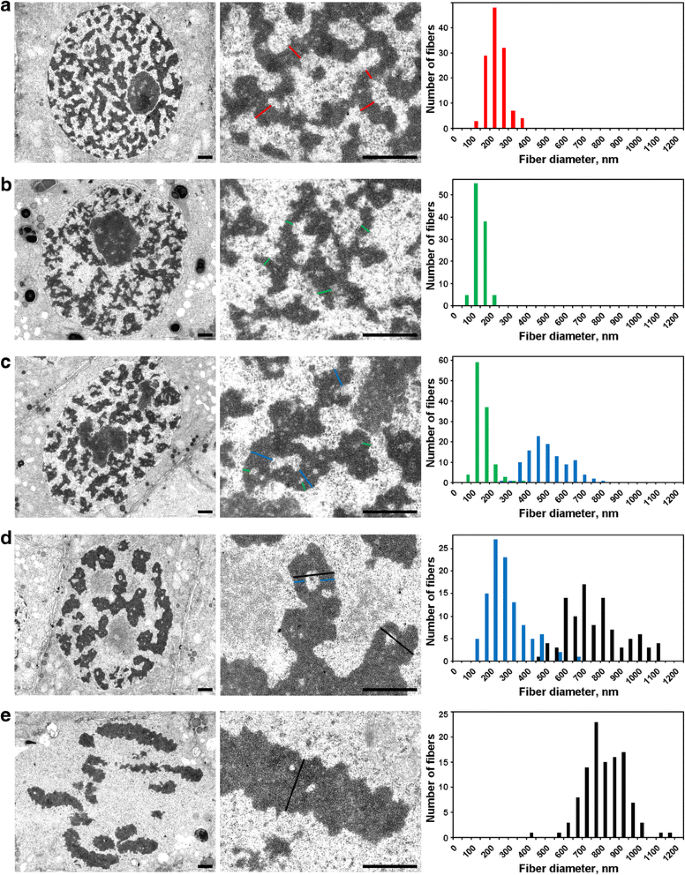
Morfometria prin microscopie electronică a cromozomilor N. damascena: condensarea cromozomilor de la interfază la metafază. Panourile din stânga și central prezintă organizarea ultrastructurală (vedere generală și fragment), panourile din dreapta prezintă histograme care descriu distribuția lățimii cromozomilor și a fibrelor de cromatină. a Interfaza. b Preprofaza. c Profaza timpurie. d Profaza târzie. e Metafaza. Secțiunile transversale tipice ale cromozomilor și/sau ale fibrilelor de cromatină sunt indicate cu linii colorate: roșu – cromonemata de interfază (heterocromatină), verde – cromonemata; albastru – „fibre de 300 nm”; negru – cromozomi. Barele de scară: 1 μm
(1) În preprofaza, cromozomii erau slab separați unii de alții și nu am putut măsura cu precizie diametrul lor (Fig. 5b). Cromozomii din preprofaza au fost formați de fibre cu un diametru de 148 ± 30 nm (tabelul 2), care cel mai probabil corespundeau fibrelor cu un diametru de 100-130 nm (cromonema), care reprezintă principala substructură cromozomială a cromozomilor din profaza și telofaza din celulele animale . Datele nu ne-au permis să stabilim identitatea cromonemelor de interfază și mitotice, dar datele raportate anterior indică faptul că cromonemele de interfază sunt complexe formate din cromonemele pliate .
(2) La începutul profazei, a avut loc separarea cromozomilor (Fig. 5c). Diametrul cromozomilor a fost de 527 ± 107 nm, iar acești cromozomi au fost, de asemenea, formați de cromonemate cu un diametru de 158 ± 46 nm.
(3) În cele din urmă, am analizat celulele din profaza târzie, care conțineau cromozomi îngroșați cu un diametru de 809 ± 185 nm (Fig. 5d). Unii cromozomi din profaza târzie conțineau cavități în regiunile axiale care ne-au permis să distingem fibrele cu un diametru de 285 ± 102 nm („fibre de 300 nm”). Analiza cu ajutorul segmentelor de cromozomi marcate a demonstrat că cromozomii din profaza timpurie s-au pliat pentru a forma cromozomi mai groși din profaza târzie (Fig. 4). Prin urmare, este posibil să se presupună că fibrele de 285 ± 102 nm și cromozomii din profaza timpurie de 527 ± 107 nm au fost aceleași fibre. Diametrul micșorat al fibrelor poate fi asociat cu compactarea cromatinei cromozomilor din profaza timpurie, care a fost, de asemenea, indicată de dispariția cromonemelor vizibile.
Cromatina din interiorul cromozomilor din metafază (Fig. 5e) și al cromatidelor din anafază (Fig. 6a) era foarte compactată și, deși erau vizibile rare cavități fără cromatină în interiorul acestora, a fost imposibilă o distincție precisă a oricăror substructuri fibrilare. În cromozomii telofazei timpurii, s-au detectat clar două tipuri de cavități (Fig. 6b). Cavitățile mari au fost localizate în regiunea axială a cromatidelor, ceea ce ne-a permis să identificăm și să măsurăm fibrele cu un diametru de 422 ± 78 nm. În regiunile centrale ale acestor fibre, am detectat cavități mici care au permis identificarea unui al doilea tip de fibre cu un diametru de 182 ± 47 nm. Primul tip de fibre ar putea corespunde „fibrelor de 300 nm” din interiorul cromozomilor din profaza târzie, iar cel de-al doilea tip ar putea corespunde cromonemelor.

Morfometria prin microscopie electronică a cromozomilor din N. damascena: decondensarea cromozomilor de la faza anafazică la faza G1. Panourile din stânga și central prezintă organizarea ultrastructurală (vedere generală și fragment), panoul din dreapta prezintă histograme care descriu distribuția lățimii cromatidelor și a fibrelor de cromatină. a Anafaza. b Telofaza timpurie. c Telofaza târzie. d Faza G1. Secțiunile transversale tipice ale cromozomilor și/sau ale fibrilelor de cromatină sunt indicate cu linii colorate: roșu – cromonemate în interfază, verde – cromonemate; albastru – „fibre de 300 nm”; negru – cromatide. Barele de scară: 1 μm
În telofaza târzie (Fig. 6c) și în faza G1 (Fig. 6d), cromozomii au fost decondensificați în domenii cromozomiale în nucleele fiice, unde nu pot fi observați cu ușurință. Cu toate acestea, a fost posibilă identificarea fragmentelor de cromatide separate. În acest stadiu, cromatidele erau formate din fibre cu un diametru de aproximativ 250 nm, ceea ce corespunde aproximativ cu diametrul cromonimelor din interfază. Această observație, în plus față de dispariția fibrelor de cromoneme, a indicat faptul că, în acest stadiu al mitozei, fibrele de cromatină au fost repliate pentru a forma complexe interfazice de cromatină condensată.
.