Quando una sostanza cambia fase, cioè passa da solido a liquido o da liquido a gas, l’energia, richiede energia per farlo. L’energia potenziale immagazzinata nelle forze interatomiche tra le molecole deve essere superata dall’energia cinetica il movimento delle particelle prima che la sostanza possa cambiare fase.
Se misuriamo la temperatura della sostanza inizialmente solida mentre la riscaldiamo produciamo un grafico come la figura 1.
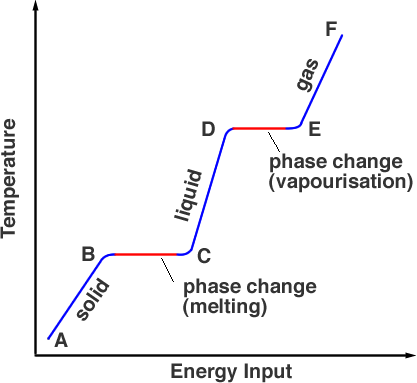
Partendo da un punto A, la sostanza è nella sua fase solida, il riscaldamento porta la temperatura fino al suo punto di fusione ma il materiale è ancora un solido al punto B. Man mano che viene riscaldato ulteriormente, l’energia della fonte di calore va a rompere i legami che tengono gli atomi in posizione. Questo avviene da B a C. Al punto C tutta la fase solida è stata trasformata in fase liquida. Ancora una volta, quando l’energia viene aggiunta, l’energia va nell’energia cinetica delle particelle, aumentando la temperatura (da C a D). Al punto D la temperatura ha raggiunto il punto di ebollizione, ma è ancora in fase liquida. Dai punti D a E l’energia termica sta superando i legami e le particelle hanno abbastanza energia cinetica per uscire dal liquido. La sostanza sta entrando nella fase gassosa. Oltre E, un ulteriore riscaldamento sotto pressione può aumentare ulteriormente la temperatura, come funziona una pentola a pressione.
Calore latente di fusione e vaporizzazione
L’energia richiesta per cambiare la fase di una sostanza è nota come calore latente. La parola latente significa nascosto. Quando il cambiamento di fase è da solido a liquido dobbiamo usare il calore latente di fusione, e quando il cambiamento di fase è da liquido a gas, dobbiamo usare il calore latente di vaporizzazione.
L’energia richiesta è Q= m L, dove m è la massa della sostanza e L è il calore latente specifico di fusione o vaporizzazione che misura l’energia termica per cambiare 1 kg di un solido in un liquido.
Tabella 1. mostra il
| Sostanza | Calore latente specifico di fusione kJ.kg-1 |
°C | Calore latente specifico di vaporizzazione kJ.kg-1 |
°C |
|---|---|---|---|---|
| Acqua | 334 | 0 | 2258 | 100 |
| Etanolo | 109 | -114 | 838 | 78 |
| Acido etanoico | 192 | 17 | 395 | 118 |
| Cloroformio | 74 | -64 | 254 | 62 |
| Mercurio | 11 | -39 | 294 | 357 |
| Zolfo | 54 | 115 | 1406 | 445 |
| Idrogeno | 60 | -259 | 449 | -253 |
| Ossigeno | 14 | -219 | 213 | -183 |
| Nitrogeno | 25 | -210 | 199 | -196 |
Tubi di calore
Come aumenta la densità dei transitori in un microprocessore, la quantità di calore dissipato aumenta. Un processore Pentium 4 (180 nm a 2GHz) dissipa 55 Watt di potenza come calore. La sua area è di soli 131 mm2. Questo dà un 55 W/(131/(102)) = 42 W cm-2. In confronto un ferro da stiro a vapore è di 5 Wcm-2.
Una soluzione è il tubo di calore. Come suggerisce il nome, trasferisce il calore da regioni ad alta temperatura a regioni a bassa temperatura dove c’è più spazio per dissipatori di calore o ventole di raffreddamento.
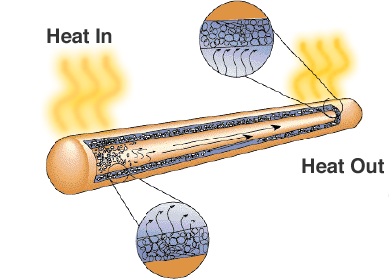
Anche se sembra solo un tubo di metallo sigillato, c’è uno stoppino o materiale poroso e un liquido con un alto calore latente di vaporizzazione. Quando il tubo viene riscaldato, il liquido utilizza il calore per evaporare e si trasforma in un gas, il gas si sposta in una regione più fredda del tubo di calore dove si condensa e utilizza il calore latente per trasformarsi nuovamente in un liquido. I tubi di calore sono una soluzione affidabile e conveniente per i computer portatili dove le ventole ridurrebbero la durata della batteria.