Introduzione
L’elettroencefalografia intracranica (IEEG) trascende molti limiti fisici dell’elettroencefalografia dello scalpo (EEG) e della magnetoencefalografia (MEG) registrando segnali direttamente dal tessuto cerebrale. I rapidi progressi nell’elaborazione del computer negli ultimi decenni hanno ampliato le capacità del software e dell’hardware, consentendo registrazioni simultanee da centinaia di siti intracranici con precisione al microsecondo. Questi aumenti nella risoluzione temporale e spaziale hanno migliorato la precisione diagnostica per la localizzazione delle crisi (Andrews et al., 2019; Cuello Oderiz et al., 2019) e hanno portato a un’accelerazione della ricerca neurofisiologica intracranica umana (Chang, 2015; Parvizi e Kastner, 2018).
Insieme agli strumenti computazionali emergenti e alle capacità di analisi di massicci set di dati, la ricchezza delle opportunità neuroscientifiche e delle potenziali scoperte è promettente. Tuttavia, l’analisi del segnale sulle registrazioni intracraniche umane invoca insidie intrinseche che sono presumibilmente affrontate ma minimamente riconosciute in molti studi neurofisiologici di pazienti umani – vale a dire, scariche epilettiformi interictali (IEDs). IEDs sono raffiche transitorie di attività prodotte da gruppi di neuroni che sono patologicamente collegati a causa di epilessia, con conseguente forme d’onda distinte e prominente durante le registrazioni IEEG (Figura 1A). Questa prospettiva attirerà l’attenzione sui pericoli IED, sui potenziali effetti sulle comuni strategie di analisi e descriverà strategie comuni per evitarli in modo che la crescente ondata di scoperte nella neurofisiologia umana continui ad avanzare, speriamo senza passi falsi.
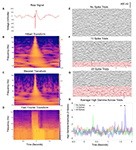
Figura 1. Contaminazione dei dati relativi alle scariche epilettiformi interictali (IED). (A) Esempio di un IED da un singolo canale durante un 2-s elettroencefalografia intracranica (IEEG) registrazione. Caratteristiche classiche sono evidenti tra cui un forte, grande ampiezza spostamento di tensione e un dopo andare onda lenta, altrimenti con un mix relativamente normale linea di base delle frequenze prima e dopo. (B) Hilbert trasformata spettrogramma dei dati in (A). Si noti l’aumento transitorio ma sostanziale di potenza in quasi tutte le frequenze, a causa della componente tagliente della forma d’onda, e un sottile aumento sostenuto di potenza a bassa frequenza relative al dopo andare onda lenta. (C) Wavelet trasformata spettrogramma dei dati in (A), con risultati simili come in (B). (D) trasformata di Fourier di A (Mitra e Bokil, 2007; Chronux Home, 2019) con finestre sovrapposte di 0.25-s, scorrendo punto per punto per fornire una risoluzione temporale simile a (B,C). Risultati simili come in (B,C), con una durata aggiuntiva dell’aumento di potenza nelle frequenze più veloci a causa della natura della finestra temporale coerente tra le frequenze per il calcolo FFT. Pannelli (E-G) ogni visualizzare i dati IEEG da 50 prove, registrato da un singolo canale durante un compito di ascolto discorso (una frase preregistrata giocato ad alta voce per ogni prova a partire dal tempo zero). Nel pannello (F), 10 prove sono state scambiate con prove che contenevano IED, mostrate in rosso. È stato utilizzato un ibrido di approcci manuali e automatici (Baud et al., 2018). Il pannello (G) aumenta questo a 20 prove con IED. Pannello (H) mostra la media alta gamma attraverso le prove in ogni gruppo (Hilbert trasformare, 50-200 Hz) da un elettrodo che contatta il giro temporale inferiore che non era veramente modulato dal compito frase-ascolto. Asterischi denotano punti di tempo durante i quali uno di questi ultimi gruppi si discosta significativamente dalla linea di base (a due vie ripetute misure ANOVA, p < 0.05). Come la percentuale di prove con IED aumenta, emergono ulteriori punti di tempo falsamente positivi.
La natura dei rischi di IED nella neurofisiologia umana IEEG
Il nocciolo della nostra visione è che il paradigma della neurofisiologia intracranica umana espone gli scienziati ben intenzionati a rischi di risultati errati a causa di due fattori principali:
(1) Gli elettrodi sono impiantati in regioni del cervello umano che sono ritenuti in grado di rivelare le firme neurofisiologiche dell’epilessia sia in contesti ictali che interictali – che sono spesso forme d’onda di grande ampiezza.
(2) Le analisi di elaborazione del segnale che sono comunemente utilizzate per la neurofisiologia umana sono squisitamente sensibili alle forme d’onda taglienti di grande ampiezza descritte in #1, che causano risultati spuri.
Quindi, i set di dati IEEG contengono comunemente firme elettriche di epilessia che trasmettono il rischio di risultati distorti quando inclusi in analisi del segnale comuni come misure di potenza e coerenza, e metodi correlati come la co-modulazione potenza-fase (Kramer et al., 2008). Un modo per rendere conto di questo problema è che molti metodi di elaborazione dei segnali neurali come le analisi basate su Fourier, Wavelet e Hilbert presuppongono un substrato di dati sinusoidali (van Drongelen, 2018). La convoluzione di onde di grande ampiezza o di forti deviazioni (ampiezza grande o anche piccola) predispone quindi a rappresentazioni di molte frequenze che possono essere ampiamente spurie, poiché molte funzioni sinusoidali consecutive possono adattarsi a questi elementi della forma d’onda. Nelle figure 1B-D, mostriamo esempi di come gli IED possono facilmente travisare i segnali neurofisiologici in questo modo attraverso i metodi spettrali comunemente usati di Hilbert, Wavelet, e trasformate di Fourier. Nelle bande di frequenza più basse, sia le componenti di onde acute e lente di IEDs può indurre un aumento di potenza in qualsiasi frequenza che si adatta a queste caratteristiche. Nelle bande di frequenza più alte, questa impressionante esplosione di potenza su vasti tratti di livelli di frequenza continua diventa ancora più evidente e può essere indicata come un ringing o una perdita spettrale (Scheffer-Teixeira et al., 2013). Questo può essere evidente in tutta la banda gamma alta (50-200 Hz o altro intervallo simile), un problema preoccupante dato molti laboratori di neurofisiologia utilizzano alta attività gamma dato il suo valore potenziale come un surrogato per l’attività neurale locale (Ray et al., 2008). L’esempio in Figura 1H dimostra come l’inclusione cumulativa (Figure 1E-G) di prove con picchi aggiunge variabilità spuria (rischiando un falso negativo) o altrimenti influenza la significatività statistica (rischiando un falso positivo).
Questo problema potrebbe essere più pervasivo che nelle registrazioni EEG o MEG a causa del contatto diretto del tessuto neurale, che può trasmettere ampiezze di picchi più grandi e deviazioni più nitide soprattutto nel caso di IEDs, contaminando le analisi neurofisiologiche. Inoltre, gli elettrodi intracranici sono specificamente posizionati in regioni che probabilmente sono clinicamente associate al focus delle crisi epilettiche, portando a forti e/o frequenti IED in alcuni set di dati IEEG.
Aneddoticamente, la maggior parte dei ricercatori in neurofisiologia umana sarebbe d’accordo sul fatto che la contaminazione dei dati da parte degli IED è una conoscenza comune, sebbene l’impatto di questo possa variare per alcuni tipi di analisi (Meisler et al., 2019). In effetti, si potrebbe anticipare che molti laboratori di ricerca hanno strategie in atto per aggirare, o almeno minimizzare questo problema. Tuttavia, se valutato praticamente, questo problema e le sue potenziali ramificazioni potrebbero essere molto più pervasivi del previsto. Un terzo fattore di complicazione può illustrare come questo possa essere così:
(3) I ricercatori di neurofisiologia (specialmente i primi tirocinanti come studenti e ricercatori post-dottorato) possono non ricevere una formazione diretta nell’identificazione di IED o artefatti elettrici. Inoltre, lo spettro di potenziali morfologie IED, e come le loro caratteristiche distinte possono essere previste per contaminare le analisi del segnale, potrebbe non essere inciso all’interno della formazione standard.
Come ulteriore complicazione, l’accordo inter-rater per il rilevamento IED è sorprendentemente povero, anche tra epilettologi completamente addestrati (Barkmeier et al, 2012; Janca et al., 2015).
Strategie per la gestione degli IED
Ci sono una varietà di approcci quando si incontrano gli IED nei dati, che possono dipendere o meno dal loro tasso e dall’estensione spaziale (per esempio, un ricercatore potrebbe non essere incline a curare e “pulire” un set di dati per un picco al minuto ma potrebbe per 10 picchi al minuto). Abbiamo distillato i potenziali approcci dei ricercatori in quattro strategie principali. La prima consiste nell’identificare e rimuovere manualmente tutte le prove o i periodi in cui si verificano gli IED, denominata qui strategia 1. I dati vengono passati al setaccio esaminando i grafici dei dati registrati con o senza qualche pre-elaborazione (filtro notch e/o passa-banda) e i segmenti di dati che contengono IED sono contrassegnati in modo che tutte le prove che si sovrappongono a questi segmenti possono essere lasciati fuori dalle analisi o convertiti in valori mancanti.
Alcuni ricercatori hanno ricevuto una formazione clinica formale nella lettura EEG/iEEG, anche se questo è meno comune per molti ricercatori non clinici che sono formati attraverso percorsi accademici di laurea-scienza. Mentre molti hanno ricevuto una formazione didattica e/o individuale su come identificare e rimuovere le prove IED dai set di dati, alcuni potrebbero non averlo fatto. A complicare la questione, i set di dati IEEG sono tutt’altro che standardizzati a causa delle differenze di registrazione: la disposizione delle reti generatrici di crisi differisce per ogni paziente con conseguente numero variabile di elettrodi, per non parlare delle differenze individuali nella neuroanatomia e la lateralità dell’impianto. Ci sono modalità di contatto miste (griglie, strisce, profondità) di diversa densità, insieme all’ordinamento personalizzato dei canali (montaggi). Tutti questi fattori portano ad una maggiore difficoltà nell’interpretazione delle analisi IEEG, in particolare per coloro che non hanno ricevuto una formazione adeguata (formale o informale) per l’identificazione di IED in questi layout di registrazione. Infine, con l’aumentare della durata delle registrazioni, la Strategia 1 diminuisce in praticità a causa dei vincoli di tempo e di sforzo.
Algoritmi computerizzati di rilevamento dei picchi sono stati sviluppati negli ultimi decenni per dotare la prossima generazione di scienziati di capacità di rilevamento dei picchi efficaci e standardizzate, per risparmiare tempo ed evitare gli errori umani. L’uso di rilevatori di IED e la rimozione dei trial/dati interessati in modo automatico costituisce un altro approccio, che chiameremo Strategia 2. Fortunatamente, gli IED tendono ad avere le caratteristiche che sono spesso salienti per molti algoritmi: componenti di grande ampiezza e nitidezza, e a volte con oscillazioni fisiopatologiche ad alta frequenza che si incontrano meno spesso nel cervello normale (anche se vedi Frauscher et al., 2018b). Idealmente, un algoritmo massimizzerà sia la sensibilità che la specificità, diminuendo o eliminando il contributo (supervisione, come l’impostazione della soglia) richiesto all’utente. È difficile soddisfare completamente questa lista di desideri, tuttavia, e quindi molti algoritmi sono stati sviluppati utilizzando una varietà di approcci automatizzati e non supervisionati. Questi includono derivazioni EEG (White et al., 2006), trasformazioni di lunghezza delle linee e di potenza (Esteller et al., 2001; Bergstrom et al., 2013), funzioni di trasferimento dirette adattive (Wilke et al., 2009), filtri spaziali (Liu et al., 2015), e algoritmi di corrispondenza spike-template come la regressione spazio-temporale (Tousseyn et al., 2014) e la fattorizzazione delle matrici non negative (Baud et al., 2018) tra molti altri approcci. Tutti gli strumenti hanno compromessi di sensibilità e specificità; nessun approccio fornisce il 100% di certezza, e questo è ulteriormente complicato dalla mancanza di un gold standard umano affidabile. In particolare, lo scarso accordo inter-rater del rilevamento manuale tra individui altamente addestrati di cui sopra, e la “zona grigia quantitativa” di piccoli IED discutibili che possono ignorare, sono caveat fondamentali per il test degli algoritmi. Infine, mentre quasi tutti i nuovi metodi vengono confrontati con il rilevamento manuale o con un altro metodo automatizzato, un ampio confronto tra la maggior parte o tutti i metodi automatizzati è difficile a causa delle sfide tecniche di implementare ciascuno a turno su un set di dati sufficientemente grande (Westover et al., 2017). Tuttavia, la rimozione automatica di picchi interictali utilizzando approcci non supervisionati e/o supervisionati può risparmiare tempo, approccio standardizzazione, e migliorare la qualità dei dati di neurofisiologia.
Come risultato dei caveat (e potenziali fallacie) di algoritmi di rilevamento automatico, alcuni ricercatori che li impiegano possono esitare a consentire piena discrezione a questo meccanismo. Poiché gli approcci di rilevamento automatico possono aumentare drasticamente l’efficienza per la maggior parte dei rilevamenti ovvi, una terza strategia (strategia 3) è un approccio ibrido delle strategie 1 e 2, in cui i rilevamenti automatici sono anche vagliati manualmente (spesso in quest’ordine, sebbene si possa applicare anche l’ordine opposto o iterazioni multiple). Un esempio di questo ibrido è attraverso l’uso di distribuzioni di caratteristiche morfologiche (ad esempio, pendenza, misure di potenza, ecc.) a cui può essere applicata una soglia, seguita da un’ispezione manuale per potenziali falsi positivi e/o negativi.
Data la complessità della raccolta di questi dati preziosi e la loro scarsità associata, uno svantaggio comune alle strategie 1, 2 o 3 è che la rimozione delle prove riduce la potenza statistica. Di conseguenza, un altro bias – verso il mantenimento di un maggior numero di prove – permette di introdurre un maggior numero di potenziali risultati di segnali spuri, aggiungendo il rischio di falsi negativi e positivi come descritto sopra.
La preferenza di mantenere il maggior numero possibile di prove introduce una diversa strategia per affrontare gli IED: l’agnosticismo, in cui gli IED vengono ignorati (non valutati) e nessuna prova viene rimossa (strategia 4). Si potrebbe naturalmente assumere che i dati afflitti da IED saranno abbastanza infrequenti e casuali da far sì che i punti di tempo interessati si fondano sullo sfondo di un segnale medio, aggiungendo variabilità ma senza alterare significativamente i risultati. Nel frattempo, si spera che le firme neurofisiologiche legate al compito emergano dall’analisi e prevalgano, se presenti, in virtù della loro coerenza tra le prove. Come un problema di segnale-rumore, questa ipotesi può essere valida per IED infrequenti, soprattutto con una forte dimensione dell’effetto sperimentale (anche se un ulteriore livello di sicurezza di utilizzare statistiche non parametriche può essere consigliato). Tuttavia, gli IED più frequenti (Figure 1E-H) e/o più grandi o più nitidi possono minare questo approccio. Ciononostante, una robusta potenza statistica è sempre preferibile, e spesso richiede un gran numero di studi che è più probabile raggiungere nell’approccio agnostico della Strategia 4, in particolare per la dimensione dell’effetto sottile. Infatti, uno studio recente (Meisler et al., 2019) ha valutato formalmente se la rimozione manuale, automatica o senza rimozione di IEDs ha influenzato i loro risultati neurofisiologici in un compito di memoria episodica – non hanno trovato alcun effetto chiaro di qualsiasi approccio, anche se ha sottolineato l’importanza di un numero sufficiente di prove. Su una nota correlata, le più recenti analisi di apprendimento automatico richiedono grandi volumi di dati di formazione per costruire modelli accurati – questi insieme agli approcci di apprendimento profondo possono imparare a differenziare tra segnali neurofisiologici normali e forme d’onda patologiche IED, a condizione che i dati di formazione precedenti siano accuratamente etichettati (spesso manualmente). Quindi, la strategia agnostica ha un certo fascino (incluso il basso sforzo) e potrebbe essere un buon default per alcuni studi, assumendo che ci siano abbastanza dati per impiegarla.
Pratiche attuali tra i ricercatori IEEG
Con queste diverse strategie generali in mente, come vengono attualmente gestiti gli IED dai ricercatori di neurofisiologia umana? Abbiamo valutato questa domanda sulle “Pratiche attuali” riassumendo prima come i ricercatori descrivono i loro metodi nella letteratura pubblicata. Abbiamo cercato su PubMed usando due ampie query: (intracranica AND eeg; elettrocorticografia) e abbiamo filtrato i risultati per includere solo gli studi pubblicati nel 2018. Abbiamo limitato i risultati della ricerca esaminando ogni articolo (613 articoli unici) e incluso solo quelli che misuravano i segnali neurofisiologici intracranici negli esseri umani e sembravano trarre conclusioni sulla neurofisiologia normale (91 totali). Anche se queste condizioni di ricerca non sono esaustive, forniscono un’istantanea contemporanea di diversi gruppi in tutto il mondo che studiano la neurofisiologia umana normale in vivo. Abbiamo trovato che la maggior parte di queste pubblicazioni alludeva all’utilizzo di metodi manuali (Figura 2A), compresa l’identificazione diretta delle IED, o un approccio simile (ma più conservativo) di identificazione ed esclusione degli elettrodi che coprivano i focolai di crisi. Meno del 5% dei manoscritti ha utilizzato metodi completamente automatizzati, e nessuno degli articoli inclusi ha utilizzato l’approccio agnostico (strategia 4). Ancora una volta, il nostro campione di articoli inclusi era limitato e questi risultati potrebbero non rappresentare completamente il campo.
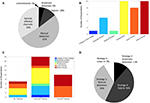
Figura 2. Pratiche attuali di gestione degli IED tra i ricercatori IEEG. (A) Metodi di gestione degli IED come riportato dai manoscritti del 2018 che corrispondono alla nostra ricerca PubMed e ai criteri di screening. (B) Livelli di carriera tra gli intervistati. (C) Formazione relativa all’identificazione e/o alla rimozione di IED tra gli intervistati. (D) Strategia utilizzata per la gestione degli IED tra gli intervistati.
Dato che i metodi di gestione degli IED non sembrano essere descritti in dettaglio in molti degli articoli, abbiamo ulteriormente valutato la nostra domanda “Pratiche attuali” progettando un sondaggio anonimo. Questo sondaggio (circa ~2 min) consisteva in domande riguardanti il livello di carriera, se avevano familiarità con le IED in IEEG, e avevano una formazione formale o informale o nessuna formazione sull’identificazione e la rimozione delle IED, insieme a una selezione di quale delle strategie (1-4) di cui sopra tendevano a usare (o altro). Abbiamo inviato un’e-mail agli autori corrispondenti elencati degli articoli descritti sopra (79 in totale, poiché alcuni articoli si sovrapponevano o avevano più autori corrispondenti) chiedendo la loro partecipazione volontaria, che sarebbe stata anonima (esente da requisiti IRB per l’ufficio IRB UCSF). Abbiamo chiesto a queste persone di inoltrare l’indagine anche ad altri colleghi e collaboratori.
Abbiamo ricevuto un tasso di risposta del 44%, con le risposte all’indagine ponderate verso i membri post-dottorato e di facoltà, probabilmente a causa di una distorsione di campionamento via e-mail ad una popolazione di autori corrispondenti (Figura 2B). Da notare che le risposte di questi membri anziani del laboratorio possono probabilmente rappresentare la pratica del loro laboratorio nel suo complesso sulla loro strategia IED, anche se questo è meno applicabile per la familiarità IED e domande di formazione. Tutti gli intervistati hanno indicato di avere familiarità con gli IED, un risultato rassicurante, anche se probabilmente influenzato dalla natura del sondaggio. Per quanto riguarda la formazione sul riconoscimento degli IED e i metodi di manipolazione, la maggior parte è stata formata in modo informale (Figura 2C), e alcuni non sono stati formati affatto. Non sorprende che coloro che si sono identificati come formati formalmente fossero docenti junior e senior, in linea con i requisiti clinici a livello di fellowship per la formazione formale sull’EEG nella maggior parte dei contesti. La maggior parte degli intervistati ha utilizzato un approccio manuale, sia isolatamente che come ibrido manuale-automatico (Strategie 1 e 3; Figura 2D), generalmente paragonabile alla revisione della letteratura (Figura 2A) come previsto. È interessante notare che non abbiamo trovato nessun articolo che indicasse esplicitamente l’uso della strategia 4 (“agnostico”) nonostante il 9% degli intervistati si sia identificato come tale, e l’incorporazione di metodi automatizzati (strategie 2 e 3) ha avuto una maggiore rappresentazione nelle risposte dell’indagine (55%) rispetto alla revisione della letteratura (14%). Queste discrepanze potrebbero essere spiegate da bias di segnalazione tuttavia, dati i diversi contesti di metodi manoscritti vs. un sondaggio diretto, e bias di campionamento (tasso di risposta del sondaggio).
Altre considerazioni
Mentre questo articolo si concentra principalmente su IED, i pericoli e le strategie qui descritte possono e dovrebbero essere estese ad altri artefatti elettrici o non fisiologici (movimenti del cavo, pops dell’elettrodo, saturazione dell’amplificatore, ecc. Per quanto riguarda l’esclusione del canale, i canali con abbondanti IED sono particolarmente problematici per i metodi automatizzati che si basano su stime di sfondo. Inoltre, se la neurofisiologia normale deve essere studiato, questi canali e qualsiasi che sono noti per essere nel tessuto lesionale dovrebbe essere escluso completamente (Frauscher et al, 2018a); questa pratica si rifletteva in circa un terzo dei manoscritti nella nostra revisione della letteratura (Figura 2A).
Per quanto riguarda il controllo sperimentale adeguato, è spesso fondamentale che la marcatura degli IED sia eseguita in cieco agli eventi del compito e alle condizioni sperimentali (più rilevante per le strategie manuali 1 e 3), per evitare distorsioni che potrebbero influenzare i risultati dello studio (ad esempio, rimuovendo le prove con IED più spesso da una condizione rispetto a un’altra). Per quanto riguarda i potenziali confondimenti negli studi basati su prove, gli IED sono spesso assunti per verificarsi in modo imprevedibile, anche al punto di casualità: questa ipotesi è favorevole se lasciando IED nei dati (strategia 4) poiché falsi positivi e negativi sarebbe diminuito attraverso la media di prova che migliora il rapporto segnale-rumore neurofisiologico. Tuttavia, va notato che il tempo di IEDs può non essere necessariamente casuale in un compito comportamentale. È stata descritta una modulazione dipendente dal compito della tempistica o della quantità di IED (Matsumoto et al., 2013), che potrebbe potenzialmente confondere i risultati ponderando preferenzialmente i risultati spuri in alcuni segmenti di prova più di altri. Questo sarebbe contro l’uso della strategia 4, anche se ancora una volta, l’enigma del numero di prove e la potenza statistica può essere problematico come notato sopra.
Infine, a parte le implicazioni di elaborazione del segnale, vale la pena ricordare che gli IED possono anche interrompere transitoriamente la disfunzione neurale locale della regione in cui si verificano (Krauss et al., 1997; Kleen et al., 2013; Horak et al., 2017; Ung et al., 2017). Questo potrebbe portare a errori cognitivi che potrebbero influenzare le analisi basate sui trial e altre analisi, ponendo un argomento separato per l’esclusione dei trial con IEDs quando si fanno conclusioni riguardanti l’elaborazione cognitiva “normale”.
Conclusioni
L’accelerazione della neurofisiologia intracranica umana trasmette grande entusiasmo per scoperte e capacità imminenti, tra cui l’espansione delle neuroscienze di base, il miglioramento delle terapie cliniche e lo sviluppo di interfacce cervello-macchina. Tuttavia, le IED pongono insidie di risultati spuri, difficili da evitare per la natura del tessuto epilettico in vivo da cui vengono registrati i dati. È necessaria una maggiore vigilanza per evitare le IED nei dati se/quando opportuno, il che può essere permesso dalla considerazione e dall’uso delle strategie sopra elencate. Suggeriamo anche che i ricercatori di medio livello e di alto livello cerchino di migliorare e fornire presentazioni o simulazioni di formazione standardizzate nei loro laboratori per l’identificazione, il rilevamento e i metodi di rimozione degli IED. Questo doterà i ricercatori più giovani di un importante set di abilità per comprendere ed esaminare costruttivamente i propri dati e quelli degli altri. Inoltre, sono necessari miglioramenti nella comunicazione scientifica (Suthana et al., 2018), in modo tale che i manoscritti sulla normale neurofisiologia umana dovrebbero trasmettere chiaramente l’approccio utilizzato per la gestione degli IED e la sua giustificazione nel contesto del loro studio. Tali pratiche di maggiore vigilanza e comunicazione chiara si spera miglioreranno la riproducibilità in modo che il campo possa continuare la sua accelerazione senza prevedibili battute d’arresto.
Data Availability Statement
I dati dell’indagine in questo articolo possono essere scaricati da doi: 10.5281/zenodo.3626105.
Ethics Statement
Gli studi che hanno coinvolto partecipanti umani sono stati rivisti e approvati dall’University of California San Francisco Institutional Review Board. Il consenso informato scritto per la partecipazione non è stato richiesto per questo studio in conformità con la legislazione nazionale e i requisiti istituzionali.
Contributi degli autori
SA e JK hanno sviluppato il concetto del manoscritto, creato e distribuito il sondaggio, eseguito la ricerca della letteratura e scritto il manoscritto. ML e EC hanno fornito un feedback significativo e modifiche al manoscritto. Tutti gli autori hanno letto e approvato il manoscritto inviato.
Finanziamento
SA è stato finanziato da un NIH Diversity Supplement sotto R01-DC012379. JK è stato finanziato dal National Institutes of Health/National Institute of Neurological Disorders and Stroke (NIH/NINDS) sovvenzioni R25NS070680 e K23NS110920. ML è stato finanziato da NIH Grant R01-DC015504, F32-DC013486 e il Kavli Institute for Brain and Mind e DARPA contratto N66001-17-2-4008. EC è stato finanziato da sovvenzioni NIH (R01-DC012379, R00-NS065120, e DP2-OD00862) e il Esther A. and Joseph Klingenstein Fund.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo Maxime Baud e Han Yi per le loro utili discussioni e commenti durante lo sviluppo di questo manoscritto.
Andrews, J. P., Gummadavelli, A., Farooque, P., Bonito, J., Arencibia, C., Blumenfeld, H., et al. (2019). Associazione della diffusione delle crisi con il fallimento chirurgico nell’epilessia. JAMA Neurol. 76, 462-469. doi: 10.1001/jamaneurol.2018.4316
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkmeier, D. T., Shah, A. K., Flanagan, D., Atkinson, M. D., Agarwal, R., Fuerst, D. R., et al. (2012). Alta variabilità inter-revisore di rilevamento spike su EEG intracranico affrontato da un algoritmo automatico multi-canale. Clin. Neurophysiol. 123, 1088-1095. doi: 10.1016/j.clinph.2011.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Baud, M. O., Kleen, J. K., Anumanchipalli, G. K., Hamilton, L. S., Tan, Y.-L., Knowlton, R., et al. (2018). Apprendimento non supervisionato delle scariche intertemporali spazio-temporali nell’epilessia focale. Neurosurgery 83, 683-691. doi: 10.1093/neuros/nyx480
PubMed Abstract | CrossRef Full Text | Google Scholar
Bergstrom, R. A., Choi, J. H., Manduca, A., Shin, H.-S., Worrell, G. A., e Howe, C. L. (2013). Identificazione automatica di più tipi di eventi epilettiformi sequestro-correlati e interictale nell’EEG dei topi. Sci. Rep. 3:1483. doi: 10.1038/srep01483
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, E. F. (2015). Verso le neurotecnologie mesoscopiche su larga scala, basate sull’uomo. Neuron 86, 68-78. doi: 10.1016/j.neuron.2015.03.037
PubMed Abstract | CrossRef Full Text | Google Scholar
Chronux Home. (2019). Software di analisi Chronux. Disponibile online a: http://chronux.org/. Accessed September 25, 2019.
Cuello Oderiz, C., von Ellenrieder, N., Dubeau, F., Eisenberg, A., Gotman, J., Hall, J., et al. (2019). Associazione della crisi indotta da stimolazione corticale con esito chirurgico in pazienti con epilessia focale resistente ai farmaci. JAMA Neurol. 76, 1070-1078. doi: 10.1001/jamaneurol.2019.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Esteller, R., Echauz, J., Tcheng, T., Litt, B., and Pless, B. (2001). “Line length: an efficient feature for seizure onset detection,” in Proceedings of the 2001 Conference 23rd Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Istanbul, Turkey: IEEE, 1707-1710.
Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Doležalová, I., Minotti, L., Olivier, A., et al. (2018a). Atlante dell’elettroencefalogramma intracranico normale: attività neurofisiologica sveglia in diverse aree corticali. Brain 141, 1130-1144. doi: 10.1093/brain/awy035
PubMed Abstract | CrossRef Full Text | Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Rogers, C., Khoa Nguyen, D., Kahane, P., et al. (2018b). Oscillazioni ad alta frequenza nel cervello umano normale. Ann. Neurol. 84, 374-385. doi: 10.1002/ana.25304
PubMed Abstract | CrossRef Full Text | Google Scholar
Horak, P. C., Meisenhelter, S., Song, Y., Testorf, M. E., Kahana, M. J., Viles, W. D., et al. (2017). Scariche epilettiformi interictali compromettono il richiamo di parole in più aree cerebrali. Epilepsia 58, 373-380. doi: 10.1111/epi.13633
PubMed Abstract | CrossRef Full Text | Google Scholar
Janca, R., Jezdik, P., Cmejla, R., Tomasek, M., Worrell, G. A., Stead, M., et al. (2015). Rilevamento di scariche epilettiformi interictali utilizzando la modellazione della distribuzione dell’inviluppo del segnale: applicazione alle registrazioni intracraniche epilettiche e non epilettiche. Brain Topogr. 28, 172-183. doi: 10.1007/s10548-014-0379-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kleen, J. K., Scott, R. C., Holmes, G. L., Roberts, D. W., Rundle, M. M., Testorf, M., et al. Ippocampale attività epilettiforme interictale disturba la cognizione negli esseri umani. Neurology 81, 18-24. doi: 10.1212/wnl.0b013e318297ee50
PubMed Abstract | CrossRef Full Text | Google Scholar
Kramer, M. A., Tort, A. B. L., e Kopell, N. J. (2008). Artefatti di bordo tagliente e accoppiamento spurio in misure di comodulazione di frequenza EEG. J. Neurosci. Methods 170, 352-357. doi: 10.1016/j.jneumeth.2008.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Krauss, G. L., Summerfield, M., Brandt, J., Breiter, S., e Ruchkin, D. (1997). Mesial picchi temporali interferire con la memoria di lavoro. Neurology 49, 975-980. doi: 10.1212/wnl.49.4.975
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Coon, W. G., de Pesters, A., Brunner, P., e Schalk, G. (2015). Gli effetti del filtraggio spaziale e degli artefatti sui segnali elettrocorticografici. J. Neural Eng. 12:056008. doi: 10.1088/1741-2560/12/5/056008
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsumoto, J. Y., Stead, M., Kucewicz, M. T., Matsumoto, A. J., Peters, P. A., Brinkmann, B. H., et al. Oscillazioni di rete modulare interictale epilettiforme tasso di spike durante la memoria umana. Brain 136, 2444-2456. doi: 10.1093/brain/awt159
PubMed Abstract | CrossRef Full Text | Google Scholar
Meisler, S. L., Kahana, M. J., e Ezzyat, Y. (2019). La pulizia dei dati migliora la classificazione degli stati cerebrali? J. Neurosci. Methods 328:108421. doi: 10.1016/j.jneumeth.2019.108421
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitra, P., e Bokil, H. (2007). Dinamiche cerebrali osservate. New York, NY: Oxford University Press.
Google Scholar
Parvizi, J., e Kastner, S. (2018). Promesse e limiti dell’elettroencefalografia intracranica umana. Nat. Neurosci. 21, 474-483. doi: 10.1038/s41593-018-0108-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., and Hsiao, S. S. (2008). Correlati neurali di alto-gamma oscillazioni (60-200 Hz) in potenziali di campo locale macaco e le loro potenziali implicazioni in elettrocorticografia. J. Neurosci. 28, 11526-11536. doi: 10.1523/JNEUROSCI.2848-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Scheffer-Teixeira, R., Belchior, H., Leão, R. N., Ribeiro, S., e Tort, A. B. L. (2013). Sulle oscillazioni di campo ad alta frequenza (>100 Hz) e la perdita spettrale di attività spiking. J. Neurosci. 33, 1535-1539. doi: 10.1523/JNEUROSCI.4217-12.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Suthana, N., Aghajan, Z. M., Mankin, E. A., and Lin, A. (2018). Linee guida di segnalazione e questioni da considerare per l’utilizzo della stimolazione cerebrale intracranica negli studi sulla memoria dichiarativa umana. Front. Neurosci. 12:905. doi: 10.3389/fnins.2018.00905
PubMed Abstract | CrossRef Full Text | Google Scholar
Tousseyn, S., Dupont, P., Robben, D., Goffin, K., Sunaert, S., e Van Paesschen, W. (2014). Un affidabile e risparmio di tempo semiautomatico spike-template-based analisi di EEG-FMRI interictale. Epilepsia 55, 2048-2058. doi: 10.1111/epi.12841
PubMed Abstract | CrossRef Full Text | Google Scholar
Ung, H., Cazares, C., Nanivadekar, A., Kini, L., Wagenaar, J., Becker, D., et al. (2017). L’attività epilettiforme interictale al di fuori della zona di insorgenza delle crisi ha un impatto sulla cognizione. Brain 140, 2157-2168. doi: 10.1093/brain/awx143
PubMed Abstract | CrossRef Full Text | Google Scholar
van Drongelen, W. (2018). Elaborazione dei segnali per i neuroscienziati. Londra: Elsevier Academic press.
Google Scholar
Westover, M. B., Halford, J. J., and Bianchi, M. T. (2017). Cosa dovrebbe significare per un algoritmo superare un test di turing statistico per il rilevamento di scariche epilettiformi. Clin. Neurophysiol. 128, 1406-1407. doi: 10.1016/j.clinph.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
White, A. M., Williams, P. A., Ferraro, D. J., Clark, S., Kadam, S. D., Dudek, F. E., et al. (2006). Efficienti algoritmi non supervisionati per il rilevamento di crisi epilettiche in registrazioni EEG continuo da ratti dopo lesioni cerebrali. J. Neurosci. Methods 152, 255-266. doi: 10.1016/j.jneumeth.2005.09.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilke, C., van Drongelen, W., Kohrman, M., and He, B. (2009). Identificazione dei focolai epilettogeni dall’analisi causale dell’attività spike interictale ECoG. Clin. Neurophysiol. 120, 1449-1456. doi: 10.1016/j.clinph.2009.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar