La colonscopia per lo screening del cancro al colon è efficace sia nella riduzione della mortalità attraverso la diagnosi precoce che nella prevenzione attraverso la rimozione dei polipi precancerosi (1-8). Questi benefici, tuttavia, potrebbero essere compensati dall’inadeguatezza della qualità della colonscopia e dalle complicazioni (9-17). I polipi mancanti e la polipectomia incompleta possono contribuire allo sviluppo del cancro di intervallo (tumori rilevati dopo la colonscopia) (10-14, 18, 19). Anche se l’emorragia post-colonscopia è relativamente poco comune, verificandosi in 1-6/1000, (15-17) è la complicazione principale che porta a visite ospedaliere non pianificate entro 7 giorni dalla colonscopia (20). La polipectomia è la causa principale (21-26). I fattori di rischio che aumentano il sanguinamento post-polipectomia includono le dimensioni del polipo, il numero di polipi, la terapia anti-coagulazione e l’istologia del polipo (17, 21, 27, 28). Tecniche avanzate di polipectomia come la resezione mucosa endoscopica (EMR) e la dissezione sottomucosa endoscopica (ESD) sembrano rimuovere più completamente i polipi, ma aumentano anche il tempo della procedura, il costo e i rischi di sanguinamento (17, 29-31).
A parte l’EMR e l’ESD, poca attenzione è stata data alla tecnica di polipectomia come fattore di rischio per il sanguinamento postpolipectomia. Infatti, la tecnica tradizionale di polipectomia con trappola, generalmente accettata e ampiamente utilizzata, per ghigliottinare il polipo intrappolato con o senza coagulazione a caldo, non è cambiata molto per quasi 5 decenni (32-37). Per prevenire il sanguinamento post-polipectomia, uno degli autori (ZJC) ha sviluppato lo stripping endoscopico della mucosa (EMS) come una modifica della tradizionale polipectomia a trappola fredda (TCSP) per evitare di tagliare la sottomucosa ricca di vasi sanguigni perché tutti i polipi non cancerosi che sono il tipo più frequente di polipi visti durante la colonscopia di screening sono per definizione confinati alla mucosa e non si estendono alla sottomucosa. Il 31 dicembre 2012 è stata presa la decisione di adottare sistematicamente l’innovazione tecnica perché l’EMS ha mostrato un successo precoce nella rimozione completa dei polipi non peduncolati senza sostanziali lesioni sottomucose. Questo rapporto ha analizzato l’efficacia dell’EMS nel prevenire il sanguinamento post-polipectomia e nel facilitare la rimozione completa del polipo, specialmente per i polipi avanzati ad alto rischio.
- Metodi
- Pazienti e disegno dello studio
- Endoscopic Mucosal Stripping (EMS)
- Valutazione dei risultati
- Esame colonscopico
- Analisi statistica
- Risultati
- L’EMS ha prevenuto il sanguinamento post-polipectomia con ricovero
- EMS Facilitated Complete Polypectomy
- Discussione
- Dichiarazione etica
- Contributi degli autori
- Dichiarazione di conflitto di interessi
- Riconoscimenti
- Materiale supplementare
- Abbreviazioni
Metodi
Pazienti e disegno dello studio
Questa è stata un’indagine retrospettiva dei dati che incorporano la cartella clinica elettronica e i vetrini di patologia al Minnesota Gastroenterology, PA (MNGI). Un’esenzione dell’Internal Review Board è stata concessa per l’indagine. I pazienti erano quelli che hanno avuto colonscopia con polipectomia snare sotto Current Procedural Terminology (CPT) codice 45385 da ZJC presso i centri di endoscopia ambulatoriale MNGI durante un periodo di 12 anni diviso in pre-EMS era (2005-2012) e EMS era (2013-2016). Una ricerca nel database è stata eseguita per i casi di sanguinamento post-polipectomia che richiedevano l’ospedalizzazione e i polipi avanzati definiti come polipi con caratteristiche villose, displasia di alto grado, adenoma sessile seghettato con displasia citologica (SSACD), nonché qualsiasi polipo adenomatoso di 10 mm o più grande. Poiché MNGI aveva un’ampia copertura della pratica locale e una linea telefonica per le complicazioni con personale 24 ore su 24, ha avuto un tasso di cattura quasi completo per le complicazioni che sono state sottoposte a revisione tra pari e riportate agli endoscopisti coinvolti per il miglioramento della qualità.
Endoscopic Mucosal Stripping (EMS)
Endoscopic mucosal stripping (EMS) è la rimozione endoscopica della mucosa contenente polipi mediante stripping meccanico utilizzando un laccio freddo. Si tratta di una modifica del TCSP in quanto l’EMS rimuove la mucosa dalla sottomucosa intrappolata nello spazio potenziale tra di loro (Figura 1, video supplementare) piuttosto che ghigliottinare l’intero tessuto intrappolato come originariamente descritto per il TCSP (36, 37). EMS è quindi previsto per ridurre al minimo la lesione sottomucosa e associati sanguinamento immediato e ritardato. Per il raro polipo peduncolato, usiamo ancora la polipectomia a caldo perché il danno tissutale indotto dalla cauterizzazione può essere in gran parte limitato al gambo intraluminale e non si estende in profondità nella parete del colon. Quindi, abbiamo applicato la SME esclusivamente ai polipi non peduncolati senza caratteristiche suggestive di malignità. Qui di seguito, spieghiamo in dettaglio le specificità delle tecniche EMS in base alle dimensioni del polipo.
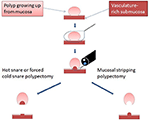
Figura 1. Diagramma che illustra la differenza critica tra EMS e la polipectomia tradizionale. Ristampato da Chen e Batts (38), Copyright (2017) con il permesso di Elsevier per l’uso come contenuto ad accesso aperto sotto licenza d’uso CC-BY.
Per i polipi piccoli (≤ 5 mm), TCSP generalmente funziona bene. Per assicurare una resezione completa, preferiamo la trappola alla pinza bioptica, tranne che per i polipi minori di 2 mm o più piccoli (25) e rimuoviamo abitualmente 2-3 mm di mucosa adiacente durante la polipectomia. Tuttavia, la sottomucosa può ancora rimanere intrappolata all’interno dell’ansa impedendo la completa chiusura dell’ansa senza ghigliottina a forza bruta o coagulazione a caldo (ansa calda). Quando ciò si verifica, tirando delicatamente e con fermezza l’ansa nel cannocchiale e mantenendola saldamente ma non strettamente chiusa, la mucosa contenente il polipo viene solitamente strappata/spillata via, lasciando dietro di sé la sottomucosa intrappolata che forma uno pseudostriscio transitoriamente sollevato (Figura 2A). Endoscopicamente, la mucosa rimossa è di solito in un unico pezzo, mentre la sottomucosa rimane in gran parte intatta senza danni ai vasi sanguigni (Figura 2B). La lacerazione della mucosa causata dalla SME crea generalmente un sito di polipectomia leggermente più grande ma molto meno sanguinolento di quello che sarebbe causato dalla TCSP. Per EMS per essere efficace, è fondamentale per mantenere la trappola saldamente ma non troppo stretto chiuso durante stripping. Chiudere la trappola non abbastanza saldamente causerà lo slittamento della trappola, mentre chiuderla troppo saldamente porterà a danni sottomucosi come la formazione di ematomi e il fallimento dello stripping. Un endoscopista esperto può facilmente percepire la sottigliezza e istruire l’infermiere che assiste l’endoscopia a regolare la fermezza appropriata della presa quando si tira l’ansa.
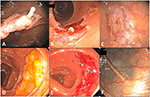
Figura 2. Polipectomie EMS. (A) pseudostalk sottomucoso dopo polipectomia di un adenoma tubolare cecale sessile di 10 mm. (B) Un pezzo intatto di polipo contenente mucosa dopo la rimozione (in alto a destra) e il sito polipo-free polipectomia con pseudostalk visibile (in basso a sinistra). (C) Un sito pulito polipectomia senza deformità nonostante minore trasudazione capillare transitoria subito dopo polipectomia. Il sollevamento della mucosa intrappolata ha impedito lo sviluppo di pseudostalk. (D) Un adenoma seghettato sessile del colon trasversale di 30 mm. (E) Sito di polipectomia di (D) dopo polipectomia frammentaria. (F) Stesso sito di polipectomia tatuato come (E) 1 anno dopo.
Mentre l’intrappolamento sottomucoso può essere evitato per i polipi più piccoli posizionando in modo ottimale la trappola e sollevando delicatamente il polipo, questo può diventare inevitabile con la rimozione del polipo più grande. Sebbene la tecnica sopra descritta sia ancora valida, la sottomucosa intrappolata spesso impedisce la separazione dell’ansa dal sito di polipectomia anche dopo che la mucosa contenente il polipo è già stata rimossa. In tali circostanze, non c’è bisogno di tirare ulteriormente il laccio con la forza bruta. Invece, aprendo leggermente il laccio e facendolo scorrere sulla sottomucosa intrappolata, si libererà il laccio e la mucosa contenente il polipo rimossa ma ancora apparentemente attaccata dal sito della polipectomia. La sottomucosa intrappolata da questi polipi più grandi frequentemente forma uno pseudostelo più spesso, ma la lesione sottomucosa rimane minima.
Per i polipi ancora più grandi che non possono essere rimossi in un unico pezzo, può essere eseguita la polipectomia frammentaria EMS. Perché la mancanza di EMS ‘di lesioni sottomucose crea un sito meno sanguinosa o deformata polipectomia in confronto con polipectomia tradizionale freddo o caldo trappola, qualsiasi tessuto residuo polipo è meglio visualizzato facilitare la rimozione completa del polipo (Figura 2).
Valutazione dei risultati
1. Ospedalizzazione-richiedendo tassi di sanguinamento postpolipectomia di tutti e non-peduncolato polipi del colon prima e dopo l’adozione EMS.
2. Completezza della rimozione dei polipi EMS determinata dalla biopsia del sito di polipectomia e dall’esame durante la colonscopia di follow-up a intervalli raccomandati dalle linee guida della società nazionale (13, 14).
Esame colonscopico
Le colonscopie sono state eseguite utilizzando colonscopi a rigidità variabile (PCF 160, CF 160, PCF 180 e CF 180; Olympus Corp. Tokyo, Giappone) per la maggior parte dei casi e colonscopi a spettro completo FUSE (EndoChoice, Alpharetta, Georgia) per alcuni casi come parte di una prova. Le polipectomie sono state eseguite utilizzando per lo più rullini ovali (da 100600 a 100602, ConMed, Utica, NY) e, in pochi casi, rullini a spirale (SD-230U-20, Olympus Corp, Tokyo, Giappone) e rullini Exacto (BX00711115, US Endoscopy, Mentor, OH).
Nell’ambito della misurazione della qualità MNGI, le seguenti statistiche annuali di colonscopia sono state riportate per ZJC per il 2014 e il 2016: tasso di raggiungimento dell’intestino cieco 99,5-100%, tassi di rilevamento dei polipi adenomatosi alla colonscopia di screening 50,3-60,1% per i maschi e 42.1-54,0% per le femmine.
Analisi statistica
L’analisi statistica è stata eseguita utilizzando il test esatto di Fisher.
Risultati
L’EMS ha prevenuto il sanguinamento post-polipectomia con ricovero
Un totale di 5.142 colonscopie con polipectomia a trappola eseguite da ZJC presso i centri di endoscopia ambulatoriale MNGI durante 12 anni sono stati divisi in era pre-EMS (2005-2012, n = 2973) ed era EMS (2013-2016, n = 2169) (Tabella 1). L’ultimo ricovero che richiedeva un’emorragia post-polipectomia si è verificato nel settembre 2012. Nessuno è stato trovato durante l’era EMS (tasso 0%) mentre dieci (compresi 2 polipi peduncolati) sono stati trovati durante l’era pre-EMS (tasso 0,336%). L’ospedalizzazione è avvenuta da 1 a 16 giorni dopo la colonscopia. Questa differenza era statisticamente significativa (P = 0,0055) ed è rimasta tale dopo aver escluso i 2 casi di polipi peduncolati (P = 0,012).
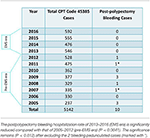
Tabella 1. Casi di sanguinamento post-polipectomia e casi di polipectomia totale con laccio (codice CPT #45385) in 12 anni.
Tra i 12 casi di sanguinamento, sono stati rimossi un totale di 18 polipi. Ad eccezione di due adenomi tubolari (TA) di 2-3 mm che sono stati rimossi usando un laccio freddo, tutti sono stati rimossi usando un laccio caldo. Questi includevano dieci TA di 8-40 mm (inclusi 2 polipi peduncolati di 11-15 mm e 36-40 mm, rispettivamente), un adenoma tubuloso (TVA) di 25 mm, quattro adenomi seghettati sessili (SSA) di 6-10 mm e un lipoma di 5 mm. Ad eccezione di un caso che aveva solo parziale recupero del polipo resecato e non aveva sottomucosa al microscopio, tutti i restanti nove casi hanno mostrato evidenza di sottomucosa cauterizzata spesso con vasi sanguigni visibili vicino al bordo cauterizzato come illustrato nella Figura 3C. Questi risultati indicano che il danno sottomucoso durante la polipectomia hot snare ha contribuito al sanguinamento postpolipectomia.
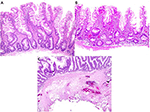
Figura 3. Confronto istopatologico di polipi avanzati rimossi con EMS e polipectomia a caldo. (A,B) I polipi rimossi con EMS mostrano tipicamente un aspetto profondo della muscularis mucosae con una scarsità di sottomucosa e mancanza di vasi sanguigni. (C) Basso ingrandimento di un polipo rimosso usando la trappola a caldo mostra la tipica quantità di sottomucosa con danni ai tessuti causati dalla cauterizzazione.
Per confronto, abbiamo anche esaminato al microscopio 20 casi consecutivi di polipi del colon avanzati rimossi usando lo SME. Questi polipi contenevano solo una quantità variabile di muscularis mucosae e scarsa, se presente, sottomucosa senza vasi sanguigni (Tabella 2, Figure 3A,B). Questi risultati indicano che l’EMS ha impedito il sanguinamento post-polipectomia evitando il danno sottomucoso.
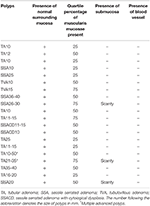
Tabella 2. Caratteristiche di 20 casi consecutivi di polipi del colon avanzati rimossi usando EMS.
EMS Facilitated Complete Polypectomy
Biopsie estese sono state eseguite sul bordo (x4) e pseudostalk (x1) di 10 siti di polipi avanzati selezionati a caso dopo la rimozione completa endoscopicamente da EMS. Nessun residuo di polipo è stato trovato in nessun campione. Novantasette siti di polipectomia neoplastica EMS sono stati seguiti da 6 mesi a 4 anni, compresi 38 siti di polipectomia in 23 pazienti dopo la rimozione di polipi avanzati. Nessuno dei 59 siti di polipo neoplastico non avanzato (< 10 mm e senza caratteristiche avanzate) aveva polipi residui o ricorrenti sulla colonscopia di follow-up. La stragrande maggioranza (33 di 38; 87%) siti di polipo avanzato anche non aveva polipi su colonscopia di follow-up (Tabella 3). Due piccoli polipi sono stati trovati vicino al sito del polipo #12 1 anno dopo, ma erano di un tipo diverso da quello originale (SSA contro TA). Per i polipi #13, #22, e #25, anche se le colonscopie di follow-up 1-3,5 anni dopo hanno trovato un piccolo (2-5 mm) stesso tipo di polipo (TA) vicino al sito originale della polipectomia in ogni caso, è stato difficile determinare se i polipi erano di nuova formazione o residui perché si sono tutti verificati in casi di poliposi con 24, 10, e 14 polipi adenomatosi rimossi nelle colonscopie combinate iniziali e di follow-up, rispettivamente. Diversi tipi di piccoli polipi (SSA piuttosto che TA) sono stati scoperti anche vicino ai siti originali di polipectomia del polipo #13 e #25 nella colonscopia di follow-up, suggerendo ulteriormente una nuova crescita del polipo piuttosto che una polipectomia incompleta. Un SSA di 10 mm è stato trovato 14 mesi dopo dietro una piega vicino al sito di polipectomia tatuato del SSA piatto di 50 mm (#26). Questo potrebbe rappresentare una polipectomia incompleta, forse a causa delle dimensioni extra-large del polipo originale, ma potrebbe anche rappresentare un polipo separato in fase di ingrandimento, mancato nella colonscopia originale a causa della sua posizione molto nascosta dietro una piega che si vede meglio in retroflessione (Figura 4). Quindi, non un singolo caso convincente e al massimo 4/97 (4,1%) di tutti i polipi neoplastici seguiti o 4/38 (10,5%) dei polipi avanzati rimossi usando lo SME avevano una polipectomia incompleta. Questi tassi sono stati confrontati molto favorevolmente con quelli riportati per le tecniche tradizionali di polipectomia con laccio (18).
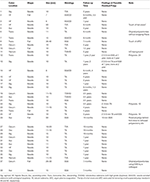
Tabella 3. Follow-up di 38 polipi del colon avanzati rimossi usando EMS in 23 pazienti.
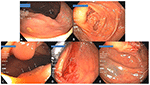
Figura 4. (A) Un grande adenoma seghettato sessile di 50 mm (Polyp # 26 nella tabella 3) nel colon ascendente prossimale con ICV visibile in background (freccia). (B) Panoramica del sito della polipectomia 14 mesi dopo con uno dei tatuaggi visibile sulla destra (frecce). (C) Un SSA di 10 mm nascosto dietro una piega (frecce) vicino al sito di polipectomia. (D) Sito di polipectomia del polipo in (C) in visione retroflessa. (E) Spazio relativo di uno dei tatuaggi (in basso a sinistra) e della piega dietro la quale si nascondeva il polipo in (C) (freccia).
Discussione
Le nostre analisi dei dati confermano che lo SME ha impedito il sanguinamento post-polipectomia e ha facilitato la rimozione completa del polipo rispetto alle tecniche tradizionali di polipectomia con laccio. L’EMS potrebbe quindi rendere la colonscopia più sicura e più efficace come strumento di prevenzione del cancro al colon.
Le complicazioni della colonscopia come l’emorragia post-polipectomia e la perforazione si verificano a causa della lesione della sottomucosa e dei tessuti più profondi. Tali lesioni non sono necessarie per la rimozione di polipi precancerosi del colon e dovrebbero essere evitate.
La sottomucosa è ricca di tessuto connettivo e vasi sanguigni. Il suo intrappolamento si verifica spesso durante la polipectomia a trappola che impedisce la chiusura completa della trappola senza ghigliottina a forza bruta o coagulazione a caldo. La tecnica TCSP per ghigliottinare l’intero tessuto intrappolato danneggia la sottomucosa intrappolata anche se in misura minore rispetto alla tecnica hot snare (39). L’aumento del tasso di sanguinamento immediato con la TCSP che richiede un intervento emostatico come il clipping non solo potrebbe compromettere l’individuazione dei residui di polipo, ma limita anche la sua applicazione ai polipi più grandi (39-42). Evitando di tagliare interamente la sottomucosa, lo SME previene il sanguinamento immediato e ritardato e appare sicuro per i polipi più grandi anche senza interrompere le terapie anticoagulanti e antiaggreganti (Figura 5).

Figura 5. (A) Un adenoma seghettato sessile del colon trasverso di 15 mm con displasia citologica (polipo n. 7 nella tabella 3). (B) sito polipectomia immediatamente dopo la rimozione del polipo in (A). (C) Stesso sito di polipectomia di (B) 6 mesi dopo. Questo paziente non ha interrotto il clopidogrel al momento della polipectomia. Con il profilo di sicurezza dell’EMS, fu presa la decisione di procedere con la polipectomia considerando che avrebbe potuto avere una colonscopia ripetuta difficile a causa della sua età avanzata (4 mesi sotto gli 80 anni) e un colon lungo e tortuoso con costipazione. Alla fine ha avuto una colonscopia 6 mesi più tardi per l’istopatologia ad alto rischio del polipo.
Una preoccupazione potenziale è la completezza della polipectomia EMS, soprattutto nel pseudostalk. I nostri dati di biopsia del sito di polipectomia e l’analisi di altri dello pseudostalk dopo la polipectomia con trappola a freddo (43) hanno mostrato la rimozione completa del polipo. Ciò è ulteriormente supportato dalla frequenza con cui abbiamo rilevato possibili polipi residui nei siti di polipectomia EMS durante la colonscopia di follow-up (probabilmente 0% e al massimo 4,1% tutti i polipi neoplastici o 10,5% avanzati) che è molto più bassa di quella precedentemente riportata (18). Sulla base di campionamenti dei bordi delle polipectomie endoscopicamente “complete”, Pohl et al. hanno notato neoplasie inaspettatamente persistenti nel 10,1% di tutte le polipectomie, il 17,3% dei polipi neoplastici da 10-20 mm, tassi maggiori per gli SSA che per gli AT (31 contro 7,2%), e il 47,6% di tutti i grandi (10-20 mm) SSA sono stati rimossi in modo incompleto (18). Zhang et al. hanno analogamente riportato una TCSP incompleta di polipi (6-9 mm) (8,5% in media e 13% per la resezione frammentaria) con un’emorragia immediata che richiede il clipping che si verifica all’1,8 e 2,7% per polipo e per paziente, rispettivamente (40). Una probabile spiegazione della differenza è che i siti di polipectomia EMS erano meno traumatici, con un sanguinamento o una deformazione minimi rispetto a quelli della polipectomia tradizionale a freddo o a caldo. Questo non solo ha facilitato l’individuazione e la rimozione dei residui di polipo, ma ha anche permesso una resezione della mucosa più generosa senza preoccupazioni per il sanguinamento e altre complicazioni. La polipectomia completa è importante nella prevenzione dei tumori del colon di intervallo che rappresentano il 2,6-9,0% dei tumori totali del colon (19).
I polipi peduncolati possono avere un alto rischio di sanguinamento post-polipectomia perché la lesione sottomucosa è inevitabile. L’esperienza acquisita può aver portato a una riduzione del sanguinamento da questi rari polipi poiché la ZJC ha spostato il taglio lontano dalla parete del colon e vicino al polipo sul gambo. Ma la riduzione del sanguinamento post-polipectomia da polipi peduncolati prima e dopo lo SME non era statisticamente significativa. Crediamo che la SME piuttosto che l’acquisizione di esperienza abbia portato all’eliminazione del sanguinamento post-polipectomia dai polipi non peduncolati.
Un ematoma potrebbe raramente svilupparsi da un vaso sottomucoso strappato durante la SME di grandi polipi. Tuttavia, la sottomucosa intatta impedisce a qualsiasi ematoma di ingrandirsi e dissanguarsi. Nella nostra esperienza, la barriera naturale fornita dalla sottomucosa intatta è apparsa superiore alla coagulazione fornita dal laccio caldo nel prevenire il sanguinamento post-polipectomia ritardato.
Rispetto alla REM, la SME è molto più facile da eseguire e può ottenere lo stesso risultato di polipectomia anche per alcune grandi lesioni a diffusione laterale (Tabella 3) senza risorse aggiuntive e con un rischio di sanguinamento molto ridotto. Sono necessari ulteriori studi per confrontare direttamente EMS e EMR, soprattutto per la rimozione di grandi polipi.
Perché EMS rimuove solo la mucosa, qualsiasi tumore precoce con invasione sottomucosa è fuori dal suo campo di applicazione. Da notare, abbiamo incontrato un caso di un polipo sessile del colon di 10 mm non sospetto canceroso durante il periodo di studio. È interessante notare che il sito della polipectomia ha continuato a trasudare e ha richiesto l’emoclipping. La diagnosi è stata ottenuta solo dopo la rimozione del polipo e il paziente è stato successivamente riferito alla chirurgia senza incidenza. La diagnosi del modello della fossa ingrandita può essere stata utile in una prediagnosi in questo caso e l’esame attento del polipo è sempre incoraggiato prima dell’EMS per evitare di tagliare il polipo canceroso. Tuttavia, nessun esito negativo si è verificato in questo caso.
La SME può essere eseguita con trappole a spirale o Exacto e in combinazione con l’iniezione sottomucosa per il sollevamento della mucosa, la coagulazione al plasma di argon o l’ablazione calda della punta della trappola. Resta da vedere se migliorano ulteriormente l’efficacia della SGA.
La SGA è stata adottata con successo da parecchi colleghi di MNGI (Tabella 3, #37-38) ma la generalizzabilità dei suoi benefici ha bisogno di ulteriori studi di conferma. Tuttavia, questa innovazione relativamente semplice ma efficace nella tecnica di polipectomia potrebbe rappresentare una nuova frontiera per una più sicura ed efficace prevenzione del cancro al colon tramite colonscopia.
Dichiarazione etica
Questo studio retrospettivo ha ottenuto l’esenzione dalla determinazione di revisione IRB il 12 maggio 2016 (IRB ID: 5502) da Sterling IRB (www.sterlingirb.com) ed è stato condotto in conformità al protocollo approvato di Clinical and Histopathological Review of Mucosal Stripping as a Colonoscopy Polypectomy Technical Innovation e alle raccomandazioni del Minnesota Gastroenterology Quality Committee. Tutti i soggetti hanno dato il consenso informato scritto alle procedure di colonscopia e al trattamento in conformità con la Dichiarazione di Helsinki.
Contributi degli autori
ZC ha iniziato il concetto di indagine e la progettazione, acquisizione, analisi e interpretazione dei dati, redazione e revisione del manoscritto. KB ha partecipato all’acquisizione, all’analisi e all’interpretazione dei dati nonché alla revisione critica del manoscritto.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo Douglas Nelson MD, Robert Ganz MD, John Allen MD, David Lieberman MD, Douglas Rex MD, Linda Rabeneck MD, Aasma Shaukat MD, Zong-ming Eric Chen MD PhD, Jeffrey Rank MD, Joshua Colton MD e Cecil Chally MD per la revisione critica e gli utili suggerimenti, Zengri Wang e Yongquan Xue PhD per l’assistenza nell’analisi statistica, Brian Hardwig per l’aiuto nell’impostazione della registrazione video, Carlie Leyde, Amy Lounsbury, Martha Carland, JaNelle Gorg, Siri McCord, Karen Lang e Marit Brock per l’assistenza amministrativa. Ringraziamo anche le infermiere di endoscopia di Minnesota Gastroenterology per l’assistenza alla polipectomia EMS.
Un poster dei risultati preliminari di questa indagine è stato presentato al DDW 2017 a Chicago, USA. Un abstract del poster è stato pubblicato in Gastrointestinal Endoscopy 2017; 85:AB520.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online a: https://www.frontiersin.org/articles/10.3389/fmed.2018.00312/full#supplementary-material
Abbreviazioni
EMS, endoscopic mucosal stripping; EMR, endoscopic mucosal resection; ESD, endoscopic submucosal dissection; TCSP, traditional cold snare polypectomy; TA, adenoma tubulare; TVA(HD), adenoma tubulovilloso (con displasia di alto grado); SSA(CD), adenoma seghettato sessile (con displasia citologica); UC, colite ulcerosa.
1. Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevenzione del cancro colorettale da polipectomia colonoscopica. Il gruppo di lavoro nazionale di studio del polipo. N Engl J Med. (1993) 329:1977-81. doi: 10.1056/NEJM199312303292701
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, et al. polipectomia colonoscopica e prevenzione a lungo termine dei decessi per cancro colorettale. N Engl J Med. (2012) 366:687-96. doi: 10.1056/NEJMoa1100370
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. incidenza a lungo termine del cancro colorettale e mortalità dopo l’endoscopia inferiore. N Engl J Med. (2013) 369:1095-105. doi: 10.1056/NEJMoa1301969
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Amri R, Bordeianou LG, Sylla P, Berger DL. Impatto della colonscopia di screening sui risultati nella chirurgia del cancro al colon. JAMA Surg. (2013) 148:747-54. doi: 10.1001/jamasurg.2013.8
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brenner H, Stock C, Hoffmeister M. Effetto della sigmoidoscopia di screening e colonscopia di screening su incidenza e mortalità del cancro colorettale: revisione sistematica e meta-analisi di studi controllati randomizzati e studi osservazionali. BMJ (2014) 348:g2467-78. doi: 10.1136/bmj.g2467
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Sonnenberg A, Delcò F, Inadomi JM. Costo-efficacia della colonscopia nello screening per il cancro colorettale. Ann Intern Med. (2000) 133:573-84. doi: 10.7326/0003-4819-133-8-200010170-00007
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Costo-efficacia dello screening del cancro colorettale. Epidemiol Rev. (2011) 33:88-100. doi: 10.1093/epirev/mxr004
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Lieberman DA Screening per il cancro colorettale in individui a rischio medio: metodi attuali e problemi emergenti. JAMA Intern Med. (2014) 174:10-11. doi: 10.1001/jamainternmed.2013.11499
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Tempi di ritiro colonscopico e rilevamento di adenoma durante la colonscopia di screening. N Engl J Med. (2006) 355:2533-41. doi: 10.1056/NEJMoa055498
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, et al. Indicatori di qualità per la colonscopia e il rischio di cancro dell’intervallo. N Engl J Med. (2010) 362:1795-803. doi: 10.1056/NEJMoa0907667
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, et al. Adenoma detection rate e rischio di cancro colorettale e morte. N Engl J Med. (2014) 370:1298-306. doi: 10.1056/NEJMoa1309086
CrossRef Full Text | Google Scholar
12. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determinato da colonscopia tandem: una revisione sistematica. Am J Gastroenterol. (2006) 101:343-50. doi: 10.1111/j.1572-0241.2006.00390.x
CrossRef Full Text | Google Scholar
13. Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Linee guida per la sorveglianza colonscopia dopo lo screening e polipectomia: un aggiornamento di consenso dalla US multi-society task force sul cancro colorettale. Gastroenterologia (2012) 143:844-57. doi: 10.1053/j.gastro.2012.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB, et al. Indicatori di qualità per la colonscopia. Gastrointest Endosc. (2015) 81:31-53. doi: 10.1016/j.gie.2014.07.058
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Waye JD, Lewis BS, Yessayan S. Colonscopia: un rapporto prospettico di complicazioni. J Clin Gastroenterol. (1992) 15:347-51. doi: 10.1097/00004836-199212000-00018
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ko CW, Dominitz JA. Complicazioni della colonscopia: entità e gestione. Gastrointest Endosc Clin N Am. (2010) 20:659-71. doi: 10.1016/j.giec.2010.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ASGE Standards of Practice Committee, Fisher, DA, Maple, JT, Ben-Menachem, T, Cash, BD, Decker, GA, et al. Complicazioni della colonscopia. Gastrointest Endosc. (2011) 74:745-52. doi: 10.1016/j.gie.2011.07.025
CrossRef Full Text | Google Scholar
18. Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Resezione incompleta del polipo durante la colonscopia – risultati dello studio CARE (Complete Adenoma Resection). Gastroenterologia (2013) 144:74-80. doi: 10.1053/j.gastro.2012.09.043
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Adler J, Robertson DJ. Intervallo di cancro colorettale dopo la colonscopia: esplorando spiegazioni e soluzioni. Am J Gastroenterol. (2015) 110:1657-64. doi: 10.1038/ajg.2015.365
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Ranasinghe I, Parzynski CS, Searfoss R, Montague J, Lin Z, Allen J, et al. Differenze nella qualità della colonscopia tra le strutture: sviluppo di un tasso di rischio standardizzato post-colonscopia di visite ospedaliere non pianificate. Gastroenterologia (2016) 150:103-13. doi: 10.1053/j.gastro.2015.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Rosen L, Bub DS, Reed JF, Nastasee SA. Emorragia dopo polipectomia colonscopica. Dis Colon Retto. (1993) 36:1126-31. doi: 10.1007/BF02052261
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Gibbs DH, Opelka FG, Beck DE, Hicks TC, Timmcke AE, Gathright JB. Emorragia colonica post-polipectomia. Dis Colon Rectum. (1996) 39:806-10. doi: 10.1007/BF02054448
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Emorragia gastrointestinale inferiore post-polipectomia: analisi descrittiva. Gastrointest Endosc. (2000) 51:690-6. doi: 10.1067/mge.2000.105773
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, et al. Complicazioni della colonscopia in un sistema integrato di assistenza sanitaria. Ann Intern Med. (2006) 145:880-6. doi: 10.7326/0003-4819-145-12-200612190-00004
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Tolliver KA, Rex DK. Polipectomia colonoscopica. Gastroenterol Clin North Am. (2008) 37:229-51, ix. doi: 10.1016/j.gtc.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Rabeneck L, Paszat LF, Hilsden RJ, Saskin R, Leddin D, Grunfeld E, et al. Sanguinamento e perforazione dopo colonscopia ambulatoriale e loro fattori di rischio nella pratica clinica abituale. Gastroenterologia (2008) 135:1899-906. doi: 10.1053/j.gastro.2008.08.058
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, et al. Eventi avversi dopo colonscopia ambulatoriale nella popolazione Medicare. Ann Intern Med. (2009) 150:849-57. doi: 10.7326/0003-4819-150-12-200906160-00008
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Fattori di rischio per gravi emorragie post-polipectomia ritardata. Endoscopia (2008) 40:115-9. doi: 10.1055/s-2007-966959
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Fattori che prevedono il sanguinamento dopo la resezione mucosa endoscopica di grandi lesioni del colon. Endoscopia (2011) 43: 506-11. doi: 10.1055/s-0030-1256346
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Bahin FF, Rasouli KN, Byth K, Hourigan LF, Singh R, Brown GJ, et al. Previsione di sanguinamento clinico significativo dopo la resezione endoscopica di grande campo sessile e lateralmente diffusione lesioni colorettali: un punteggio di rischio clinico. Am J Gastroenterol. (2016) 111:1115-22. doi: 10.1038/ajg.2016.235
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Albéniz E, Fraile M, Ibáñez B, Alonso-Aguirre P, Martínez-Ares D, Soto S, et al. Un sistema di punteggio per determinare il rischio di sanguinamento ritardato dopo resezione mucosa endoscopica di grandi lesioni colorettali. Clin Gastroenterol Hepatol. (2016) 14:1140-7. doi: 10.1016/j.cgh.2016.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Wolff WI, Shinya H. Diagnosi precoce del cancro del colon attraverso l’endoscopia del colon (colonscopia). Cancer (1974) 34:912-34.
Google Scholar
33. Tedesco FJ. Polipectomia colonoscopica. In: Silvia SE, editore. Therapeutic Gastrointestinal Endoscopy (1984) New York, NY: Igaku-Shoin. p. 269-88.
Google Scholar
34. Waye JD. Principi di base della polipectomia. In: Waye JD, Rex DK, Williams CB, editors. Principi e pratica della colonscopia. Malden, MA; Oxford: Carlton (2003) p. 410-9. doi: 10.1002/9780470986943.ch35
CrossRef Full Text | Google Scholar
35. Waye JD. Polipectomia: principi di base. In: Waye JD, Rex DK, Williams CB, editors. Principi e pratica della colonscopia. Oxford; Hoboken, NJ: Wiley-Blackwell (2009) p. 572-81.
Google Scholar
36. Meeroff JC. Rimozione di polipi sessili di medie dimensioni del colon senza diatermia. Gastrointest Endosc. (1989) 35:136. doi: 10.1016/S0016-5107(89)72740-1
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Tappero G, Gaia E, De Giuli P, Martini S, Gubetta L, Emanuelli G. Escissione a freddo di piccoli polipi colorettali. Gastrointest Endosc. (1992) 38:310-3. doi: 10.1016/S0016-5107(92)70422-2
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Chen ZJ., Batts K. P. (2017). Mo2011 eliminazione del sanguinamento post-polipectomia e rimozione più completa dei polipi con lo stripping mucosale endoscopico (EMS). Gastroenterol. Endos. 85(Suppl. 5):AB520. Abstract Mo2011. doi: 10.1016/j.gie.2017.03.1198
CrossRef Full Text | Google Scholar
39. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Rimozione di piccoli polipi colorettali in pazienti anticoagulati: un confronto prospettico randomizzato di trappola fredda e polipectomia convenzionale. Gastrointest Endosc. (2014) 79:417-23. doi: 10.1016/j.gie.2013.08.040
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Zhang Q, Gao P, Han B, Xu J, Shen Y. Polipectomia per la resezione endoscopica completa di piccoli polipi colorettali. Gastrointest Endosc. (2017). 87(3):733-740. doi: 10.1016/j.gie.2017.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Paspatis GA, Tribonias G, Konstantinidis K, Theodoropoulou A, Vardas E, Voudoukis E, et al. Un confronto prospettico randomizzato di freddo vs caldo polipectomia snare nel verificarsi di sanguinamento post-polipectomia in piccoli polipi del colon. Colorectal Dis. (2011) 13:e345-8. doi: 10.1111/j.1463-1318.2011.02696.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Repici A, Hassan C, Vitetta E, Ferrara E, Manes G, Gullotti G, et al. Sicurezza della polipectomia fredda per < polipi 10mm alla colonscopia: uno studio prospettico multicentrico. Endoscopia. (2012) 44:27-31. doi: 10.1055/s-0031-1291387
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Tutticci N, Burgess NG, Pellise M, Mcleod D, Bourke MJ. Caratterizzazione e significato delle protrusioni nel difetto della mucosa dopo la polipectomia fredda snare. Gastrointest Endosc. (2015) 82:523-8. doi: 10.1016/j.gie.2015.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar