- Introduzione
- Materiali e metodi
- Soggetti e paradigma sperimentale
- Risonanza magnetica funzionale e segnali dipendenti dal livello di ossigeno nel sangue
- Selezione delle regioni di interesse per i segnali dipendenti dal livello di ossigeno nel sangue del cervelletto/del tronco cerebrale
- Calcolo della media del sangue-ossigeno livello-dipendente, Beat-to-Beat Interval, e le onde di respirazione
- Risultati
- Discussione
- Coincidenza delle onde di respirazione e dell’artefatto dipendente dal livello di ossigeno del sangue respiratorio
- Attivazione neurale ritmica associata all’oscillazione neurale dipendente dal livello di ossigeno nel sangue
- Attività neurale come “forza motrice” per le oscillazioni lente della frequenza cardiaca
- Limitazioni e prospettive future
- Conclusione
- Data Availability
- Ethics Statement
- Contributi degli autori
- Conflitto di interessi
- Riconoscimenti
- Abbreviazioni
Introduzione
L’aritmia del seno respiratorio (RSA) riflette l’accelerazione della frequenza cardiaca (HR) durante l’ispirazione e la decelerazione HR durante l’espirazione. Si tratta di un principio fondamentale (Yasuma e Hayano, 2004) e del fenomeno centrale della resonance breathing paced a 6/min associato a un’amplificata variabilità della frequenza cardiaca a bassa frequenza (HRV), a un maggiore benessere emotivo (Mather e Thayer, 2018) e a una migliore elaborazione delle emozioni negative (Zaccaro et al., 2018). È interessante notare che esistono eccezioni di RSA con aumenti dell’intervallo battito-battito (RRI) dell’HR durante l’ispirazione e con la fase RRI che conduce rispetto al ritmo respiratorio (Rassler et al., 2018). Questa insolita RSA paradossale è stata trovata in una minoranza di partecipanti sani durante la scansione della risonanza magnetica funzionale (fMRI), una situazione scomoda, a volte claustrofobica, solitamente associata a un aumento dell’ansia di stato (Munn et al., 2015; Pfurtscheller et al., 2018).
Le onde respiratorie spontanee lente con una frequenza compresa tra 6 e 9 respiri/min sono anche accompagnate da HRV elevato e potrebbero quindi facilitare l’elaborazione di emozioni spiacevoli come ansia e stress (Thayer e Lane, 2009). A causa del ruolo di primo piano della RRI sulle oscillazioni respiratorie durante l’insolita cessazione della RSA (Rassler et al., 2018), sembra probabile un oscillatore neurale autonomo (pacemaker centrale; Julien, 2006) nel cervello, che agisce come fonte delle oscillazioni lente della RRI. È degno di nota che Perlitz et al. (2004) hanno riportato un nuovo tipo di ritmo cardiovascolare nella banda 0,15-Hz nell’uomo e nel cane con un’origine comune nel tronco cerebrale. La caratteristica più interessante di questa banda larga “ritmo 0.15-Hz” (che include anche componenti di frequenza vicino a 0.1 Hz) è che i periodi delle onde del fuso sono accoppiati in fase con la respirazione in un rapporto di 1:1. Il nostro principale interesse di ricerca era quello di identificare questo pacemaker, che è suggerito per essere situato nel tronco cerebrale (Lambertz e Langhorst, 1998; Perlitz et al, 2004), analizzando i segnali BOLD.
Il segnale BOLD non quantifica direttamente l’attività neurale in sé, ma è sensibile ai cambiamenti del tasso metabolico cerebrale, del flusso sanguigno cerebrale e del volume del sangue cerebrale (Obrig et al., 2000; Buxton et al., 2004) e a diversi tipi di movimento (movimenti del petto e dei vasi sanguigni; Birn et al., 2006). Pertanto, i segnali BOLD possono essere composti da componenti neurali e non neurali (ad esempio, il movimento dei vasi). Ci si aspetta che due segnali BOLD di origine diversa potrebbero essere identificati nel tronco cerebrale con il suo grande vaso sanguigno (arteria basilare) e la sorgente neurale postulata a 0,15 Hz (Perlitz et al., 2004). Supponiamo che uno di essi risulti dal movimento dei vasi sanguigni (BOLDv) e indichi l’inizio di un’azione respiratoria lenta, poiché si verifica quasi contemporaneamente all’attivazione neurale dei neuroni respiratori. L’altro si pensa sia associato all’attivazione neurale (BOLDn) ritardata dal tempo di accoppiamento neurovascolare di 2-3 s (Mateo et al., 2017). Noi ipotizziamo che entrambi i segnali BOLD puntino a un pacemaker centrale nel tronco cerebrale.
Materiali e metodi
Soggetti e paradigma sperimentale
Il gruppo di soggetti studiato era lo stesso (età 23,8 ± 3,3 anni) analizzato recentemente da Rassler et al. (2018). La registrazione e la pre-elaborazione dell’ECG e della respirazione sono state descritte in quell’articolo. Tutti i partecipanti hanno dato il consenso informato scritto al protocollo dello studio, che era stato approvato dal comitato etico locale dell’Università di Graz.
Risonanza magnetica funzionale e segnali dipendenti dal livello di ossigeno nel sangue
Le immagini funzionali sono state acquisite con uno scanner 3 T (Magnetom Skyra) utilizzando una sequenza GE-EPI multibanda (Moeller et al, 2010) con un’acquisizione simultanea a sei bande con TE/TR = 34/871 ms, 52° flip angle, 2 mm × 2 mm × 2 mm dimensione del voxel, 66 fette assiali contigue (11 × 6), matrice di acquisizione di 90 × 104, e un FOV di 180 mm × 208 mm. Questa velocità di scansione di 871 ms (frequenza di campionamento 1.15 Hz) permette di studiare le oscillazioni lente nell’intervallo 0.1-0.15 Hz. Per ulteriori dettagli sulla pre-elaborazione, vedere Pfurtscheller et al. (2018). L’atlante di etichettatura anatomica automatizzata (AAL) (Tzourio-Mazoyer et al., 2002) è stato utilizzato per estrarre corsi di tempo dei segnali BOLD in 116 regioni di interesse (ROI). Questo atlante non mostra ROI nel tronco cerebrale, ma solo in prossimità del cervelletto e del vermis. A causa della vicinanza di queste regioni e a causa della contiguità di un’arteria principale, è ragionevole supporre che il segnale raccolto dalle ROI AAL etichettate “cervelletto” rifletta parzialmente l’attività del tronco cerebrale.
Selezione delle regioni di interesse per i segnali dipendenti dal livello di ossigeno nel sangue del cervelletto/del tronco cerebrale
Tra le 116 ROI dell’atlante AAL, le ROI da 91 a 108 corrispondono a fette assiali del cervelletto, compreso il tronco cerebrale (Tzourio-Mazoyer et al, 2002). Le immagini T1 della fetta assiale (spazio Talairach z = -34) documentano la vicinanza del cervelletto e del tronco cerebrale (Figura 1). A causa del loro piccolo numero di voxel (<200), ROIs 107 e 108 sono stati esclusi da ulteriori analisi. ROI dal cervelletto / tronco cerebrale sono stati ispezionati visivamente al fine di cercare ROI appropriato, cioè, ROI con un buon rapporto segnale-rumore e dominante onde BOLD lento. Sono state identificate le seguenti ROI: 96, 98, 100, 103 e 105. I numeri indicano le etichette ROI secondo l’atlante AAL. I numeri pari e dispari indicano gli emisferi destro e sinistro, rispettivamente.
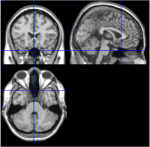
Figura 1. Immagini T1 da fette mediale, sagittale e assiale da un soggetto (spazio Talairach 0, 20, -34). Nella fetta sagittale (immagine in alto a destra), il ponte è chiaramente visibile, e nella fetta assiale (in basso) la vicinanza del cervelletto e del tronco cerebrale è documentata.
Calcolo della media del sangue-ossigeno livello-dipendente, Beat-to-Beat Interval, e le onde di respirazione
Averaging permette migliorare il rapporto segnale-rumore, ma richiede l’uso di un trigger. Poiché non sono disponibili tali trigger nei dati dello stato di riposo, sono stati utilizzati i massimi che si verificano ritmicamente (picchi) del segnale RRI (Pfurtscheller et al., 2017): In primo luogo, sono stati identificati i picchi più prominenti dei segnali RRI, distanziati di almeno diversi secondi. Nel caso di oscillazioni a 0,1 Hz, questi intervalli tra i picchi erano circa 10 s, e nel caso di oscillazioni a 0,15 Hz, erano circa 7 s (un esempio è rappresentato nella Figura 2 dalle linee verticali tratteggiate quasi equidistanti). I picchi RRI contrassegnati sono stati utilizzati come trigger per la media (epoche con 6 s prima e 6 s dopo il trigger) attraverso il BOLD, RRI, e segnali di respirazione.
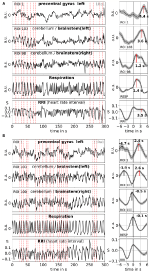
Figura 2. Esempi di segnali BOLD, RRI e respirazione in corso e corrispondenti onde medie (±SE) per due soggetti, uno con dominante 0.1-Hz e uno con dominante 0.15-Hz oscillazioni. Le linee tratteggiate verticali nei pannelli sul lato sinistro indicano i massimi (picchi) delle oscillazioni RRI utilizzati come trigger per la media. I picchi delle onde mediate sono indicati nei pannelli sul lato destro.
Risultati
Oscillazioni BOLD lento nel cervelletto / tronco cerebrale sono caratterizzati dalla loro qualità del segnale favorevole, ma ancora più importante, dalla loro coincidenza con oscillazioni in RRI e respirazione. Come riportato in Rassler et al. (2018), le oscillazioni 0.1-Hz hanno prevalso durante ~37% del tempo di registrazione, mentre le oscillazioni 0.15-Hz hanno prevalso in ~45%. Due esempi caratteristici per le oscillazioni 0.1-Hz (soggetto 1Rb1) e 0.15-Hz (soggetto 11Ra1) sono visualizzati nella Figura 2. In entrambi i casi, le oscillazioni RRI di grande ampiezza coincidono con la respirazione in forma di un aumento RRI durante l’ispirazione e sono anche chiaramente riflesse nei segnali BOLD nel tronco cerebrale. Nota, la dinamica variabile di oscillazioni spontanee e onde singole, rispettivamente, nello stato di riposo dare una forte evidenza che non solo uno ma una varietà di ritmi cardiovascolari esistono con componenti di frequenza vicino a 0.1 e 0.15 Hz. Alcuni di questi ritmi sono amplificati durante l’elaborazione dell’ansia, altri no, e alcuni sono sincronizzati nella corteccia prefrontale e nel tronco cerebrale e altri no.
Esempi di segnali spontanei e onde medie di due soggetti caratteristici sono mostrati nella Figura 2. Le onde medie con latenze di picco marcate (distanza dal picco RRI) di tutti i soggetti sono visualizzate nella Figura 3. Da notare, la varianza relativamente piccola delle onde BOLD medie nel tronco cerebrale sottolinea l’affidabilità delle misure di picco.
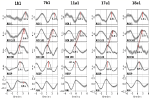
Figura 3. Onde mediate (±SE) dei segnali BOLD da giro precentrale sinistro (ROI 1), tronco cerebrale sinistro (BOLDn, ROIs 103, 105), tronco cerebrale destro (BOLDv, 96, 98, 100), respirazione, e intervalli RR (dall’alto verso il basso) da tutti i cinque soggetti. Le latenze di picco (differenza dal picco RRI) da picchi importanti sono contrassegnati. Lo spostamento temporale di 2-3 s tra i due segnali BOLD dal cervelletto / tronco cerebrale è indicato da una linea tratteggiata.
L’onda BOLD nell’emisfero destro che precede l’onda di respirazione da 0,3 ± 0,2 s è stato interpretato come BOLDv, e l’onda BOLD nell’emisfero sinistro in ritardo l’onda di respirazione da 2,3 ± 0,5 s è stato preso come BOLDn. La differenza di picco tra le onde BOLDv e BOLDn era 2.6 ± 0.4 s.
Le onde medie in Figura 3 evidenziano il chiaro sfasamento tra i due segnali BOLD nel tronco cerebrale (BOLDn, BOLDv) in tutti i cinque soggetti. Le differenze di picco sono indicate da linee tratteggiate. Oltre ai due segnali BOLD dal tronco cerebrale, il segnale BOLD dal giro precentrale sinistro (ROI 1) è stato analizzato come controllo. Anche se le onde BOLD medie nella corteccia prefrontale (PFC) mostrano una varianza elevata (SE), sono in sorprendente perfetta corrispondenza con le onde BOLDn nel cervelletto / tronco cerebrale. Questo conferma la forte interazione tra la PFC e il tronco cerebrale nella gamma di frequenza lenta intorno a 0,1 Hz.
Discussione
Coincidenza delle onde di respirazione e dell’artefatto dipendente dal livello di ossigeno del sangue respiratorio
La respirazione è accompagnata non solo dal movimento del petto ma anche dal movimento dei vasi sanguigni cerebrali (Birn et al., 2006). Uno spostamento temporale stabile di 0,3 ± 0,2 s è stato osservato tra il picco positivo del segnale BOLDv nel cervelletto destro e il massimo di ogni onda respiratoria (inizio dell’espirazione). La respirazione era spontanea, e il picco di respirazione ritardato il picco BOLDv, forse indicando una vasomozione vivace dell’arteria basilare, un grande vaso sanguigno vicino al lato rostrale del ponte. Questa vasomozione potrebbe essere considerato un artefatto respiratorio indotto da una modulazione respiratoria dei neuroni simpatico-eccitatori nel nucleo reticolare rostroventrolaterale. Una marcata influenza del generatore centrale del pattern respiratorio sull’attività dei nervi simpatici è stata osservata in molte specie, compreso l’uomo (Haselton e Guyenet, 1989; Häbler e Jänig, 1995; Eckberg, 2003; Mandel e Schreihofer, 2006). La diminuzione dell’attività di questi neuroni nel midollo rostroventrolaterale (cioè la depressione simpatica) durante l’inspirazione e un brusco aumento dell’attività con la cessazione degli scoppi frenici è uno dei modelli predominanti di accoppiamento respiratorio-simpatico (Haselton e Guyenet, 1989). Queste oscillazioni simpatiche modulate dalla respirazione causano una vasodilatazione massima alla fine dell’ispirazione (cioè, massimo del segnale BOLD immediatamente precedente l’inizio dell’espirazione) e vasocostrizione durante l’espirazione (minimo del segnale BOLD appena precedente l’inizio dell’ispirazione).
Attivazione neurale ritmica associata all’oscillazione neurale dipendente dal livello di ossigeno nel sangue
Le oscillazioni BOLD (BOLDn) hanno ritardato l’artefatto respiratorio periodico (BOLDv) di 2.6 ± 0.4 s. Entrambe le oscillazioni BOLD sono state registrate simultaneamente in fette assiali con BOLDn associata all’attività neurale come forza motrice per la respirazione spontanea e BOLDv che riflette un movimento vascolare associato all’inizio dell’espirazione. Questo ritardo temporale di 2-3 s corrisponde al tempo di accoppiamento neurovascolare (Mateo et al., 2017).
Varie influenze esterne sull’emozione suscitate dalla scomoda posizione supina con la testa del soggetto in uno spazio rumoroso limitato possono attivare prima le aree sensoriali primarie ed essere seguite dalla proiezione corticale ai neuroni respiratori del tronco cerebrale. Inoltre, le influenze interne e comportamentali derivanti dai centri superiori modificano i modelli metabolici della respirazione. L’output respiratorio finale coinvolge una complessa interazione tra strutture corticali, tronco cerebrale e sistema limbico ed è caratteristico della respirazione emotiva (Homma e Masaoka, 2008; Kato et al., 2018). Pertanto, è abbastanza plausibile che le oscillazioni nel giro precentrale sinistro (ROI 1) fossero sincronizzate con le oscillazioni BOLD lente, indotte neuralmente nel cervelletto/stelo cerebrale.
Attività neurale come “forza motrice” per le oscillazioni lente della frequenza cardiaca
Le dinamiche variabili dei modelli di accoppiamento osservati nello stato di riposo puntano verso una varietà di ritmi cardiovascolari nella banda di frequenza tra 0,1 e 0,15 Hz. Questo sottolinea l’importanza, la flessibilità e la complessità dell’interazione cervello-cuore e merita ulteriori ricerche intensive.
In tutti e cinque i partecipanti, il modello di accoppiamento tra respirazione e HR era abbastanza contrario al tipico RSA (Rassler et al., 2018), cioè il RRI aumentava durante l’ispirazione e diminuiva durante l’espirazione. Durante le situazioni ansiogene, la respirazione tende ad essere più veloce e l’attività vagale diminuisce, portando ad una maggiore HR (RRI più breve). Tuttavia, quando la respirazione è inconsciamente/autonomicamente rallentata in una situazione ansiogena, l’attività vagale potrebbe aumentare, con conseguente HR più bassa (RRI più grande). Sembra che non solo l’attivazione corticale induce un aumento quasi simultaneo dell’RRI (Barry, 1983; Damen e Brunia, 1987; Pfurtscheller e Lopes da Silva, 1999; Pfurtscheller et al., 2013), ma il nostro studio fornisce la prima prova che anche un pacemaker centrale nel cervelletto / tronco cerebrale può agire come forza motrice per le oscillazioni intrinseche dell’RRI e le onde respiratorie spontanee lente. Questo risultato supporta fortemente il lavoro di Perlitz et al. (2004) sul “ritmo 0.15-Hz.”
Limitazioni e prospettive future
La selezione delle ROI con segnali BOLD di buona qualità nel cervelletto/stelo cerebrale è stata fatta tramite ispezione visiva. Questo includeva la differenziazione tra oscillazioni BOLD di origine neurale e artefatti di movimento. Quest’ultimo denota segnali BOLD sincronizzati con la respirazione. Per ulteriori studi, si raccomanda di calcolare i valori di blocco di fase (PLV; Pfurtscheller et al., 2017) tra RRI e segnali BOLD individuali nel cervelletto/stelo del cervello. Inoltre, la valutazione sincrona delle metriche di ventilazione, come il volume tidal/volume respiratorio per tempo, la pCO2 end-tidal, e il tipo di respirazione (naso vs bocca), così come l’uso di vari metodi di denoising in ambienti clinici e sperimentali animali, potrebbe dare intuizioni più profonde nelle complesse interazioni dei sistemi di regolazione coinvolti.
Lo “spegnimento” dell’aritmia sinusale respiratoria è un’eccezione di un fenomeno fisiologico fondamentale che può verificarsi, ad esempio, in situazioni che provocano ansia. Tra 23 partecipanti sani di uno studio fMRI, solo cinque soggetti hanno presentato questo modello di accoppiamento paradossale.
Un prerequisito per l’analisi BOLD (Bn e Bv) nel tronco cerebrale è una coincidenza di oscillazioni lente di respirazione e RRI; tuttavia, un tale accoppiamento 1:1 può essere trovato solo in una minoranza di partecipanti. Quindi, questo tipo di analisi è limitato a questi rari casi. Ciononostante, si presume che un pacemaker centrale nel tronco cerebrale sia prevalente anche negli individui con un RSA normale e un accoppiamento 1:2 o 1:3 (due o tre respiri durante un ciclo RRI). I primi risultati del calcolo dell’accoppiamento di fase (PLV) tra le oscillazioni BOLD del tronco cerebrale e le oscillazioni RRI nella banda da 0,1 a 0,15 Hz supportano questa ipotesi. Con questo metodo, è possibile misurare l’attività pacemaker nel tronco cerebrale indipendente dalla frequenza respiratoria. Questo lavoro è in corso.
Si deve notare che il livello di ansia di stato negli individui con respirazione spontanea lenta variava tra AS = 14 e AS = 28 (possibile gamma di punteggi AS: 10-40) e non tutti gli individui con punteggi di ansia elevati hanno mostrato questo tipo di respirazione lenta. Concludiamo quindi che non esiste una chiara relazione tra la respirazione spontanea lenta e l’elaborazione dell’ansia.
Conclusione
1. Le oscillazioni BOLD dello stato di riposo dal cervelletto/stelo cerebrale possono avere frequenze alternate tra 0,1 e 0,15 Hz, simili a quelle riportate nei segnali di RRI e respirazione (Rassler et al., 2018).
2. Alcuni segnali BOLD dal cervelletto/stelo cerebrale possono essere influenzati dalla vasomozione (arteria basilare), mentre altri possono essere associati a un’attività pacemaker centrale nel tronco cerebrale. Di conseguenza, il tempo effettivo di inizio della respirazione così come la sua fonte neurale potrebbe essere rilevato nei segnali BOLD.
3. Entrambi i segnali BOLD con origini diverse registrati contemporaneamente caratterizzano una fonte comune, che supporta il lavoro di Perlitz et al. (2004).
4. I risultati suggeriscono che ci sono prove per una respirazione emotiva inconscia a 6-9/min (0.1-0.15 Hz), che – in modo simile alla respirazione di risonanza cosciente a 6/min (0.1 Hz) che promuove il benessere psicologico (Mather e Thayer, 2018) – eleva anche l’HRV e può facilitare l’elaborazione delle emozioni negative.
Data Availability
I dataset generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Ethics Statement
Questo studio è stato condotto in conformità alle raccomandazioni della Dichiarazione di Helsinki del 1964 con il consenso informato scritto di tutti i soggetti. Tutti i soggetti hanno dato il consenso informato scritto in conformità con la Dichiarazione di Helsinki. Il protocollo è stato approvato dal comitato etico dell’Università di Graz.
Contributi degli autori
GP ha contribuito alla concettualizzazione e alla bozza originale. BR e AA hanno aiutato nella metodologia, nell’elaborazione dei dati, nelle statistiche, nella scrittura e nella visualizzazione. AS, BR, GS, WK, e JT hanno rivisto e modificato il manoscritto.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori vorrebbero ringraziare Thomas Zussner, David Fink, e Karl Koschutnig, Università di Graz, per il supporto nell’acquisizione dei dati.
Abbreviazioni
BOLD, Blood-oxygenation-level-dependent; ECG, Elettrocardiogramma; (f)MRI, (funzionale)Risonanza magnetica; HR, Frequenza cardiaca; HRV, Variabilità della frequenza cardiaca; PFC, Corteccia prefrontale; ROI, Regione di interesse; RRI, Beat-to-beat interval; RSA, Respiratory sinus arrhythmia.
Barry, R. J. (1983). La bradicardia primaria e la risposta cardiaca evocata nel contesto della sala operatoria. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Separare le fluttuazioni legate alle variazioni respiratorie dalle fluttuazioni legate all’attività neuronale nella fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., e Liu, T. T. (2004). Modellazione della risposta emodinamica all’attivazione del cervello. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., e Brunia, C. H. M. (1987). Cambiamenti nella frequenza cardiaca e nei potenziali cerebrali lenti legati alla preparazione motoria e all’anticipazione dello stimolo in un compito di stima del tempo. Psicofisiologia 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). Il gate respiratorio umano. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., e Jänig, W. (1995). Coordinazione del sistema simpatico e respiratorio: esperimenti neurofisiologici. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., e Guyenet, P. G. (1989). Modulazione respiratoria centrale dei neuroni simpatico-eccitatori midollari nel ratto. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., e Masaoka, Y. (2008). Ritmi di respirazione ed emozioni. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). L’enigma delle onde di Mayer: fatti e modelli. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Relazioni tra tratto e parametri respiratori durante la respirazione tranquilla in soggetti normali. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998). Cambiamenti simultanei di organizzazione ritmica nei neuroni del tronco cerebrale, respirazione, sistema cardiovascolare e EEG tra 0.05 Hz e 0.5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). Modulazione respiratoria centrale di neuroni barosensibili nel midollo ventrolaterale caudale del ratto. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., e Kleinfeld, D. (2017). Entrainment di fluttuazioni vasomotorie arteriole da attività neurale è una base di sangue-ossigenazione livello-dipendente connettività “resting-state”. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Come la variabilità della frequenza cardiaca influenza le reti cerebrali di regolazione delle emozioni. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multibanda multislice GE-EPI a 7 Tesla, con 16 volte l’accelerazione utilizzando parziale imaging parallelo con l’applicazione di alta spaziale e temporale tutto il cervello fMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., e Murphy, F. (2015). Claustrofobia nella risonanza magnetica: una revisione sistematica. Radiografia 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Oscillazioni spontanee a bassa frequenza di emodinamica ccerebrale e il metabolismo negli adulti umani. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. Ritmi cardiovascolari nella banda 0.15-Hz: origine comune di fenomeni identici nell’uomo e nel cane nella formazione reticolare del tronco cerebrale? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). Sincronizzazione e desincronizzazione Event-related EEG/MEG: principi di base. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. Comunicazione cervello-cuore: prove per oscillazioni “pacemaker centrale” con una frequenza dominante a 0,1 Hz nel cingolo. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Sincronizzazione delle oscillazioni intrinseche a 0,1 Hz dipendenti dal livello di ossigeno nel sangue nell’amigdala e nella corteccia prefrontale in soggetti con aumento dell’ansia di stato. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., and Müller-Putz, G. R. (2013). Frequenza cardiaca vivace e cambiamenti EEG durante l’esecuzione e la ritenzione di cue-paced motore immagini piede. Fronte. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., e Pfurtscheller, G. (2018). “Switch-off” di aritmia sinusale respiratoria può verificarsi in una minoranza di soggetti durante la risonanza magnetica funzionale (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard e la connessione cuore-cervello: ulteriore elaborazione di un modello di integrazione neuroviscerale. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. Etichettatura anatomica automatizzata delle attivazioni in SPM usando una parcellizzazione anatomica macroscopica del cervello MNI MRI a soggetto singolo. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., e Hayano, J. (2004). Aritmia sinusale respiratoria: perché il battito cardiaco si sincronizza con il ritmo respiratorio? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Come il controllo del respiro può cambiare la tua vita: una revisione sistematica sui correlati psicofisiologici della respirazione lenta. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar