Introduzione
I neutrofili sono la popolazione più abbondante di globuli bianchi circolanti e la prima linea di difesa dell’ospite contro gli agenti patogeni invasori. In condizioni normali, i neutrofili circolanti hanno un’emivita di 6-12 ore e sono funzionalmente quiescenti. Durante l’infiammazione, i neutrofili arrivano rapidamente ai siti di infezione e di lesione, aumentano l’attività antimicrobica e muoiono all’interno del tessuto infiltrato. Essi svolgono un ruolo importante nel sistema immunitario innato, e significative risposte dei neutrofili sono osservate nell’infiammazione sistemica come il trauma, le ustioni, la sepsi e la chirurgia maggiore.
Tuttavia, la disregolazione delle risposte dei neutrofili come il rilascio eccessivo o incontrollato di citochine proinfiammatorie può causare danni ai tessuti o agli organi dell’ospite durante la sepsi grave e le malattie autoimmuni.
La terapia di rimozione dei leucociti (LRT), leucocitaferesi (LCAP), o aferesi di granulociti/monociti (GMA) è un metodo di aferesi terapeutica che rimuove i leucociti periferici tramite circolazione extracorporea. È stato usato come trattamento non farmacologico nella colite ulcerosa (UC) e nella malattia di Crohn (CD), e ha mostrato un’eccellente efficacia a breve termine.
LCAP utilizzando Cellsorba, una colonna di fibre di polietilene teleftalato (Asahi-Kasei Medical, Tokyo, Giappone), è stato riportato per rimuovere ~100% dei granulociti/monociti, ~60% dei linfociti, e ~50% delle piastrine da entrambi l’ingresso e l’uscita dell’apparecchio Cellsorba. Anche se i meccanismi esatti di LRT non sono stati completamente esplorati, sono stati riportati i loro potenziali meccanismi, che includono una riduzione del numero di leucociti attivati o citochine proinfiammatorie come il fattore di necrosi tumorale (TNF)-α, interleuchina (IL)-1β, IL-6 e IL-8.
L’infezione del sito chirurgico (SSI) rimane una delle cause più comuni di morbilità nella chirurgia maggiore, che prolunga l’ospedalizzazione e aumenta i costi medici. La sorveglianza multicentrica prospettica giapponese ha mostrato che il 19,5% dei pazienti con UC ha sviluppato SSI dopo l’intervento.
In uno studio caso-controllo, abbiamo confrontato retrospettivamente l’incidenza di SSI tra i pazienti sottoposti a proctocolectomia con anastomosi ileale pouch-anale (IPAA) (n=29) e quelli sottoposti a IPAA con LCAP postoperatoria (n=43). La LCAP postoperatoria ha ridotto significativamente le SSI nei pazienti UC sottoposti a proctocolectomia con IPAA (p<0,01). In uno studio prospettico multicentrico da noi condotto, l’incidenza di SSI è stata confrontata tra i pazienti UC sottoposti a chirurgia (gruppo di controllo; n=103) e quelli sottoposti a chirurgia con LCAP postoperatoria (n=40). Le SSI si sono verificate in 4 di 37 pazienti (10,8%) nel gruppo LCAP, mentre si sono verificate in 29 di 103 pazienti (28,2%) nel gruppo di controllo, anche se la differenza non ha raggiunto la significatività statistica (p=0,069).
Queste osservazioni cliniche suggeriscono che LCAP rimuove i leucociti attivati produttori di citochine proinfiammatorie nell’infiammazione sistemica postoperatoria dovuta alla chirurgia colorettale maggiore, e potrebbe sopprimere il verificarsi di SSI. Abbiamo riportato un’associazione tra disfunzione dei neutrofili e complicazioni infettive postoperatorie.
I neutrofili sono le cellule più abbondanti tra i leucociti circolanti e possono essere i più frequentemente rimossi dalla LCAP. Così, ci siamo concentrati sulle funzioni dei neutrofili circolanti isolati prima e dopo la LCAP, per chiarire i meccanismi terapeutici della LCAP postoperatoria sul verificarsi di SSI in pazienti UC dopo l’intervento chirurgico.
Materiali e metodo
Pazienti
Tre pazienti con UC sottoposti a IPAA hanno ricevuto la LCAP postoperatoria presso il Dipartimento di Chirurgia Gastrointestinale e Pediatrica della Mie University Graduate School of Medicine dal 2004 al 2008. La diagnosi di UC si è basata sui dati clinici, radiografici, endoscopici, chirurgici e istopatologici. Prima dell’intervento chirurgico, i pazienti hanno ricevuto vari trattamenti medici tra cui farmaci anti-infiammatori (aminosalicilati, corticosteroidi) o farmaci immunosoppressori (azatioprina, mercaptopurina, ciclosporina), o entrambi. Il LCAP postoperatorio è stato eseguito una volta entro 2 ore dall’intervento. I pazienti con sintomi clinici di sepsi sono stati esclusi dallo studio. Anche i pazienti con emodinamica instabile dopo l’intervento sono stati esclusi secondo il protocollo. Il consenso informato scritto è stato ottenuto da tutti i pazienti prima dell’inizio di questo studio, che è stato eseguito in conformità con la Dichiarazione di Helsinki ed è stato approvato dall’Institutional Review Board (n. 474).
Isolamento dei neutrofili
I neutrofili pre e post-LCAP sono stati isolati dagli stessi pazienti prima e dopo l’intervento. L’isolamento dei neutrofili si è basato su una procedura precedentemente descritta. I campioni di sangue (10 ml) sono stati diluiti con un volume uguale di fosfato-buffered salina (PBS), stratificato su un volume di Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canada) e centrifugato a 600 × g per 30 min a temperatura ambiente. Dopo la rimozione delle cellule mononucleari, del plasma e del Ficoll-Paque PLUS, il pellet è stato risospeso in 12 mL di soluzione di cloruro di ammonio per lisciare i globuli rossi, lavato due volte in PBS e risospeso in PBS. I neutrofili sono stati lavati due volte con PBS e risospesi in TCM-10 . Le preparazioni cellulari sono state testate per la vitalità (>99%) mediante esclusione del blu di tripan e per la purezza (>95% granulociti CD13+, CD33+) mediante citometria a flusso.
Attività fagocitica
L’attività fagocitica ex vivo dei neutrofili circolanti contro Escherichia coli è stata confrontata tra neutrofili pre e post-LCAP isolati da pazienti identici.
La fagocitosi dei neutrofili è stata misurata usando bioparticelle fluorescenti. Per opsonizzare le bioparticelle batteriche, il reagente opsonizzante ricostituito e le bioparticelle batteriche (5 × 105) sono stati mescolati, vortexati e incubati per 1 ora a 37°C in un incubatore umidificato al 5% di CO2. Dopo due lavaggi con PBS, separati da centrifugazione a bassa velocità (1500 × g, 15 min, 4°C), il pellet è stato incubato con neutrofili (5 × 105) in 1 mL di terreno senza antibiotici per 3 ore a 37°C in un incubatore umidificato al 5% di CO2. Dopo 3 ore di incubazione, l’attività fagocitaria dei neutrofili contro E. coli è stata analizzata utilizzando un FACScan (Becton-Dickinson, San Jose, CA, USA) e sono stati contati 10.000 eventi per campione.
Preparazione di E. coli
Escherichia coli (ATCC25922) è stato acquistato dalla American Type Culture Collection (Manassas, VA, USA), e coltivato in Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokyo, Giappone) per 10 ore a 37°C. Il mezzo di coltura è stato centrifugato a 1.700 × g per 10 minuti a temperatura ambiente per ottenere un pellet, che è stato lavato due volte e risospeso in soluzione fisiologica normale sterile. Un’aliquota (100 μL) della sospensione è stata diluita in serie con soluzione salina sterile, piastrata su Agar-B (Qbiogene, Carlsbad, CA, USA) e incubata per 18 ore per determinare la concentrazione batterica. Il resto è stato conservato a -80°C fino all’uso.
Co-cultura di neutrofili con E. coli
Poco prima dell’uso, la sospensione di E. coli è stata diluita in mezzo per raggiungere una concentrazione finale di 2,5 × 106 ufc/mL. Dopo l’opsonizzazione di E. coli con siero autologo per 30 minuti a 37°C, i neutrofili (2,5 × 105 /mL) sono stati coculturati in 1 mL di terreno senza antibiotici per 3 ore a 37°C in un incubatore umidificato al 5% di CO2. Dopo la centrifugazione delle cellule a 600 × g per 10 min a 4°C, i surnatanti sono stati raccolti per analizzare la produzione di citochine, l’elastasi neutrofila (NE) e la vitalità dei neutrofili.
Vitabilità dei neutrofili
La vitalità ex vivo dei neutrofili circolanti contro E. coli è stata confrontata tra neutrofili pre e post-LCAP isolati da pazienti identici. Per valutare la vitalità dei neutrofili dopo la co-cultura con E. coli, è stato eseguito un test di apoptosi.
L’apoptosi dei neutrofili dopo la co-cultura con E. coli è stata quantificata mediante citometria a flusso utilizzando un kit di rilevamento dell’apoptosi Annexin V (BioVision Research Products, Palo Alto, CA, USA). I neutrofili sono stati incubati in un tampone legante 1X a cui sono stati aggiunti 5 μL di Annexin V-fluoresceina isotiocianato (FITC) e 5 μL di ioduro di propidio (PI). Dopo l’incubazione a temperatura ambiente per 5 minuti al buio, le cellule sono state analizzate utilizzando un FACScan e sono stati contati 10.000 eventi per campione.
La combinazione di Annexin V-FITC e PI è stata in grado di distinguere tra cellule apoptotiche precoci (Annexin V+, PI-), cellule necrotiche (Annexin V-, PI+), cellule apoptotiche tardive o necrotiche secondarie (Annexin V+, PI+), e cellule vitali (Annexin V-, PI-).
Saggio di immunoassorbimento enzimatico (ELISA)
Le citochine nel siero dei pazienti prima e dopo il LCAP e i surnatanti dopo la co-cultura di neutrofili pre e post-LCAP con E. coli sono stati misurati tramite ELISA secondo le istruzioni del produttore. Le citochine includevano TNF-α, antagonista del recettore IL-1 (IL-1Ra), IL-6, IL-8 e NE. I kit ELISA per TNF-α, IL-1Ra, IL-6 e IL-8 sono stati acquistati da R&D Systems (Minneapolis, MN, USA). Il kit ELISA NE è stato acquistato da Immundiagnostik (Bensheim, Germania). I limiti di rilevamento di TNF-α, IL-1Ra, IL-6, IL-8, e NE erano rispettivamente 1, 2, 0,01, e 2 pg/mL e 0,12 ng/mL, e i livelli al di sotto di questi limiti sono stati considerati non rilevabili. Il livello di ogni citochina è stato valutato in duplicato e il valore medio della citochina è stato calcolato.
Analisi statistica
Tutte le analisi statistiche sono state fatte usando JMP versione 5 (SAS Institute, Cary, NC, USA). Le associazioni tra variabili continue e categoriche sono state valutate utilizzando il test U di Mann-Whitney o il test T accoppiato quando appropriato. P<0.05 è stato considerato statisticamente significativo.
Risultati
Caratteristiche dei pazienti
Ventinove pazienti UC sottoposti a IPAA hanno ricevuto LCAP post-operatorio. Le caratteristiche dei pazienti sono mostrate nella tabella 1. L’età media alla diagnosi era di 27 anni (range 15-54 anni) e l’età media alla chirurgia era di 33 anni (range 16-61 anni). La durata della malattia era di 6,9 anni (range 0,1-28 anni). La colite sinistra era in 6/29 (21%) pazienti e la pan-colite in 23/29 (79%) pazienti. La gravità della malattia della colite è stata classificata come lieve (7; 24%), moderata (11; 38%), e grave (4; 38%).
| Caratteristiche dei pazienti | |
|---|---|
| Variabili | Pazienti (n=29) Numero |
| Gender | |
| Maschio | 19 |
| Femmina | 10 |
| Età alla diagnosi | 27( 15-54) |
| Età alla chirurgia | 33(16-61) |
| Durata della malattia | 6.9 (0.1-28) |
| Gravità della malattia | |
| Lieve | 7 |
| Moderata | 11 |
| grave | 4 |
| Estensione della malattia | |
| Colite sinistracolite laterale sinistra | 6 |
| Pan- colite | 23 |
| Sistema di classificazione dei malti | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Dose totale di steroidi (mg) | 17285 (800-70000) |
| Uso di immunosoppressori | |
| Sì | 5 |
| No | 24 |
| Tempo di funzionamento (min) | 262.4 (118-496) |
| Perdita di sangue (ml) | 307,9 (17-826) |
Tabella 1: Caratteristiche dei pazienti.
Variazione temporale della conta di WBC, neutrofili e piastrine
WBC, neutrofili e piastrine sono stati contati prima dell’intervento, prima della LCAP (dopo l’intervento) e dopo la LCAP (entro 12 ore dalla LCAP), rispettivamente. Come mostrato nella Figura 1, la conta dei WBC, dei neutrofili e delle piastrine era significativamente più bassa dopo la LCAP che prima della LCAP. Tutti i pazienti che hanno ricevuto LCAP postoperatorio non ha avuto alcun effetto avverso ematologico.
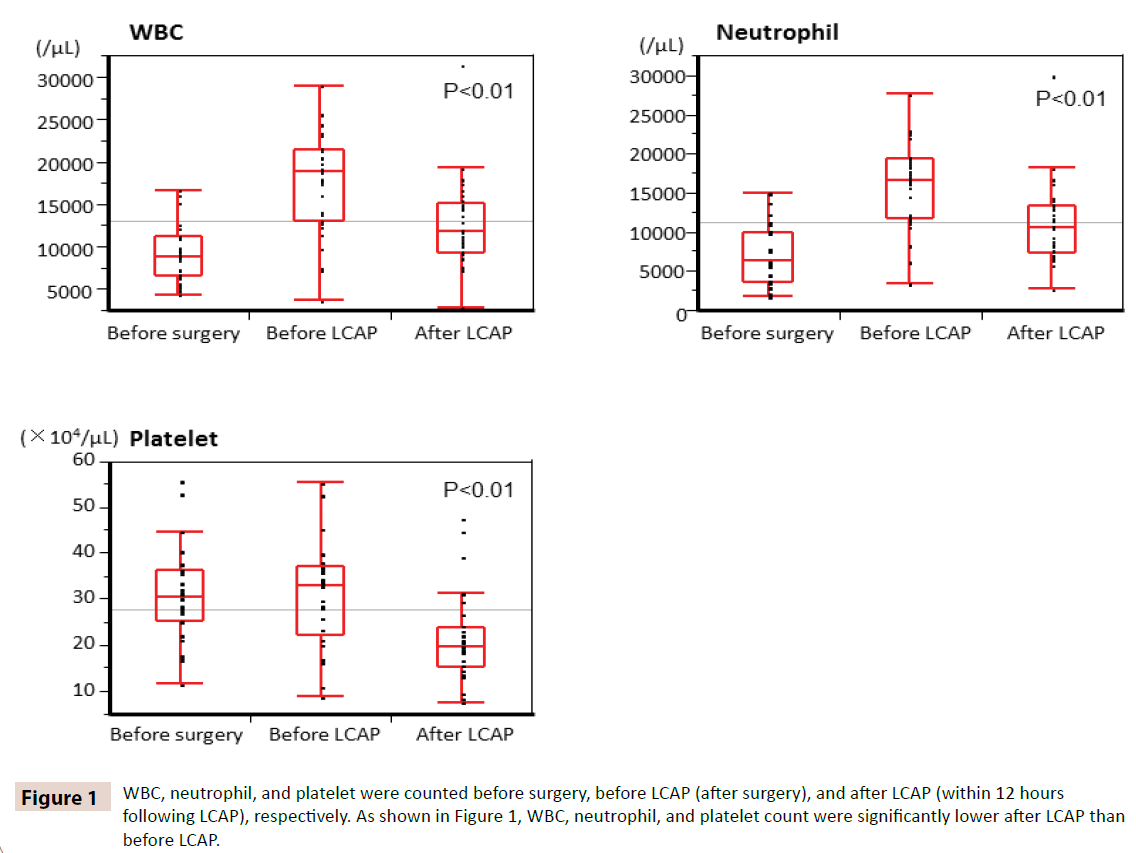
Figura 1: WBC, neutrofili e piastrine sono stati contati prima della chirurgia, prima di LCAP (dopo l’intervento), e dopo LCAP (entro 12 ore dopo LCAP), rispettivamente. Come mostrato nella Figura 1, WBC, neutrofili e piastrine sono stati significativamente più bassi dopo LCAP rispetto a prima LCAP.
Attività fagocitica dei neutrofili contro E. coli
Per chiarire se LCAP influenza l’attività fagocitica dei neutrofili circolanti, attività fagocitica contro E. coli è stato confrontato tra neutrofili pre- e post-LCAP. Come mostrato nella Figura 2, nessuna differenza significativa nell’attività fagocitica dei neutrofili (intensità fluorescente media) contro E. coli è stata osservata tra pre-LCAP (mediana 1259.4, range 50.8-3505.6) e post- LCAP (mediana 1077.6, range 24.4-4152.1) neutrofili (P=0.72). Questi risultati suggeriscono che LCAP non influenza l’attività fagocitaria dei neutrofili circolanti contro E. coli.
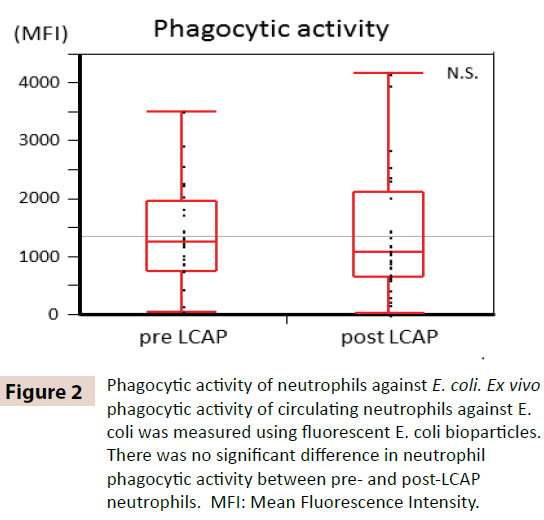
Figura 2: Attività fagocitaria dei neutrofili contro E. coli. L’attività fagocitica ex vivo dei neutrofili circolanti contro E. coli è stata misurata usando bioparticelle fluorescenti di E. coli. Non c’è stata alcuna differenza significativa nell’attività fagocitica dei neutrofili tra i neutrofili pre e post-LCAP. MFI: Mean Fluorescence Intensity.
Vitabilità dei neutrofili dopo la co-cultura con E. coli
Per chiarire se LCAP influenza la risposta dei neutrofili contro le infezioni batteriche, la vitalità dei neutrofili contro E. coli è stata confrontata tra i neutrofili pre- e post-LCAP. Le percentuali di cellule vitali (Annexin V-, PI-), cellule apoptotiche precoci (Annexin V+, PI-), cellule necrotiche (Annexin V-, PI+), e cellule apoptotiche tardive o necrotiche secondarie (Annexin V+, PI+) sono state confrontate tra neutrofili pre- e post-LCAP. Come mostrato nella Figura 3, la percentuale mediana di neutrofili vitali coculturati con E. coli era più alta in post-LCAP (mediana 34.2%, range 1.16- 77.7%) che in pre-LCAP (mediana 27.9%, range 0.53-89.7%) neutrofili, anche se la differenza non ha raggiunto la significatività statistica (P=0.82). La percentuale di neutrofili necrotici in co-cultura con E. coli era significativamente diminuita nei neutrofili post-LCAP (mediana 0,73%, range 0,0-26,0%) rispetto ai neutrofili pre-LCAP (mediana 1,14%, range 0,0-26,0%) (P=0,0232).
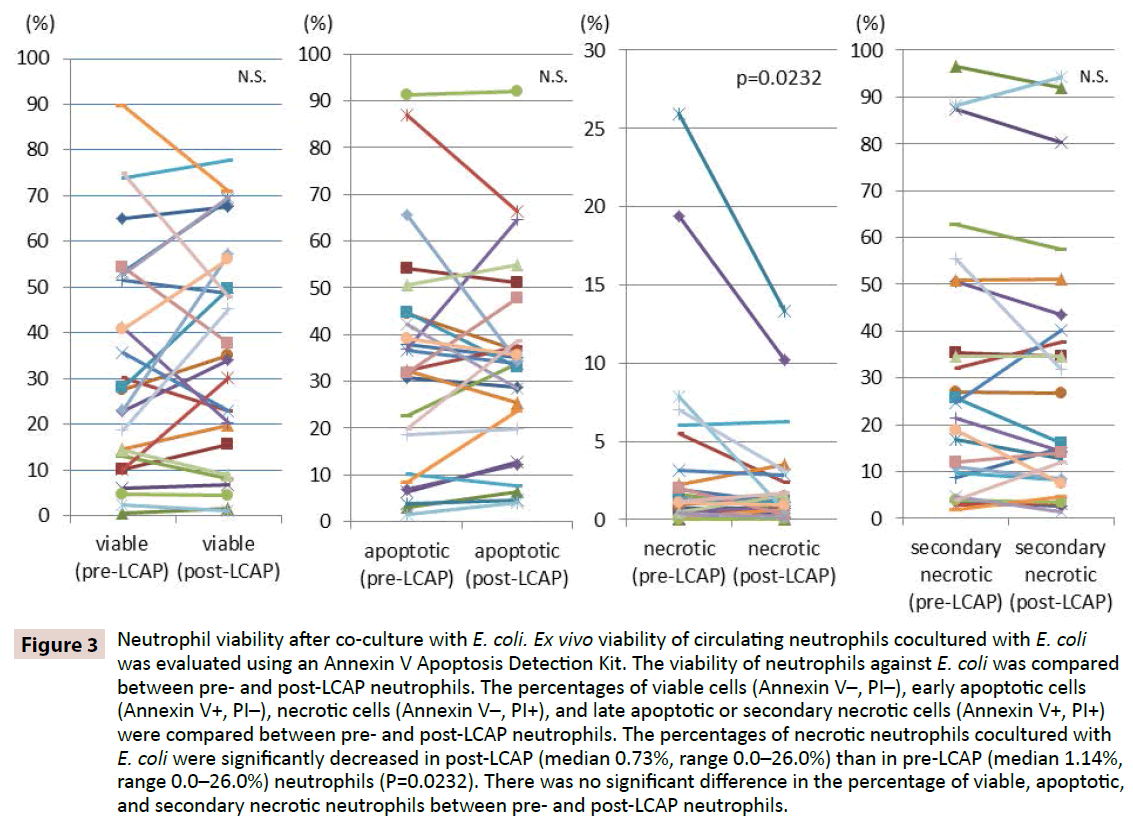
Figura 3: vitalità dei neutrofili dopo co-cultura con E. coli. La vitalità ex vivo dei neutrofili circolanti coculturati con E. coli è stata valutata utilizzando un kit di rilevazione dell’apoptosi Annexin V. La vitalità dei neutrofili contro E. coli è stata confrontata tra neutrofili pre- e post-LCAP. Le percentuali di cellule vitali (Annexin V-, PI-), cellule apoptotiche precoci (Annexin V+, PI-), cellule necrotiche (Annexin V-, PI+), e cellule apoptotiche tardive o necrotiche secondarie (Annexin V+, PI+) sono state confrontate tra neutrofili pre- e post-LCAP. Le percentuali di neutrofili necrotici coculturati con E. coli erano significativamente diminuite nei neutrofili post-LCAP (mediana 0,73%, range 0,0-26,0%) rispetto a quelli pre-LCAP (mediana 1,14%, range 0,0-26,0%) (P=0,0232). Non c’era alcuna differenza significativa nella percentuale di neutrofili vitali, apoptotici e necrotici secondari tra i neutrofili pre e post-LCAP.
Nessuna differenza significativa nella percentuale di neutrofili apoptotici coculturati con E. coli è stata osservata tra neutrofili pre- LCAP (mediana 32,3%, range 1,51-91,2%) e post-LCAP (mediana 33,8%, range 4,0-92,1%) (P=0,57). Nessuna differenza significativa nella percentuale di neutrofili apoptotici tardivi o necrotici secondari coculturati con E. coli è stata osservata anche tra i neutrofili pre- LCAP (mediana 23.1%, range 1.81-96.5%) e post- LCAP (mediana 16.1%, range 1.44-94.3%) (P=0.13).
Questi risultati suggeriscono che LCAP può diminuire il sottoinsieme distinto di neutrofili circolanti che inducono la necrosi contro l’infezione batterica, e aumentare il numero di neutrofili vitali (probabilmente non adescati) nella circolazione sistemica.
Produzione di citochine da parte dei neutrofili dopo la co-cultura con E. coli
Per chiarire se LCAP influenza la produzione di citochine da parte dei neutrofili circolanti, i livelli di citochine nei surnatanti di cultura dopo la co-cultura con E. coli sono stati confrontati tra neutrofili pre- e post- LCAP. Come mostrato nella Figura 4, non c’è stata alcuna differenza significativa nei livelli di NE, TNF-α, IL-6, IL-8 e IL-1Ra nei surnatanti di coltura tra i neutrofili pre e post LCAP. Questi risultati suggeriscono che LCAP non influenza la produzione di citochine di neutrofili circolanti contro E. coli.
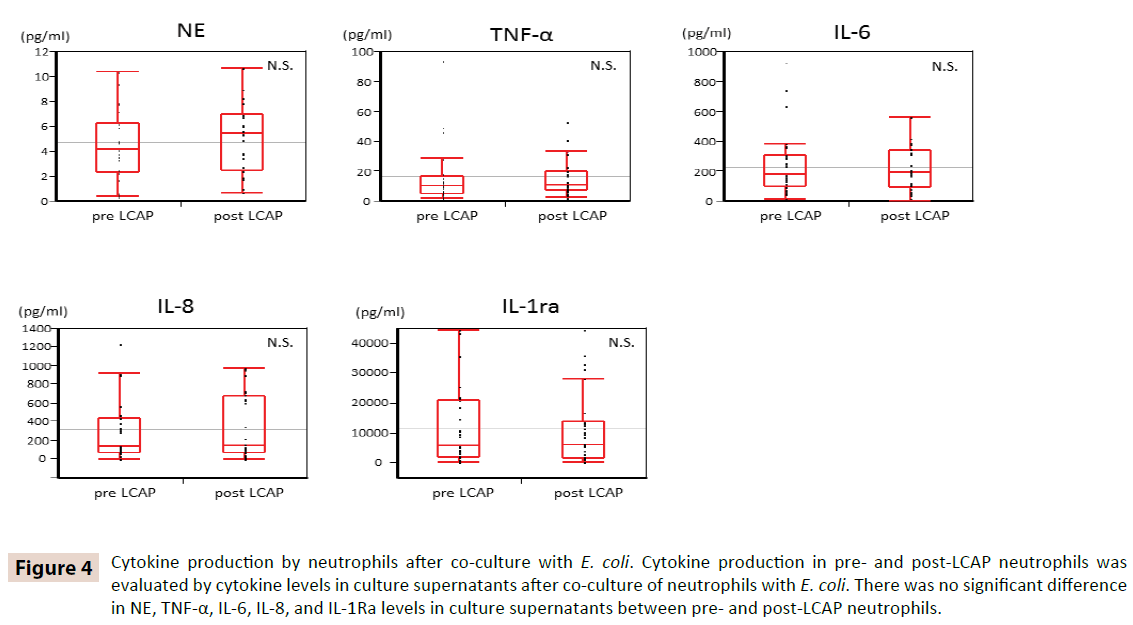
Figura 4: Produzione di citochine da neutrofili dopo co-cultura con E. coli. La produzione di citochine nei neutrofili pre e post-LCAP è stata valutata dai livelli di citochine nei surnatanti di coltura dopo la co-cultura dei neutrofili con E. coli. Non c’era alcuna differenza significativa nei livelli di NE, TNF-α, IL-6, IL-8, e IL-1Ra nei surnatanti della cultura tra i neutrofili pre- e post-LCAP.
Citochine del siero prima e dopo LCAP
Per chiarire se LCAP influenza la risposta infiammatoria sistemica dell’ospite, le citochine del siero sono state misurate utilizzando campioni di sangue presi prima e dopo LCAP. Come mostrato nella Figura 5, il siero NE dopo LCAP (mediana 5.62 pg/mL, range 0.16-10.4 pg/mL) era significativamente più alto di quello prima di LCAP (mediana 2.87 pg/mL, range 0.15-7.61 pg/mL) (P=0.0251). Nessuna differenza significativa è stata trovata nei livelli sierici di TNF-α, IL-6, IL-8, e IL-1Ra prima e dopo LCAP.
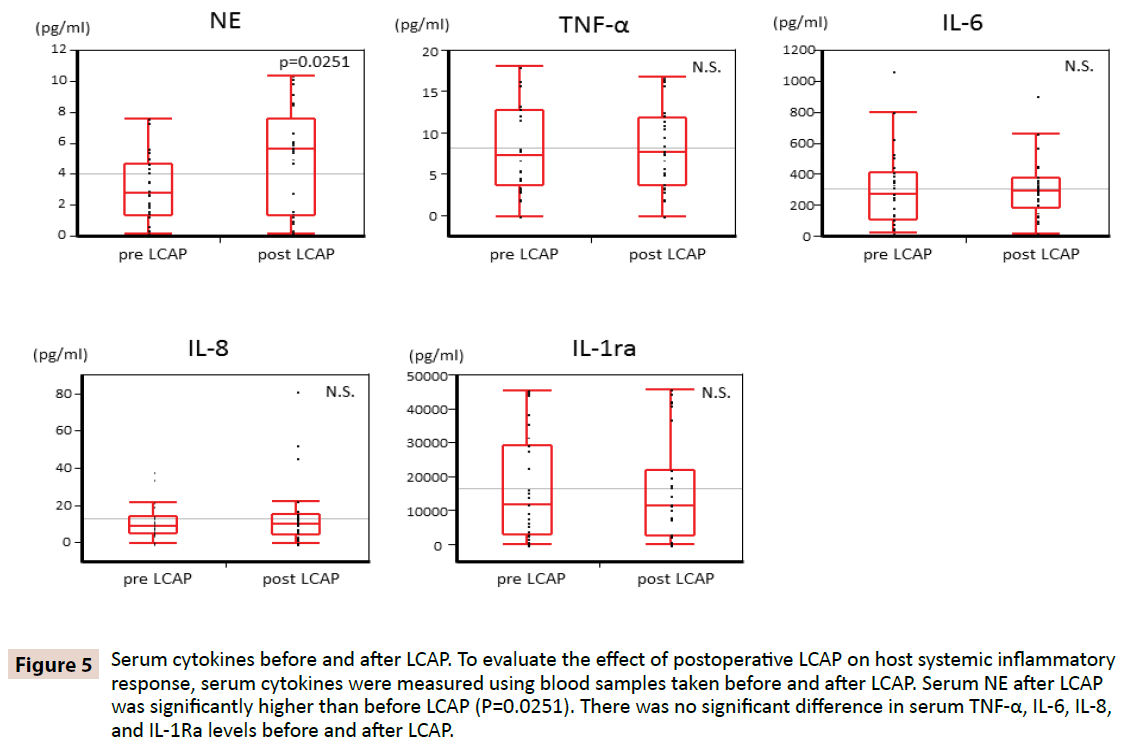
Figura 5: Citochine sieriche prima e dopo LCAP. Per valutare l’effetto della LCAP postoperatoria sulla risposta infiammatoria sistemica dell’ospite, le citochine sieriche sono state misurate utilizzando campioni di sangue prelevati prima e dopo la LCAP. Il NE sierico dopo la LCAP era significativamente più alto rispetto a prima della LCAP (P=0,0251). Non c’era alcuna differenza significativa nei livelli sierici di TNF-α, IL-6, IL-8 e IL-1Ra prima e dopo la LCAP.
Associazioni delle funzioni dei neutrofili post-LCAP con il tempo operatorio o la conta dei neutrofili postoperatoria
Per chiarire se le funzioni dei neutrofili circolanti dopo la LCAP influenzano il verificarsi di SSI, abbiamo esaminato l’associazione tra l’attività fagocitica o la produzione di citochine dei neutrofili post-LCAP e i fattori di rischio delle SSI legati allo stress chirurgico, come il tempo operatorio, la perdita di sangue e la conta dei neutrofili postoperatoria.
Come mostrato nella Figura 6, NE nei surnatanti dopo la co-cultura dei neutrofili post-LCAP con E. coli era significativamente più alto nei pazienti con tempo operativo >3 h (mediana 5,65 pg/mL, range 0,97-10.7 pg/mL) rispetto a quelli con tempo operatorio <3 h (mediana 1,05 pg/mL, range 0,72-2,44 pg/mL) (P=0,0158).
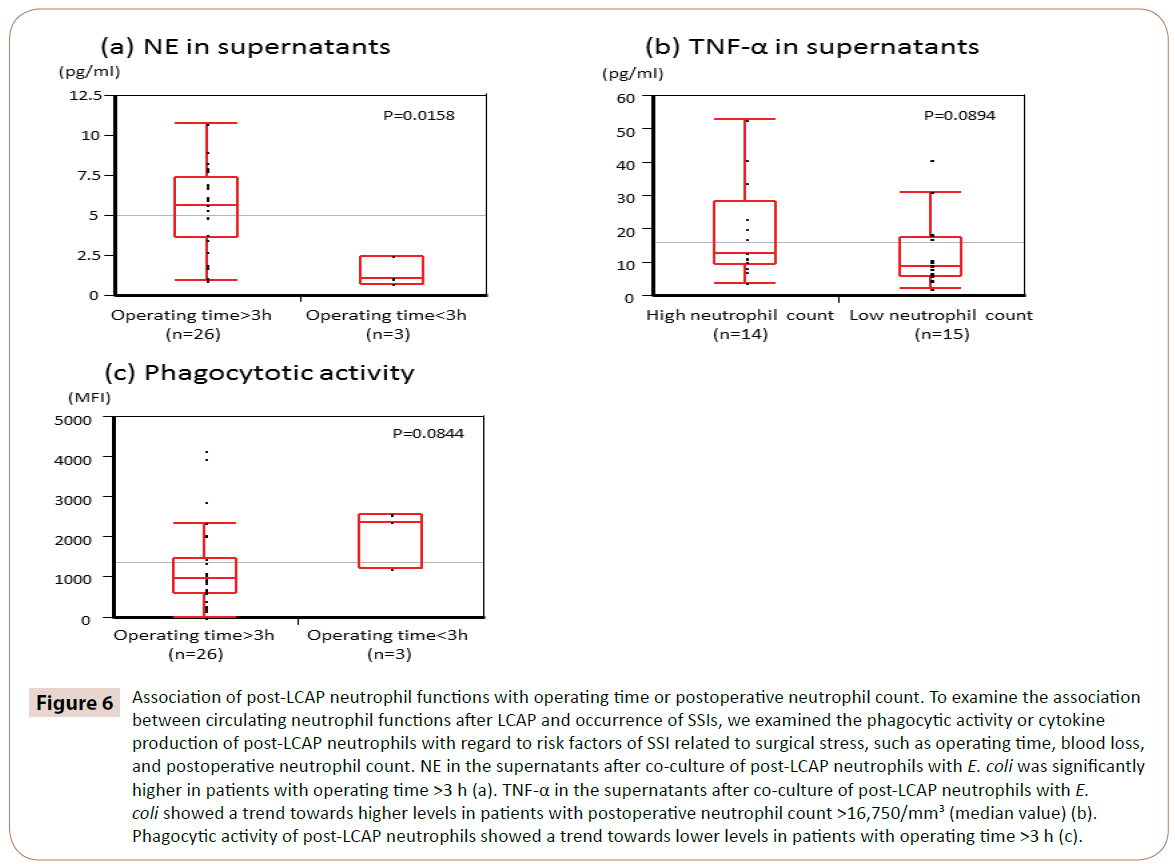
Figura 6: Associazione delle funzioni dei neutrofili post-LCAP con il tempo operatorio o la conta post-operatoria dei neutrofili. Per esaminare l’associazione tra le funzioni dei neutrofili circolanti dopo il LCAP e il verificarsi di SSI, abbiamo esaminato l’attività fagocitica o la produzione di citochine dei neutrofili post-LCAP in relazione ai fattori di rischio di SSI legati allo stress chirurgico, come il tempo operatorio, la perdita di sangue e la conta dei neutrofili postoperatoria. NE nei surnatanti dopo la co-cultura dei neutrofili post-LCAP con E. coli era significativamente più alto nei pazienti con tempo operativo >3 h (a). Il TNF-α nei surnatanti dopo la co-cultura di neutrofili post-LCAP con E. coli ha mostrato una tendenza verso livelli più alti nei pazienti con conta dei neutrofili postoperatoria >16.750/mm3 (valore mediano) (b). L’attività fagocitica dei neutrofili post-LCAP ha mostrato una tendenza verso livelli più bassi nei pazienti con tempo operatorio >3 h (c).
TNF-α nei surnatanti dopo la co-cultura dei neutrofili post-LCAP con E. coli ha mostrato una tendenza verso livelli più alti nei pazienti con conta dei neutrofili post-LCAP >16.750/mm3 (valore mediano) (b). coli ha mostrato una tendenza verso livelli più alti nei pazienti con conta dei neutrofili postoperatoria >16.750/mm3 (valore mediano) (P=0,0894).
L’attività fagocitaria dei neutrofili post-LCAP contro E. coli ha mostrato una tendenza verso livelli più bassi nei pazienti con tempo operativo >3 h (P=0,0844).
Associazione tra TNF-α sierico dopo LCAP e SSI
Per chiarire se la risposta infiammatoria sistemica dell’ospite dopo LCAP influenza la comparsa di SSI, abbiamo esaminato l’associazione tra i livelli di citochine sieriche dopo LCAP e la comparsa di SSI.
Come mostrato nella Figura 7, il TNF-α sierico dopo la LCAP ha mostrato una tendenza verso livelli più alti nei pazienti che hanno sviluppato SSI rispetto a quelli che non l’hanno fatto (P=0,0714).
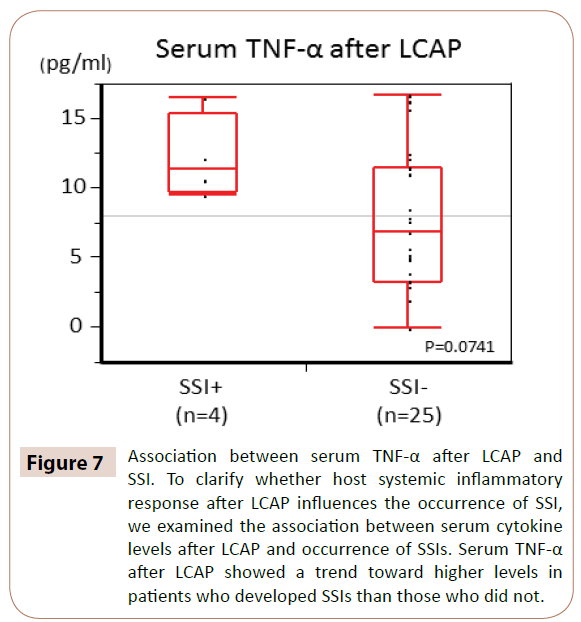
Figura 7: Associazione tra TNF-α sierico dopo LCAP e SSI. Per chiarire se la risposta infiammatoria sistemica dell’ospite dopo la LCAP influenza il verificarsi di SSI, abbiamo esaminato l’associazione tra i livelli di citochine nel siero dopo la LCAP e il verificarsi di SSI. Il TNF-α sierico dopo la LCAP ha mostrato una tendenza verso livelli più alti nei pazienti che hanno sviluppato SSI rispetto a quelli che non l’hanno fatto.
Non c’era alcuna differenza significativa tra i livelli sierici di IL-6, IL-8 e IL-1Ra dopo la LCAP e il verificarsi di SSI.
Discussione
Sono stati riportati diversi possibili meccanismi di azione della LCAP o GMA, sebbene i loro meccanismi esatti non siano stati completamente studiati. La variabilità dei risultati sembra dipendere dalle differenze nelle cellule del sangue utilizzate per le analisi (granulociti, monociti o linfociti), dai metodi di campionamento del sangue (prelevato dalla linea di ingresso o di uscita o dalla vena periferica) e dai soggetti dello studio (volontari sani o pazienti malati).
La maggior parte dei ricercatori ha utilizzato leucociti come neutrofili, monociti o linfociti prelevati dalle linee di ingresso e uscita di un dispositivo di circolazione extracorporea. I leucociti dalle linee di uscita sono le cellule rimanenti filtrate dal LCAP. Essi vengono rimessi immediatamente nella circolazione sistemica dei pazienti e rimescolati con i leucociti circolanti. I leucociti dalle linee di uscita sono la piccola percentuale di tutti i leucociti circolanti dopo LCAP. Per chiarire l’effetto sistemico della LCAP sul sistema immunitario dell’ospite, abbiamo usato neutrofili circolanti isolati da vene periferiche di pazienti UC.
In senso stretto, la leucocitoterapia (LCAP) dovrebbe essere definita come leucocitafiltrazione perché non solo può rimuovere i leucociti ma anche attivarli attraverso il filtro. Infatti, la LCAP non può assorbire e rimuovere tutte le cellule del sangue che vi sono entrate. Un certo numero di cellule del sangue può passare attraverso il filtro e poi tornare in circolazione. Si pensa che le cellule del sangue filtrate siano attivate dalla filtrazione di LCAP.
I neutrofili sono la popolazione più abbondante di leucociti e le cellule rimosse più efficacemente da LCAP. Il numero stimato di leucociti filtrati è quasi 1,1 × 1010 cellule per singola sessione LCAP, che potrebbe essere paragonabile alla rimozione di quasi la metà del numero di neutrofili circolanti (2 × 10-3 × 1010 cellule). Così, abbiamo studiato la differenza funzionale tra pre-LCAP e post-LCAP neutrofili per quanto riguarda la risposta a E. coli per chiarire i potenziali meccanismi di osservazione clinica che LCAP postoperatorio ridotto incidenza SSI. Tuttavia, la LCAP con Cellsorba può rimuovere e attivare non solo i neutrofili, ma anche le altre cellule del sangue (monociti, linfociti e piastrine) con diversa efficacia di rimozione. Pertanto, è necessario indagare il cambiamento della risposta a E. coli su non solo neutrofili, ma anche le altre cellule del sangue tra pre e post-LCAP, anche se non sono stati valutati in questo studio.
Uno dei risultati più significativi del presente studio è stato il fatto che la percentuale di neutrofili necrotici era significativamente ridotto quando post-LCAP neutrofili sono stati co-culturati con E. coli, rispetto ai neutrofili pre-LCAP. Questa osservazione suggerisce che LCAP diminuisce la percentuale di neutrofili che inducono alla necrosi da E. coli, e aumenta la percentuale di neutrofili vitali (probabilmente non adescati) nella circolazione sistemica.
È stata osservata un’ampia variazione della percentuale di vitalità dei neutrofili, apoptosi o necrosi in co-coltura con E. coli. Nei nostri recenti dati non pubblicati, la percentuale di apoptosi precoce (Annexin V+, PI-) nei neutrofili circolanti variava ampiamente da circa il 10% al 90% nei pazienti con infiammazione sistemica come la proteina C-reattiva elevata >0,3 mg/L. Queste osservazioni suggeriscono che i neutrofili possono essere già apoptotici senza cocoltura di E. coli a causa di insulti chirurgici più elevati.
La necrosi è pensata per essere la morte cellulare incontrollata, e sembra rilasciare specie tossiche dell’ossigeno ed enzimi proteolitici inaspettatamente . La necrosi dei neutrofili è nota per essere la causa primaria del danno alle vie aeree e ai polmoni nei polmoni intensamente infiammati dei pazienti con fibrosi cistica. Postoperatorio LCAP può indurre il reclutamento di un sottoinsieme di neutrofili che è resistente alla morte cellulare necrotica inaspettata o incontrollata contro l’infezione batterica nella circolazione sistemica, oltre alla rimozione dei leucociti attivati che causano l’infiammazione sistemica.
In contrasto con i risultati di cui sopra di esperimenti ex vivo, siero NE dopo LCAP era significativamente aumentato. La riduzione immediata di siero NE da LCAP non è stata osservata. Una possibile spiegazione di ciò è che una singola sessione di LCAP potrebbe non sopprimere sufficientemente il rilascio di NE dai neutrofili del corpo intero nell’infiammazione sistemica indotta dalla chirurgia
I neutrofili circolanti dopo la LCAP isolati da pazienti con un tempo operativo più lungo (>3 h) o un numero più alto di neutrofili postoperatori (>16.750/mm3; valore mediano) hanno mostrato non solo una maggiore attività di produzione di NE o TNF-α, ma anche una minore attività fagocitica contro E. coli. Questi risultati suggeriscono che i neutrofili isolati da pazienti con elevato stress chirurgico mostrano un’eccessiva produzione di citochine pro-infiammatorie o un’attività fagocitaria compromessa, anche dopo il rinnovamento dei neutrofili tramite LCAP postoperatorio.
Tra i 29 pazienti UC con LCAP postoperatorio, solo quattro pazienti (13,8%) hanno sviluppato SSI. Il loro TNF-α sierico dopo LCAP era più alto di quelli senza SSI, anche se la differenza non ha raggiunto la significatività statistica. Pertanto, il TNF-α sierico può essere utile per identificare i pazienti che svilupperanno SSI dopo il LCAP postoperatorio. Tuttavia, non è stata osservata alcuna associazione tra lo sviluppo di SSI e la vitalità dei neutrofili, l’apoptosi o la necrosi in co-coltura con E. coli, il che può essere in parte dovuto alla piccola dimensione del campione.
Di recente, i neutrofili circolanti sono stati riconosciuti come una popolazione funzionalmente eterogenea e differentemente adescata contro vari insulti. Abbiamo riportato il significato clinico dei neutrofili circolanti nell’infiammazione sistemica. Pensiamo che i neutrofili circolanti possono essere l’obiettivo primario per esplorare l’effetto sistemico di LCAP sul sistema immunitario dell’ospite.
Inoltre, alcuni ricercatori hanno riferito che la leucodepletione, che rimuove le cellule polimorfonucleate dalla circolazione sistemica utilizzando filtri leucocitari, porta a un miglioramento significativo della funzione polmonare e renale dei pazienti che sviluppano la sindrome da risposta infiammatoria sistemica (SIRS) dopo bypass cardiopolmonare. Leukodepletion targeting dei neutrofili può essere utile per prevenire l’insufficienza d’organo a causa di SIRS.
In conclusione, questo è ritenuto il primo rapporto che dimostra che LCAP postoperatorio diminuisce il sottoinsieme di neutrofili circolanti che inducono la necrosi contro l’infezione batterica. Può essere utile per la prevenzione di SSI ridurre la morte necrotica cellulare inaspettata o incontrollata causata dal rilascio di sostanze tossiche o proteolitiche nella circolazione sistemica.
Riconoscimenti
Gli autori ringraziano Motoko Ueeda e Chihiro Hibi per l’eccellente assistenza tecnica.
Contributo dell’autore
K.T, T.A., e M.K. hanno progettato ed eseguito gli esperimenti, analizzato e interpretato i dati e scritto il manoscritto. S.Y., Y.O., e S.K. hanno eseguito gli esperimenti e analizzato i dati. Y.T., M.I., M.O., M.K., Y.I., K.U., e Y.M. hanno progettato gli esperimenti e analizzato e interpretato i dati. C.M. e M.K. hanno progettato gli esperimenti e interpretato i dati.
Sostegno e divulgazione di accordi finanziari
Questo lavoro è stato sostenuto in parte da sovvenzioni del Ministero dell’Istruzione, della Cultura, dello Sport, della Scienza e della Tecnologia del Giappone (KAKENHI 23791523 a S.Y., 25861181 a Y.O., e 24791887 a M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Cinetica dei neutrofili in salute e malattia. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Vivere e morire per infiammazione: neutrofili, eosinofili, basofili. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrofili nell’immunità innata e adattativa. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Disfunzione dei neutrofili circolanti nell’insufficienza epatica acuta. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Stato attuale e prospettive future della leucocitoterapia per le malattie infiammatorie intestinali. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Fattori che influenzano gli effetti a breve e lungo termine della terapia di rimozione dei leucociti nella colite ulcerosa attiva. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Valutazione della leucocitoterapia di filtrazione da utilizzare nel trattamento di pazienti con artrite reumatoide. Rheumatology (Oxford) 39:165-171.
- Shirokaze J (2002) Leucocitoterapia utilizzando un filtro di rimozione dei leucociti. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) Un nuovo paradigma nella colite ulcerosa: cellule T regolatorie sono fattore chiave che induce/esacerba UC attraverso uno squilibrio immunitario. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Effetti immunomodulatori dell’aferesi di assorbimento di granulociti e monociti come trattamento per i pazienti con colite ulcerosa. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) Valutazione in vitro e in vivo di Adacolumncytapheresis in soggetti sani. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)Una revisione sistematica dei fattori di rischio associati alle infezioni del sito chirurgico tra i pazienti chirurgici. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Fattori di rischio per le infezioni del sito chirurgico in pazienti giapponesi con colite ulcerosa: uno studio prospettico multicentrico. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Applicazione postoperatoria precoce di aferesi extracorporea di leucociti in pazienti con colite ulcerosa: risultati di uno studio pilota per prevenire complicazioni settiche postoperatorie. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Efficacia della leucocitoterapia nel sopprimere l’insorgenza di infezioni del sito chirurgico dopo un intervento per la colite ulcerosa. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K, et al. (2006) Neutrophil priming come fattore di rischio legato alla chirurgia per le complicazioni infettive postoperatorie in pazienti con colite ulcerosa. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Fattori che predicono complicazioni infettive postoperatorie e induzione precoce di mediatori infiammatori in pazienti con colite ulcerosa. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Disturbo immunoinflammatorio legato ai neutrofili in pazienti con colite ulcerosa sovradosati di steroidi. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S, Otake K, Araki T, et al. (2011) disfunzione dei neutrofili in pazienti con colite ulcerosa sovradosati di steroidi: potenziale rilevanza del fattore inibitorio della migrazione dei macrofagi per aumentare la morbilità post-operatoria. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classificazione della morte cellulare: raccomandazioni del Comitato di nomenclatura sulla morte cellulare 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Meccanismo di disfunzione dei neutrofili: le serina proteasi dei neutrofili scindono e inattivano il recettore C5a. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Prova diretta di necrosi secondaria dei neutrofili durante un’intensa infiammazione polmonare. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) La necrosi dei neutrofili e la degradazione dell’annexina 1 associate all’infiammazione delle vie aeree nei destinatari di trapianto di polmone con fibrosi cistica. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Eterogeneità funzionale e priming differenziale di neutrofili circolanti in endotossemia sperimentale umana. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse nuove funzioni dei neutrofili nell’immunità, infiammazione e oltre. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)Gli effetti della leucodepletione in pazienti che sviluppano la sindrome da risposta infiammatoria sistemica dopo bypass cardiopolmonare. Perfusione. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Deplezione dei neutrofili del sangue da pazienti con sepsi: trattamento per il futuro? IntImmunopharmacol17:1226-1232.