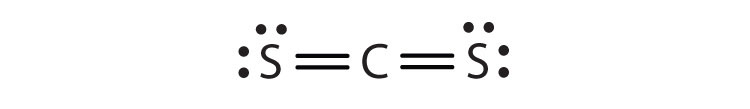4.3 Legami covalenti multipli
Obiettivo di apprendimento
- Riconosci le molecole che possono avere legami covalenti multipli.
In molte molecole, la regola dell’ottetto non sarebbe soddisfatta se ogni coppia di atomi legati condividesse due elettroni. Consideriamo l’anidride carbonica (CO2). Se ogni atomo di ossigeno condivide un elettrone con l’atomo di carbonio, otteniamo quanto segue:
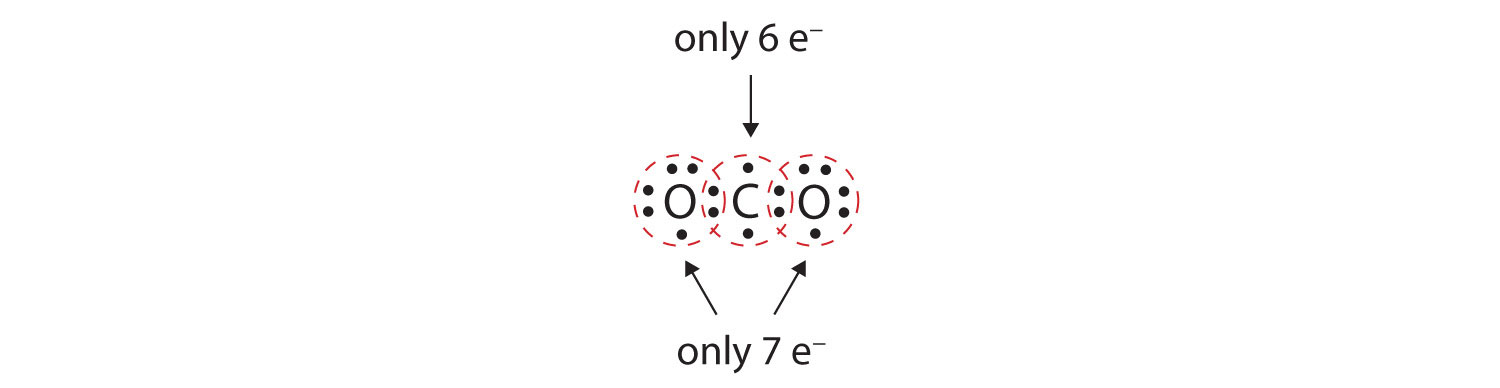
Questo non dà all’atomo di carbonio un ottetto completo; troverete solo sei elettroni nel suo guscio di valenza. Inoltre, ogni atomo di ossigeno ha solo sette elettroni nel suo guscio di valenza. Infine, nessun atomo fa il numero di legami che forma tipicamente (Figura 4.2 “Quanti legami covalenti si formano?”). Questa disposizione degli elettroni condivisi è tutt’altro che soddisfacente.
A volte più di una coppia di elettroni deve essere condivisa tra due atomi perché entrambi gli atomi abbiano un ottetto. Nell’anidride carbonica, un secondo elettrone da ogni atomo di ossigeno è condiviso anche con l’atomo di carbonio centrale, e l’atomo di carbonio condivide un altro elettrone con ogni atomo di ossigeno:
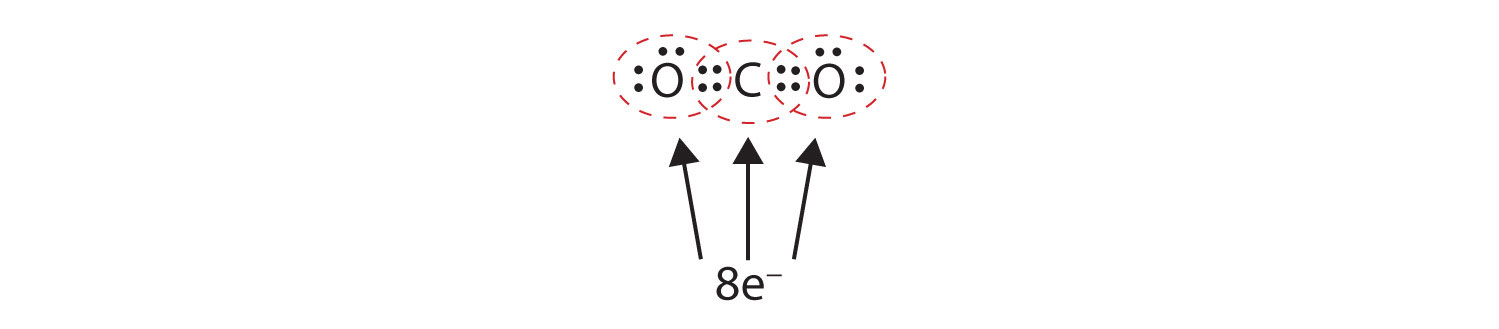
In questa disposizione, l’atomo di carbonio condivide quattro elettroni (due coppie) con l’atomo di ossigeno a sinistra e quattro elettroni con l’atomo di ossigeno a destra. Ora ci sono otto elettroni intorno ad ogni atomo. Due coppie di elettroni condivisi tra due atomi creano un doppio legameDue coppie di elettroni condivisi da due atomi in una molecola. tra gli atomi, che è rappresentato da un doppio trattino:
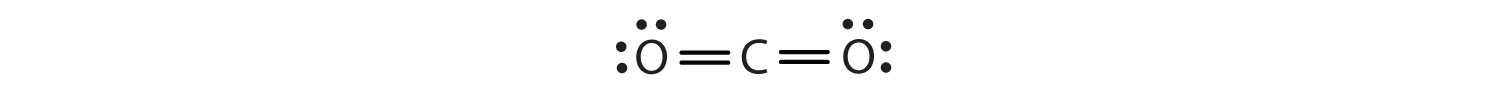
Alcune molecole contengono tripli legamiTre coppie di elettroni condivisi da due atomi in una molecola, legami covalenti in cui tre coppie di elettroni sono condivisi da due atomi. Un composto semplice che ha un triplo legame è l’acetilene (C2H2), il cui diagramma di Lewis è il seguente:

Esempio 5
Disegna il diagramma di Lewis per ogni molecola.
- N2
- CH2O (L’atomo di carbonio è l’atomo centrale.)
Soluzione
-
Il legame tra i due atomi di azoto è un triplo legame. Il diagramma di Lewis per N2 è il seguente:

-
In CH2O, l’atomo centrale è circondato da due diversi tipi di atomi. Il diagramma di Lewis che riempie il guscio elettronico di valenza di ogni atomo è il seguente:

Nota
Una applicazione del CH2O, chiamato anche formaldeide, è la conservazione di campioni biologici. Le soluzioni acquose di CH2O sono chiamate formalina e hanno un odore acuto e caratteristico (pungente).
Esercizio di costruzione delle abilità
-
O2
-
C2H4
Disegna il diagramma di Lewis per ogni molecola.
Esercizio di revisione dei concetti
-
Qual è un indizio che una molecola ha un legame multiplo?
Risposta
-
Se i legami singoli tra tutti gli atomi non danno a tutti gli atomi (tranne l’idrogeno) un ottetto, possono essere presenti legami covalenti multipli.
Presa di coscienza
- Alcune molecole devono avere legami covalenti multipli tra gli atomi per soddisfare la regola dell’ottetto.
Esercizi
-
Ogni molecola contiene più legami. Disegna il diagramma di Lewis per ciascuna. Il primo elemento è l’atomo centrale.
- CS2
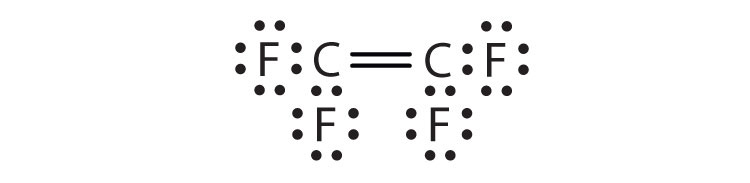
- C2F4
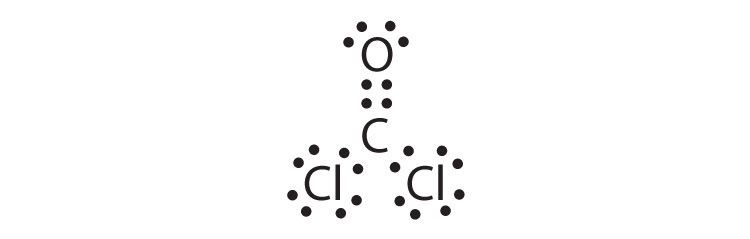
- COCl2
-
Ogni molecola contiene doppi legami. Disegna il diagramma di Lewis per ciascuna. Assumere che il primo elemento sia l’atomo centrale, se non diversamente indicato.
- N2
- HCN (L’atomo di carbonio è l’atomo centrale.)
- POCl (L’atomo di fosforo è l’atomo centrale.)
-
Spiega perché gli atomi di idrogeno non formano doppi legami.
-
Perché non è corretto disegnare un doppio legame nel diagramma di Lewis per MgO?
Risposte
-
-
-
L’idrogeno può accettare solo un altro elettrone; i legami multipli richiedono la condivisione di più di una coppia di elettroni.