Introduzione
Il cancro alla prostata è la forma più comune di tumore maligno e la seconda causa di morte per cancro tra gli uomini.1 Studi cadaverici mostrano che la possibilità di sviluppare microfocolai di cancro alla prostata aumenta con l’età (30% nella quarta decade di vita, 40% nella quinta decade, ecc.).2
Mentre alcuni tumori sono aggressivi, altri hanno un potenziale metastatico minimo o nullo.3 Molti uomini con un cancro alla prostata a basso rischio non progrediranno o diventeranno clinicamente sintomatici nel corso della loro vita.4 A causa di questa variabilità, sono state introdotte diverse opzioni di trattamento che offrono effetti terapeutici paragonabili alla prostatectomia radicale (RP), pur preservando la funzione sessuale e la continenza. In questo scenario, la sorveglianza attiva (AS) può offrire una ridotta morbilità e un miglioramento della qualità della vita.5 I tumori piccoli e non aggressivi sono i candidati ideali per l’AS, sebbene non sia stato raggiunto un consenso. La malattia a basso rischio è definita come Gleason score (GS) 6 e antigene prostatico specifico (PSA)
ng/ml. I pazienti con stadio clinico >T2a sono solitamente esclusi.6
Il grado istologico è un determinante indipendente della prognosi della malattia e della sopravvivenza.7 Il sistema di classificazione GS è il più ampiamente accettato,8 ma molti studi hanno dimostrato che il GS ottenuto dalla biopsia prostatica non sempre è correlato al grado patologico finale dei campioni chirurgici. L’aggiornamento del GS (aumento del GS di almeno un punto) è stato riportato fino al 57% dei casi.9,10 Errori nell’assegnazione del GS possono portare alla sorveglianza inappropriata di tumori biologicamente aggressivi, o alla selezione di trattamenti con tassi di guarigione inferiori nella malattia ad alto rischio, che possono avere un impatto negativo sui risultati dei pazienti.11 Pertanto, diversi studi recenti hanno cercato fattori che potrebbero predire l’aggiornamento della GS.12
Il basso volume della prostata (PV), e più specificamente, l’alta densità dell’antigene prostatico specifico (PSAD) hanno dimostrato di essere predittori di progressione del rischio in molti studi, riflettendo la possibilità di un cancro aggressivo non rilevato.6 Diversi studi hanno dimostrato una forte relazione tra la PSAD e l’aggressività del cancro alla prostata.13 La PSAD è stata proposta come un forte predittore dell’aumento della GS nei pazienti con malattia di Gleason 6 confermata dalla biopsia, ma non esiste un consenso generale sul valore di cut-off.11-Lo scopo principale del nostro studio è stato quello di identificare i predittori indipendenti per l’aumento del GS e determinare il miglior valore di cut-off per il PSAD per identificare i pazienti a rischio.
Materiali e metodi
Abbiamo raccolto le informazioni dello studio dal database prospettico del nostro centro ospedaliero. Sono stati selezionati i pazienti con cancro alla prostata clinicamente localizzato, sottoposti a prostatectomia radicale (RP) e con una biopsia prostatica preoperatoria nel periodo compreso tra gennaio 2004 e febbraio 2015. Il rilevamento di GS 3+3 alla biopsia prostatica è stato preso come criterio di inclusione. Tutte le informazioni cliniche, di imaging, di laboratorio e patologiche sono state ottenute dal database e corroborate dalle cartelle cliniche dei pazienti.
Abbiamo incluso l’età preoperatoria del paziente, lo stadio clinico della malattia, il PSA pre-biopsia, il PSAD preoperatorio, la GS alla biopsia, il numero totale di carote bioptiche prelevate e il numero di carote bioptiche con cancro e abbiamo analizzato l’associazione di questi fattori con il miglioramento della GS dopo la RP. Sono stati utilizzati diversi valori di cut-off per ogni variabile per identificare e quantificare una potenziale relazione con l’aggiornamento di Gleason. Abbiamo anche analizzato l’associazione dell’aumento del GS con le variabili della sindrome metabolica, come il diabete mellito (DM), la pressione alta (HBP) e l’obesità, che sono state ottenute dalle cartelle cliniche dei pazienti. Le ultime variabili sono state incluse perché studi precedenti hanno dimostrato la loro associazione con una prognosi peggiore e un più alto tasso di recidiva.18,19
PSAD è stato calcolato dividendo il valore del PSA preoperatorio per la PV. La PV è stata calcolata tramite ecografia transrettale utilizzando il diametro trasversale massimo (D1), il diametro anteroposteriore massimo (D2) e il diametro longitudinale massimo (D3), utilizzando la formula D1×D2×D3×ϖ/6 basata sulla teoria della dimensione dell’ellisse prostatica.14 La biopsia prostatica è stata eseguita utilizzando il protocollo precedentemente descritto del nostro ospedale. Tutti i pazienti sono stati leggermente sedati e una singola dose i.v. di piperacillina/tazobactam è stata somministrata 15 minuti prima della procedura.20 Abbiamo usato un ago da 18 gauge con una pistola bioptica automatica per ottenere il tessuto prostatico. Per la prima biopsia, sono stati prelevati 12-18 carote, a seconda delle dimensioni della prostata e della presenza di noduli sospetti.21 Tutti i campioni sono stati posti in un contenitore separato che identificava il sito corrispondente e sono stati inviati al servizio di patologia del nostro ospedale.
Le statistiche descrittive sono state presentate come media±deviazione standard (SD) e mediana/IQR per le variabili continue e come frequenza assoluta e percentuale di distribuzione per le variabili categoriche. I pazienti che dopo l’intervento sono stati migliorati a GS 7 o superiore sono stati confrontati con quelli che non sono stati migliorati. Per determinare le differenze medie e le somiglianze, le variabili categoriche sono state confrontate utilizzando il test chi-quadro di Pearson e le variabili continue con il test mediano e il test t di Student. Un test di regressione univariata è stato utilizzato per individuare i predittori indipendenti significativi dell’aggiornamento. È stata utilizzata una curva caratteristica operativa del ricevitore (ROC) e l’area sotto la curva (AUC) è stata calcolata per mostrare il valore di cut-off ottimale per le variabili con significato predittivo per l’aggiornamento della GS. Abbiamo stimato la sensibilità, la specificità, il valore predittivo positivo e il valore predittivo negativo di diversi cut-off proposti da altri autori, li abbiamo applicati alla nostra popolazione e li abbiamo confrontati con il nostro valore di cut-off. Tutti i test erano a due code e un valore p di
Risultati
Da un totale di 342 pazienti nel nostro database, 144 (42,1%) sono stati esclusi perché avevano un GS ≥4 nella biopsia prostatica. Questo ha lasciato 198 (57,9%) pazienti che hanno soddisfatto i nostri criteri di inclusione di GS 6 (3+3). Settantatre di questi pazienti sono stati esclusi a causa di informazioni cliniche incomplete dalle cartelle cliniche.
L’età media dei pazienti era di 65,1±6,3 anni, l’indice di massa corporea (BMI) era di 26,7±3,6kg/m2, il numero di carote prelevate era 13,4±3,5, il numero di carote positive era 2,5±2, e il PSAD preoperatorio era 0,26±0,23ng/ml2. Il PSA preoperatorio mediano era 7,2 IQR 5,67-10,05 e il PV era 38 IQR 26,5-55,5. Lo stadio clinico basato sull’esame rettale digitale era T1c in 86 (69,6%) pazienti, T2a in 28 (22,4%), T2b in 7 (5,6%), T2c in 2 (1,6%), e T3 in un paziente (0,8%).
Il PSA preoperatorio era classificato come segue: 6 (4,8%) pazienti avevano valori di PSA
ng/ml, 88 (70,4%) erano tra 4 e 9,9ng/ml, 23 (18,4%) erano tra 10 e 19,9ng/ml, e 8 (6,4%) avevano PSA ≥20ng/ml. La GS bioptica e la GS chirurgica sono rimaste le stesse in 71 (56,8%) pazienti con GS 3+3, mentre 54 (43,2%) pazienti hanno avuto un upgrade. Di quei pazienti con aggiornamento, il 70% è salito a una GS di 7 e il 30% è aumentato a ≥8.
La tabella 1 mostra le caratteristiche demografiche e cliniche dei pazienti con e senza aggiornamento della GS. Abbiamo trovato una correlazione statisticamente significativa tra l’upgrade postoperatorio e il valore PSAD preoperatorio (p0.001), il PSA preoperatorio (p=0.039), il PV (p=0.004), e l’età del paziente ≥70 anni (p=0.011).
Caratteristiche dei pazienti con e senza aggiornamento del punteggio di Gleason dopo prostatectomia radicale.
| Caratteristiche | Upgrade | No upgrade | p-Value |
|---|---|---|---|
| No. di pazienti (%) | 54 (43,2%) | 71 (56.8%) | |
| Età (anni) | |||
| Media±SD | 66.22±6.5 | 64.28±6.0 | 0.092b |
| Età (n.) | |||
| >70 anni di età | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| Media±SD | 26.22±4.0 | 27.14±3.1 | 0.178c |
| PSA (ng/ml) | |||
| Mediana/IQR | 8/6.5-12.6 | 6.8/5.4-9 | 0.039*,c |
| Volume prostatico (ml) | |||
| Mediana/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Media±SD | .36±.27 | .19±.16 | *,c |
| Core di biopsia (no.) | |||
| Media±SD | 12.9±3.4 | 13.7±3.7 | 0.240c |
| Core positive (no.) | |||
| Media±SD | 2.9±2.4 | 2.1±1.6 | 0.0702c |
| Obesità (no.) | |||
| Positivo | 9 (16.6%) | 16 (22.5%) | 0.500a |
| Negativo | 45 (83,4%) | 55 (77..5%) | |
| DM (no.) | |||
| Positivo | 16 (29,6%) | 14 (19.7%) | 0.150a |
| Negativo | 38 (70.4%) | 57 (80.3%) | |
| HBP (no.) | |||
| Positivo | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Negativo | 33 (61,1%) | 41 (57.8%) | |
IQR: intervallo interquartile; BMI: indice di massa corporea; PSA: antigene prostatico specifico; PSAD: densità dell’antigene prostatico specifico; DM: diabete mellito; HBP: pressione alta.
testX2.
Test di Student.
Test mediano.
Statisticamente significativo con un valore p
Abbiamo stimato un cut-off PSAD ottimale di 0.17ng/ml2 attraverso l’analisi ROC, con un AUC di 0,675 (p=0,001, 95%CI .580-.770), e poi abbiamo analizzato i valori di cut-off proposti da altri autori e li abbiamo confrontati. La Tabella 2 e la Fig. 1 mostrano questi risultati.
Analisi di diversi valori di cutoff del PSAD come predittore di miglioramento del GS.
| Upgrade | No upgrade | p | Odds rapporto | Sens % | Spec % | PPV % | NPV % | ||
|---|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4%) | 49 (69%) | ||||||||
PSAD: antigene prostatico specifico.
testX2.
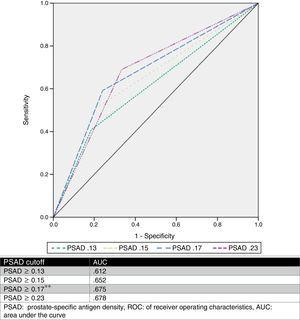
CurvaROC.
La tabella 3 mostra i risultati della regressione univariata per l’individuazione dei predittori indipendenti di miglioramento.
Predittori indipendenti dell’upgrading (regressione univariata).
| Caratteristiche | HR | 95 CI | p value |
|---|---|---|---|
| Età | 0.5 | 0,99-1,11 | 0,09 |
| >70 anni di età | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1.49 | 2.08-9.49 | |
| PSA | 0.05 | 0.99-1.11 | 0.059 |
| volume prostatico | 0.02 | 1.01-1.04 | 0.008* |
| Nuclei bioptici positivi | 0.06 | 0.98-1.18 | 0.24 |
| Obesità | 0.31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0,152 |
| HBP | 0,10 | 0,53-2,29 | 0.775 |
BMI: indice di massa corporea; PSA: antigene prostatico specifico; PSAD: densità dell’antigene prostatico specifico; DM: diabete mellito; HBP: pressione alta.
Discussione
Diversi studi hanno trovato una mancanza di concordanza tra il rapporto GS della biopsia prostatica e quello della prostatectomia radicale. In una recente meta-analisi comprendente 14.839 pazienti, gli autori hanno stimato un aumento del GS nel 30% dei pazienti, con solo il 63% che rimaneva invariato dopo la prostatectomia.22 L’aggiornamento di Gleason è stato riscontrato nel 29-58% dei casi,23 ed è peggiore nel sottogruppo di pazienti con un GS 3+3 alla biopsia (fino al 63,3%).14 Nel nostro centro ospedaliero, abbiamo riscontrato un aggiornamento di GS nel 42,1% di tutti i pazienti sottoposti a prostatectomia radicale e nel 43,2% dei pazienti con un punteggio di Gleason alla biopsia di 3+3.
Molti autori hanno cercato di trovare predittori di aggiornamento di GS, in particolare con la crescente popolarità attuale dei protocolli AS. I predittori precedentemente descritti sono l’età >60 anni, il valore del PSA >5.0ng/ml, e >25% di nuclei positivi durante la biopsia.24
Il PSA è stato analizzato e sono stati descritti diversi valori di cut-off (come ≥0.13ng/ml, ≥0.15ng/ml, e ≥0.23ng/ml).11,13,16,17 Tuttavia, non c’è consenso sull’uso di questo valore per prevedere con precisione un GS upgrade. Sulla base dei nostri risultati, abbiamo proposto un valore di cut-off di ≥0,17ng/ml, che aveva un AUC di 0,675, una sensibilità del 75,9%, una specificità del 59,2%, un PPV del 58,5% e un NPV del 76,3% per la previsione dell’upgrade di GS. Abbiamo selezionato questo cut-off point, perché analizzando altri valori proposti in relazione alla nostra casistica, il miglior AUC è stato ottenuto con un valore ≥0,23ng/ml (0,678), ma aveva una sensibilità peggiore e un alto tasso di falsi negativi (33,33%). D’altra parte, quando abbiamo usato i valori ≥0,13ng/ml e ≥0,15ng/ml, avevano un tasso di falsi positivi del 59% e 49%, rispettivamente. Il tasso di falsi negativi e di falsi positivi del cut-off proposto dal nostro team era rispettivamente del 24% e del 41%, che abbiamo considerato il più utile. La Fig. 2 mostra un grafico della nostra popolazione.

La popolazione dello studio, che mostra le diverse densità dell’antigene prostatico specifico e i dati di aggiornamento.
Il nostro studio ha incluso solo i pazienti con una biopsia GS di 3+3, a causa dell’importanza di questa variabile quando si considera un paziente per AS. Dato che ci sono altri fattori presi in considerazione per la sorveglianza attiva, non possiamo dichiarare che il rischio di GS upgrade e il PSAD siano variabili determinanti per proporre una strategia terapeutica, ma crediamo sicuramente che debbano essere discussi prima di prendere una decisione. Una seconda biopsia potrebbe essere indicata per i pazienti con una PSAD ≥0.17ng/ml, considerando il rischio di sottoclassificazione, al fine di corroborare la GS. La risonanza magnetica prostatica e le biopsie di fusione guidate dalla risonanza magnetica hanno dimostrato un’elevata sensibilità e specificità per la localizzazione di tumori significativi non identificati.25 Tuttavia, queste opzioni non sono ampiamente disponibili in Messico, quindi la biopsia transrettale a saturazione o template guidata dall’ecografia potrebbe essere un’opzione più valida per aumentare l’accuratezza diagnostica.
Prove recenti hanno suggerito un’associazione tra le diverse componenti della sindrome metabolica e il cancro alla prostata, aumentando il rischio di presentare la malattia e morire per essa,21 così come un tasso più elevato di recidiva biochimica dopo il trattamento radicale.22 Tuttavia, nel nostro studio non abbiamo potuto dimostrare un’associazione con l’aggiornamento del punteggio di Gleason.
Il volume della prostata, che è direttamente correlato all’età, potrebbe essere un elemento di distrazione. Quando si esegue una biopsia casuale ecoguidata in una prostata di grandi dimensioni c’è il rischio potenziale di lasciare aree sottocampionate più grandi, il che rappresenta un rischio maggiore di mancare un tumore significativo.
L’AS ha fornito risultati promettenti nei pazienti con cancro alla prostata a basso rischio, con miglioramenti nella qualità della vita, nella conservazione della funzione erettile e della continenza urinaria, e in altre complicazioni associate ai trattamenti radicali.6 Tuttavia, c’è il rischio di diagnosticare erroneamente un cancro aggressivo e ritardare il trattamento opportuno, influenzando la prognosi del paziente. Ci sono molti criteri per selezionare i candidati all’AS, e la classificazione del rischio di D’Amico26 e i criteri di Epstein27 sono i più usati a questo scopo. La prima non include il PSAD, ma nei criteri di Epstein viene suggerito l’uso di un valore di cut-off ≥0,15ng/ml. Nel nostro ospedale, usiamo criteri molto rigorosi e il valore di cut-off del PSAD ≥0,17ng/ml sarà incluso come parte della discussione quando si seleziona un possibile candidato per l’AS.
Il carattere retrospettivo del nostro studio è stato il suo limite principale. Il campione potenziale è stato ulteriormente ridotto a causa di dati incompleti nelle cartelle cliniche. Un’altra limitazione era il fatto che non avevamo tutti i dati dei campioni bioptici, quindi non potevamo analizzare i pazienti con tutti i criteri dell’AS. Tuttavia, con la quantità di pazienti inclusi nello studio, sono stati ottenuti risultati significativi e questi possono essere utilizzati per considerare il rischio di aggiornamento del GS nei pazienti con GS 3+3.
Conclusioni
Concludiamo che è importante utilizzare quanti più strumenti possibili per prendere decisioni accurate e per identificare i pazienti ad alto rischio di aggiornamento patologico che potrebbero beneficiare di una valutazione più meticolosa e/o un trattamento aggressivo. Il PSAD dovrebbe essere usato di routine per identificare i pazienti con un cancro apparentemente a basso rischio a rischio di GS upgrade, con una conseguente selezione più accurata dei candidati per l’AS. Secondo i nostri dati, possiamo evitare una stadiazione GS potenzialmente errata in circa il 43% dei casi.
Abbiamo trovato un’alta frequenza di GS upgrade nella nostra popolazione. Nel nostro studio, i valori di PSAD erano significativamente associati all’upgrading e il valore di cut-off più accurato era 0,17ng/ml2. Raccomandiamo che una revisione locale del rischio di aggiornamento di GS e dei suoi potenziali predittori sia effettuata in tutti i centri ospedalieri prima di offrire una sorveglianza attiva ai potenziali candidati.
Discrezioni eticheProtezione dei soggetti umani e animali
Gli autori dichiarano che nessun esperimento è stato eseguito su esseri umani o animali per questo studio.
Confidenzialità dei dati
Gli autori dichiarano che nessun dato dei pazienti appare in questo articolo.
Diritto alla privacy e al consenso informato
Gli autori dichiarano che nessun dato dei pazienti appare in questo articolo.
Finanziamento
Nessuna sponsorizzazione di alcun tipo è stata ricevuta per intraprendere questo articolo.
Conflitto di interessi
Gli autori dichiarano di non avere alcun conflitto di interessi, né hanno ricevuto alcuna sponsorizzazione per lo studio.