US Pharm. 2008;33(3)(OTC suppl):4-7.
L’asma è una malattia polmonare caratterizzata dall’ostruzione reversibile del flusso d’aria e dall’iperreattività bronchiale. La caratteristica centrale dell’asma è l’infiammazione, che porta a episodi ricorrenti di respiro sibilante, tosse, mancanza di respiro e oppressione toracica.1,2 L’obiettivo della terapia è quello di ottenere il controllo della malattia al fine di mantenere una normale qualità della vita.
Il peso dell’asma è stato in costante aumento negli ultimi tre decenni. Nel 1970, circa il 3% della popolazione aveva l’asma, rispetto al 5,5% e al 7,7% nel 1995 e nel 2005, rispettivamente.3 Quest’ultima stima equivale a circa 22,2 milioni di americani.2,3 Con un aumento della prevalenza di questa malattia negli Stati Uniti, anche la morbilità e la mortalità dovute all’asma sono in aumento. Attribuiti all’asma nel 2004 sono stati 1,8 milioni di visite al pronto soccorso, 497.000 ricoveri e 4.055 morti.3
Trattamento basato sul controllo dell’asma
Il National Asthma Education and Prevention Program (NAEPP), una divisione del National Heart, Lung, and Blood Institute, pubblica le linee guida per la diagnosi e la gestione dell’asma, aggiornate di recente nel 2007.2 Le linee guida classificano la gravità dell’asma come intermittente o persistente in base ai sintomi e alla frequenza d’uso dei farmaci di rapido sollievo. Gli individui con asma intermittente hanno sintomi poco frequenti, di conseguenza l’uso poco frequente di farmaci a rapida attenuazione, e nessuna interferenza con la normale attività. Se l’asma è meno controllata, allora la gravità dell’asma è classificata come persistente (vedi TABELLA 1).
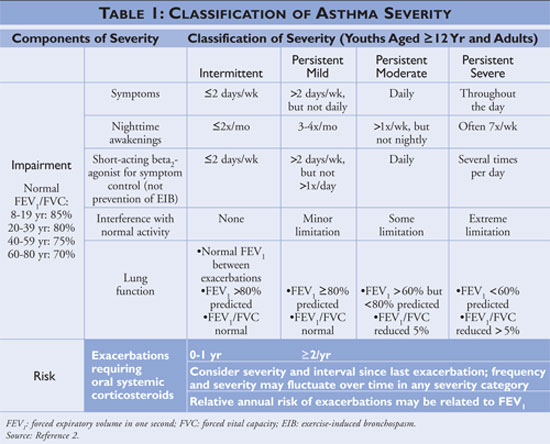
Le linee guida descrivono le pietre miliari della gestione dell’asma come l’educazione all’autogestione, l’uso di farmaci di rapido sollievo e l’uso di farmaci di controllo a lungo termine in individui con asma persistente. Gli operatori sanitari che offrono un’educazione all’autogestione dovrebbero istruire i pazienti a identificare ed evitare i fattori scatenanti dell’asma quando possibile, a usare correttamente le terapie farmacologiche e a elaborare un piano d’azione per l’asma. I farmaci a rapido rilascio dovrebbero essere iniziati per tutti i pazienti con diagnosi di asma e possono essere usati come monoterapia negli individui con asma intermittente; gli individui con diagnosi di asma persistente, tuttavia, dovrebbero avere uno o più farmaci di controllo a lungo termine aggiunti al loro regime. I farmaci di controllo a lungo termine includono corticosteroidi per via inalatoria, modificatori di leucotrieni, beta-agonisti a lunga durata d’azione e teofillina (vedi TABELLA 2).

Le linee guida notano anche che circa il 30% della popolazione statunitense utilizza farmaci e interventi complementari e alternativi. Al momento, tuttavia, non esistono prove sufficienti per raccomandare queste modalità di trattamento per l’asma. Le linee guida sconsigliano l’uso di rimedi a base di erbe per il trattamento dell’asma a causa della mancanza di dati sulla sicurezza e l’efficacia.
Prodotti per l’asma senza prescrizione e la loro regolamentazione
I prodotti per l’asma senza prescrizione sono disponibili dagli anni ’50, anche se alcuni dei principi attivi sono cambiati notevolmente nel corso degli anni. Gli ingredienti attivi attualmente disponibili senza prescrizione sono efedrina – con o senza guaifenesina – ed epinefrina. La teofillina e il fenobarbital erano precedentemente ingredienti attivi in prodotti per l’asma senza prescrizione; tuttavia, entrambi sono ora classificati come prodotti con obbligo di prescrizione.4
Negli ultimi tre decenni, la FDA ha intrapreso azioni riguardanti la regolamentazione dei trattamenti per l’asma senza prescrizione. Nel 1976, la FDA ha concluso che l’epinefrina inalata forniva un sollievo rapido ed efficace nell’asma da lieve a moderata. Nel 1982, ha concluso nuovamente in una monografia finale provvisoria: “L’epinefrina, il bitartrato di epinefrina e il cloridrato di epinefrina (racemico; ribattezzato racepinefrina cloridrato) in forme di dosaggio pressurizzate per aerosol per inalazione possono essere generalmente riconosciuti come sicuri ed efficaci per uso OTC al dosaggio per adulti e bambini di 4 anni e più di 1 o 2 inalazioni di una dose misurata equivalente a 0,16-0,25 mg di epinefrina.16 a 0,25 mg di epinefrina per inalazione non più spesso di ogni 3 ore. “5,6
Nel 1986, la FDA ha esaminato i prodotti a base di efedrina per la broncodilatazione e ha approvato questo principio attivo come generalmente riconosciuto come sicuro ed efficace per l’uso senza prescrizione. In quell’anno, la FDA decise che i dati erano insufficienti per limitare l’epinefrina inalata solo all’uso su prescrizione e che i benefici della disponibilità senza prescrizione superavano i rischi. La FDA concluse che un’etichettatura estesa e riveduta avrebbe giovato ai consumatori.5,6
Dopo le segnalazioni di eventi pericolosi per la vita e di decessi attribuibili a prodotti combinati non soggetti a prescrizione contenenti teofillina, la FDA emise una decisione finale nel 1995 che questi prodotti non erano sicuri o efficaci.7 Così, i prodotti contenenti una combinazione di efedrina e teofillina furono interrotti e alcuni furono riformulati per contenere efedrina e guaifenesina. Sempre nel 1995, la FDA ha proposto di rimuovere l’efedrina dal mercato non prescrittivo a causa del suo ruolo nella produzione di metanfetamina e metcatinone e del suo uso improprio per il controllo del peso e l’aumento dei muscoli.7
Nel 1996, la FDA ha modificato la monografia finale del 1986 per rimuovere lo status di monografia per i broncodilatatori OTC.6 Invece, i produttori di qualsiasi nuovo inalatore dosato senza prescrizione devono presentare una domanda approvata che contiene informazioni che non si trovano nella monografia.6 I broncodilatatori senza prescrizione attualmente commercializzati non sono stati interessati da questo emendamento.
Nonostante la proposta della FDA di rimuovere l’efedrina dal mercato senza prescrizione a causa del suo uso come elemento base nella produzione di metanfetamina, il prodotto rimane disponibile senza prescrizione. Invece, il Combat Methamphetamine Epidemic Act del 2005, incorporato nel Patriot Act nel 2006, ha conferito lo status di prodotto da banco ai prodotti senza prescrizione contenenti efedrina.8 I consumatori che desiderano acquistare prodotti contenenti efedrina devono ora presentare un documento d’identità con foto rilasciato dal governo presso una farmacia, poiché questi prodotti non sono più venduti legalmente nei minimarket o nei magazzini senza una farmacia registrata.
Come parte della protezione globale della salute pubblica, è stato formato un accordo internazionale per ridurre ed eventualmente eliminare i prodotti che contengono sostanze che riducono l’ozono (ODS) come i clorofluorocarburi (CFC) presenti negli inalatori dosatori (MDI). Questo accordo ha dato origine al Protocollo di Montreal del 1987 e successivamente al Clean Air Act Amendments del 1990.9-11 L’accordo prevede un’esenzione per l’uso dei CFC negli inalatori usati per il trattamento dell’asma se l’uso del prodotto è determinato come essenziale dalla FDA.12 I farmaci per l’asma senza prescrizione sono rimasti sotto la designazione di uso essenziale. Tuttavia, nel 2007 la FDA ha annunciato la proposta di rimuovere la designazione di uso essenziale per l’epinefrina inalata a partire dal 31 dicembre 2010.13 La FDA ha utilizzato i seguenti criteri, che si trovano nel 21 CFR 2.125(g)(2), per rivedere la designazione di uso essenziale per l’epinefrina inalata: “(i): Esistono barriere tecniche sostanziali per formulare il prodotto senza ODS; (ii): Il prodotto fornirà un importante beneficio di salute pubblica non disponibile; e (iii): L’uso del prodotto non rilascia quantità cumulativamente significative di ODS nell’atmosfera o il rilascio è giustificato in vista dell’importante beneficio per la salute pubblica non disponibile. “13 La FDA sta attualmente ricevendo commenti su questo argomento prima della loro decisione finale.
Sicurezza ed efficacia dei prodotti non soggetti a prescrizione
Come dimostrano le varie proposte fatte e le azioni intraprese dalla FDA riguardo allo status di prodotti per l’asma non soggetti a prescrizione, negli ultimi decenni si è discusso molto sulla sicurezza e sull’efficacia degli ingredienti attivi di questi prodotti. Anche se questi prodotti non sono attivamente promossi, la loro disponibilità significa che la loro sicurezza ed efficacia sono criticamente importanti per i consumatori.
Efedrina: I prodotti a base di efedrina mono-ingrediente per l’uso come broncodilatatori sono stati considerati generalmente riconosciuti come sicuri ed efficaci dalla FDA dal 1986.14 L’efedrina rilascia epinefrina dai tessuti, che attiva i recettori alfa-adrenergici e beta-adrenergici non selettivi. L’efficacia dell’efedrina per la broncodilatazione è stata dimostrata in studi che risalgono agli anni ’50. Le proprietà che rendono l’efedrina meno desiderabile come broncodilatatore includono una più lenta insorgenza dell’azione rispetto ai prodotti inalati (da 15 minuti a un’ora) e la non selettività della stimolazione beta, che potrebbe contribuire agli eventi avversi cardiovascolari (AE).15-17 Tuttavia, gli studi hanno dimostrato risultati contrastanti riguardo agli eventi avversi cardiovascolari attribuibili all’uso dell’efedrina alle dosi etichettate da 12,5 a 25 mg.16
Epinefrina: L’epinefrina presenta la stessa attività dei recettori alfa e beta-adrenergici dell’efedrina; pertanto esistono le stesse preoccupazioni riguardo alla possibilità di eventi avversi cardiovascolari. L’inizio dell’azione dell’epinefrina inalata (15 secondi) è molto più rapido di quello dell’efedrina orale, rendendola una scelta più appropriata per il sollievo immediato da una esacerbazione acuta dell’asma.6 La sua breve durata d’azione (23 minuti), tuttavia, può rendere necessario che il paziente usi il prodotto ripetutamente per un sollievo continuo piuttosto che seguire le istruzioni dell’etichetta di non più di due inalazioni entro tre ore.6 Gli inalatori di epinefrina non soggetti a prescrizione sembrano essere sicuri ed efficaci per i pazienti con asma lieve e intermittente se usati come indicato in etichetta.5 Questo rimane una fonte di controversia, tuttavia, poiché molti fornitori di assistenza sanitaria sono preoccupati che i pazienti che si affidano agli inalatori non soggetti a prescrizione possano non ricevere un’adeguata gestione della malattia da un team di assistenza sanitaria, con possibili gravi ripercussioni.
Guaifenesina: La guaifenesina è usata in combinazione con l’efedrina per il trattamento dell’asma ed è riconosciuta come sicura ed efficace quando il prodotto è etichettato per la tosse associata all’asma.14 Anche se la guaifenesina è un mucolitico approvato dalla FDA, non possiede effetti broncodilatatori. Pertanto, non apporta alcun beneficio aggiuntivo al prodotto a base di efedrina per un’esacerbazione acuta.17
Uso dei prodotti per l’asma senza prescrizione medica
Un sondaggio Wyeth Consumer Healthcare (WCH) condotto nel 1999 ha rilevato che circa sei milioni (30%) di individui con asma usano inalatori di epinefrina.6 Le autovalutazioni degli intervistati suggeriscono che circa il 20% di questi sei milioni sarebbe classificato come affetto da asma persistente lieve-moderata, che non rientra nell’uso previsto per questo prodotto.5 Le linee guida del NAEPP promuovono l’uso di beta agonisti a breve durata d’azione almeno al bisogno da parte di tutti gli individui che soffrono di asma; le linee guida non menzionano specificamente l’epinefrina inalata come scelta di trattamento, tuttavia.
Nel 2005, il WCH ha condotto un sondaggio su Internet su 330 persone riguardo all’uso di broncodilatatori non soggetti a prescrizione per il trattamento dei loro sintomi. Il WCH ha determinato che, tra gli utenti senza prescrizione, il 92% aveva ricevuto una diagnosi di asma, il 91% usava l’epinefrina per via inalatoria solo in caso di esacerbazione acuta dell’asma, il 31% non aveva un’assicurazione medica e il 38% non aveva un’assicurazione con prescrizione.6 Il WCH ha estrapolato questi risultati per stimare che circa il 5%-10% delle persone con asma usa broncodilatatori senza prescrizione come monoterapia.6 Le ragioni principali addotte per l’uso senza ricetta – facilità di accesso e costi inferiori – sono direttamente correlate alle preoccupazioni degli operatori sanitari che gli individui che usano prodotti per l’asma senza ricetta non ricevano una gestione appropriata della malattia.6
Discussione
Le proprietà desiderabili nel trattamento dell’asma acuto includono l’efficacia come broncodilatatore, la sicurezza quando assunto come indicato in etichetta, un rapido inizio dell’azione e una lunga durata della stessa. Sia l’epinefrina per via inalatoria che l’efedrina orale hanno dimostrato la loro efficacia negli studi per decenni. Dati i risultati cardiovascolari misti negli studi clinici, tuttavia, la sicurezza dell’uso di broncodilatatori senza prescrizione da parte di individui che potrebbero non essere seguiti dal punto di vista medico è una grande preoccupazione degli operatori sanitari. L’epinefrina per via inalatoria ha un inizio d’azione più rapido dell’efedrina orale, ma la sua breve durata d’azione può limitarne l’efficacia.
La disponibilità dell’efedrina orale è stata limitata dal 2006 dal suo status di prodotto da banco. La disponibilità dell’efedrina per via inalatoria dipende dalla decisione della FDA se questa formulazione manterrà la sua designazione di uso essenziale. Non esistono alternative non prescrittive per i broncodilatatori non prescrittivi contenenti CFC attualmente in commercio.12 Un produttore ha cercato di riformulare il suo prodotto di epinefrina per via inalatoria non prescrittiva con un propellente idrofluoroalcano, con effetti indesiderati per l’utente; si è associato con un’altra azienda farmaceutica per la riformulazione in previsione della presentazione alla FDA entro il 2011.6 Le principali preoccupazioni riguardo ai propellenti alternativi includono la necessità di un’erogazione efficace di epinefrina e i dati sulla sicurezza ed efficacia del nuovo prodotto a seguito dei cambiamenti.18
Nel determinare se rimuovere la designazione di uso essenziale per l’epinefrina per inalazione, la FDA non sta esaminando la sicurezza o l’efficacia dei prodotti contenenti CFC attualmente in commercio; piuttosto, sta esaminando l’impatto sulla salute pubblica se la designazione dovesse essere rimossa. Nelle lettere della National Association of Chain Drug Stores e dell’American Pharmacists Association alla FDA sulla proposta di rimuovere la designazione di uso essenziale, la preoccupazione principale era il potenziale impatto negativo sugli attuali utenti di inalatori senza ricetta se i prodotti non fossero disponibili.19,20 La FDA ha dichiarato che se la regola proposta per rimuovere la designazione di uso essenziale diventa definitiva e non esistono alternative senza ricetta, sarà necessario per i consumatori ottenere una prescrizione per un prodotto alternativo.12 Molti consumatori che usano l’epinefrina per via inalatoria possono scegliere di rinunciare al trattamento dell’asma o cercare una terapia alternativa senza ricetta.
E’ imperativo che la comunità medica renda il pubblico consapevole della gravità delle conseguenze dell’asma non controllata e che ogni persona che sperimenta difficoltà respiratorie dovrebbe vedere un fornitore di assistenza sanitaria per la diagnosi e il trattamento. Un paziente che sceglie di usare broncodilatatori non prescritti dovrebbe essere avvisato di informare il suo fornitore di assistenza sanitaria; il paziente dovrebbe anche essere consigliato sulla differenza nelle istruzioni dell’etichetta tra inalatori non prescritti e prescritti. L’attuale continua accessibilità dei broncodilatatori senza ricetta richiede la consulenza informata dei pazienti per prevenire l’uso improprio di questi prodotti e i successivi effetti avversi.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Linee guida per la diagnosi e la gestione dell’asma. Programma nazionale di educazione e prevenzione dell’asma. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Stati Uniti, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Accessed December 10, 2007.
4. W. Steven Pray. Prodotti OTC e terapia dell’asma. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Sicurezza degli inalatori da banco per l’asma: relazione del Consiglio per gli affari scientifici. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Uso della sostanza che distrugge l’ozono: determinazione dell’uso essenziale degli inalatori di epinefrina da banco (OTC). Documento informativo. 19 dicembre 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Accessed December 30, 2007.
7. Kupec IF. Broncodilatatori contenenti teofillina e prodotti farmaceutici a base di efedrina. Risposte T95-40. 27 luglio 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Accessed December 10, 2007.
8. Drug Enforcement Administration. Informazioni generali riguardanti il Combat Methamphetamine Epidemic Act del 2005. Maggio 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Accessed February 4, 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Approfondimenti meccanicistici aiutano la ricerca di sostituti CFC: valutazione del rischio di HCFC-123 come esempio. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economia delle “esenzioni per uso essenziale” per gli inalatori dosatori sotto il protocollo di Montreal. J Environ Manage.2007;85:1-8.
11. D’Souza S. Il protocollo di Montreal e le esenzioni per uso essenziale. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. Notizie FDA. FDA propone l’eliminazione dei CFC negli inalatori dosatori di epinefrina. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Accessed December 10, 2007.
13. Food and Drug Administration. Codice del regolamento federale 21 CFR parte 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Accessed February 6, 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, classificazione internazionale delle droghe; Convenzione sulle sostanze psicotrope. 16 aprile 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Accessed December 30, 2007.
15. Lexi-Comp Online. www.crlonline.com. Accessed December 28, 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Confronto in doppio cieco degli effetti bronchiali e cardiovascolari acuti della terbutalina orale e dell’efedrina. Chest. 1975;68:155-161.
17. Dulfano MJ. I nuovi broncodilatatori orali. Chest.1975;68:133-134.
18. Prodotti farmaceutici per raffreddore, tosse, allergia, broncodilatatori e antiasmatici per uso umano da banco; modifica della monografia per prodotti farmaceutici broncodilatatori OTC. Fed Regist. 1996; 61:25142-25147.
19. Associazione nazionale delle catene di negozi di droga. Oggetto: uso di propellenti che distruggono l’ozono; rimozione della designazione di uso essenziale per gli inalatori dosatori di epinefrina da banco (MDI). 6 gennaio 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Accesso 6 febbraio 2008.
20. Dichiarazione dell’Associazione Americana dei Farmacisti (APhA) al Comitato consultivo per i farmaci senza ricetta della Food and Drug Administration e al Comitato consultivo per i farmaci per l’allergia polmonare. Uso della sostanza che distrugge l’ozono: determinazione dell’uso essenziale degli inalatori di epinefrina OTC. 24 gennaio 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Accessed February 6, 2008.
Per commentare questo articolo, contattare [email protected].