L’acqua del rubinetto contiene gas atmosferici, come azoto e ossigeno, disciolti in essa. Quando il bicchiere riempito d’acqua rimane fuori per qualche ora, la sua temperatura aumenta leggermente (l’acqua diventa più calda), il che fa sì che i gas disciolti in esso escano dall’acqua e formino bolle lungo l’interno del bicchiere.
Riempi un bicchiere d’acqua (a temperatura ambiente o inferiore) e lascialo indisturbato per qualche ora (puoi farlo usando acqua di rubinetto). Alla fine noterai che cominciano ad apparire delle piccolissime bolle lungo il lato del bicchiere (all’interno). Perché succede questo?

- Solubilità dei gas nell’acqua
- I gas sono più solubili in acqua a temperature più fredde
- Pericolo per la vita acquatica dovuto al cambiamento della temperatura dell’acqua
- La solubilità dei gas nell’acqua aumenta con l’aumentare della pressione
- La legge di Henry
- Perché si formano bolle in un bicchiere pieno d’acqua durante la notte
Solubilità dei gas nell’acqua
L’acqua che esce dai rubinetti viaggia attraverso i tubi prima di raggiungere grandi serbatoi. Ecco perché l’acqua è ad una pressione più alta del normale (mentre è nei tubi), ed è anche più fredda. Queste due condizioni sono ideali per dissolvere alcuni gas che si trovano in abbondanza nella nostra atmosfera, tra cui azoto e ossigeno.
I gas sono più solubili in acqua a temperature più fredde
I gas, in generale, sono più solubili in acqua quando è a una temperatura più bassa. In altre parole, si può dire che la solubilità dei gas in acqua diminuisce all’aumentare della temperatura dell’acqua. Il grafico qui sotto dovrebbe aiutare a visualizzare come la solubilità dei gas varia al variare della temperatura.
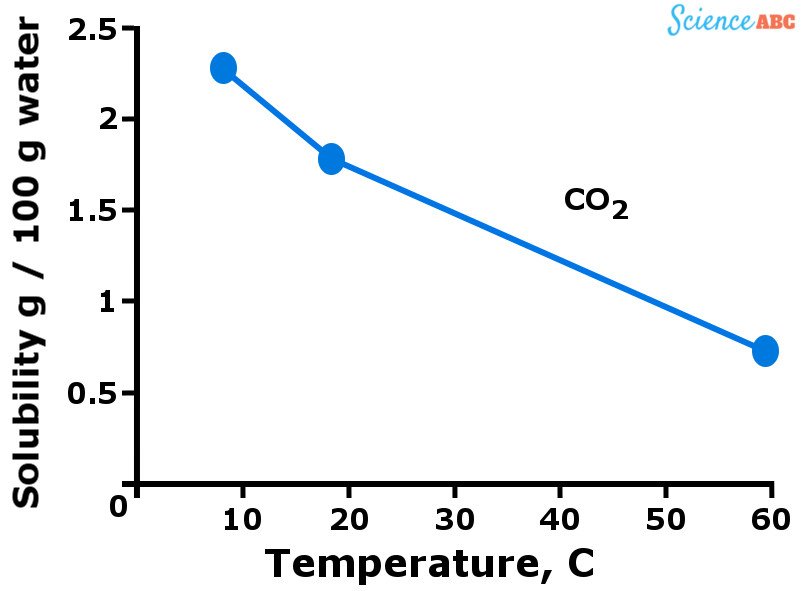
La variazione della solubilità dell’anidride carbonica in acqua all’aumentare della temperatura
La tendenza al ribasso della solubilità dei gas all’aumentare della temperatura è abbastanza simile a come la pressione del vapore aumenta con la temperatura. Vedete, più molecole di gas sono dissolte in acqua quando è fredda. Tuttavia, quando l’acqua comincia a scaldarsi (cioè, la temperatura aumenta), anche l’energia cinetica delle molecole di gas aumenta.
Questo permette a quelle molecole di muoversi più liberamente e di rompere i legami intermolecolari che le tengono insieme, uscendo così dalla soluzione. Ecco perché la solubilità dei gas diminuisce all’aumentare della temperatura.
Pericolo per la vita acquatica dovuto al cambiamento della temperatura dell’acqua
La dipendenza dalla temperatura della solubilità dei gas in acqua ha un’implicazione diretta sulla vita delle creature acquatiche. Vedete, le creature acquatiche come i pesci hanno bisogno di ossigeno per sopravvivere, e lo ottengono dall’acqua in cui vivono assorbendo l’ossigeno disciolto (nell’acqua) attraverso le loro branchie. Dato che l’ossigeno è più solubile nelle acque più fredde, è fondamentale che la temperatura non aumenti oltre un certo limite.

I prodotti di scarto rilasciati dalle centrali elettriche aumentano la temperatura dell’acqua, mettendo così in pericolo la vita marina (Photo Credit : Flickr)
Tuttavia, questo è esattamente quello che sta succedendo in questi giorni, in gran parte a causa delle attività umane. Le centrali elettriche, per esempio, scaricano enormi volumi di acqua calda in grandi corpi d’acqua, che poi aumentano la temperatura dell’acqua e hanno un impatto drastico sulla vita acquatica. Questo è un risultato molto indesiderabile di tale dipendenza dalla temperatura della solubilità dei gas.
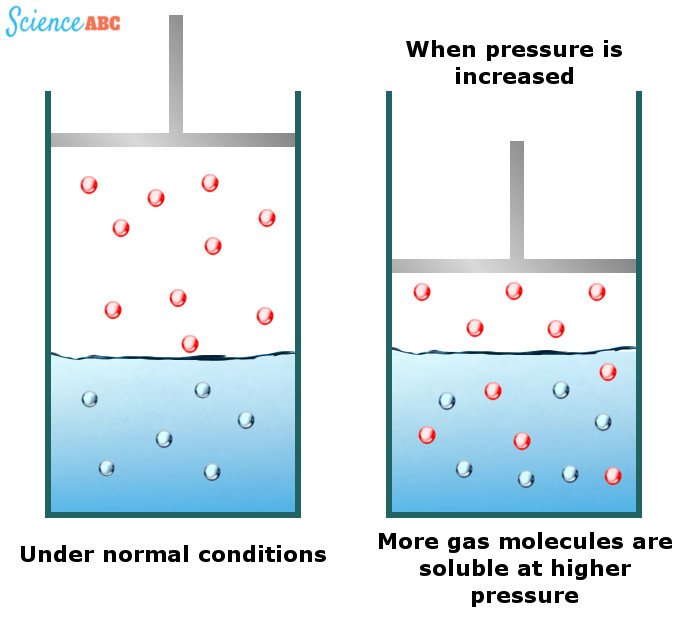
La solubilità dei gas nell’acqua aumenta con l’aumentare della pressione
Anche se i liquidi e i solidi non mostrano praticamente nessun cambiamento di solubilità al variare della pressione dell’acqua, i gas sì. È stato osservato che i gas sono più solubili in acqua a pressioni più elevate. Le bevande gassate sono esempi eccellenti di questo fenomeno.
La legge di Henry
Gli effetti del cambiamento della pressione dell’acqua sulla solubilità dei gas possono essere spiegati da una delle leggi dei gas conosciuta come legge di Henry. Essa afferma che “la quantità di gas dissolto è proporzionale alla sua pressione parziale nella fase gassosa”
Il modo più semplice per spiegare questa dipendenza è che quando la pressione aumenta, le molecole di gas sono forzate nella soluzione in modo che la pressione applicata possa essere alleggerita. La seguente immagine dovrebbe aiutare a visualizzare meglio ciò:
Perché si formano bolle in un bicchiere pieno d’acqua durante la notte
A causa dei due fenomeni fisici che abbiamo discusso sopra, l’acqua del rubinetto diventa un buon candidato (se non ideale) per contenere i gas atmosferici dissolti. Tuttavia, quando quell’acqua viene versata in un bicchiere e lasciata per qualche ora a temperatura ambiente, la sua pressione comincia a diminuire, mentre la sua temperatura comincia a salire.

Piccole bolle si formano in un bicchiere d’acqua durante la notte (Photo Credit : )
Questo fa sì che i gas dissolti nell’acqua escano dalla soluzione e formino bolle sui punti ruvidi all’interno del bicchiere. Poiché lo spostamento di temperatura non è così rapido (nel senso che l’acqua non passa da fredda a bollente in pochi minuti), ci vogliono alcune ore prima che le bolle comincino ad apparire sul vetro.