INTRODUZIONE
Secondo Torrent-Guasp e altri autori,1-6 il miocardio ventricolare consiste in una banda continua di muscoli che si estende dalla radice dell’arteria polmonare alla radice aortica, formando una struttura elicoidale con 2 spirali e delimitando le 2 cavità ventricolari. Questa banda miocardica sarebbe composta dall'”anello basale” e dall'”anello apicale”. L’ansa basale è prevalentemente orizzontale e si divide in segmenti destro e sinistro; l’ansa apicale è prevalentemente verticale e consiste nel segmento discendente e nel segmento ascendente (Figura 1). L’eiezione sarebbe prodotta dalla successiva contrazione dei segmenti basale destro e basale sinistro, che porta a un restringimento della base del cuore, seguito dalla contrazione del segmento apicale discendente. Questo, a sua volta, produce un accorciamento delle dimensioni longitudinali del cuore, avvicinando la base all’apice. Il riempimento ventricolare inizierebbe con la contrazione del segmento apicale ascendente, accompagnato dall’allungamento longitudinale e seguito dal rilassamento delle pareti ventricolari. Durante il ciclo cardiaco, l’apice rimane fermo, mentre la base si muove verso il basso, causa principale dell’accorciamento longitudinale e dell’espulsione del sangue, seguita da un altro movimento verso l’alto a cui si attribuisce l’aspirazione del sangue dall’atrio sinistro.7-9
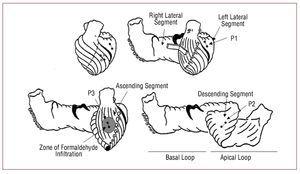
Figura 1. Diagrammi che mostrano i segmenti della banda miocardica (Torrent-Guasp) e la posizione delle coppie di cristalli impiantati nel miocardio, rappresentati come piccoli cerchi collegati da una linea. Nel diagramma in alto a sinistra, i cristalli corrispondenti al subendocardio P2 (nel segmento discendente dell’ansa apicale) sono rappresentati da cerchi aperti.
Nella dottrina classica, il riempimento ventricolare sinistro inizia con il rilassamento ventricolare, un processo attivo che consuma energia e che riduce la pressione intraventricolare a meno di quella corrispondente all’atrio sinistro. L’incrocio delle pressioni provoca l’apertura della valvola mitrale e l’inizio del riempimento rapido precoce. I fattori che determinano questo meccanismo sono considerati il recupero elastico, che coinvolge diversi componenti come il contenuto di elastina nel collagene della matrice extracellulare,10 o la proteina titina, che restituisce forza al sarcomero per il suo recupero dopo la deformazione prodotta durante la sistole,11 e il rilassamento della parete miocardica. Emodinamicamente, questo coinvolge l’80% del volume di riempimento e si produce con un contributo quasi nullo da parte dei fattori atriali.10
Quello che è difficile da immaginare e da dimostrare è il fatto che la fase di rilassamento isovolumico e il successivo rapido riempimento siano una conseguenza della contrazione della porzione finale della fascia miocardica. Tuttavia, questo spiegherebbe perché ogni volta che si sviluppa una disfunzione sistolica, essa è accompagnata da una disfunzione diastolica, perché l’indice T (la costante di tempo della caduta della pressione durante la fase di contrazione isovolumica) dipende dalla contrattilità ed è migliorata dall’isoproterenolo,12 e anche perché la disfunzione diastolica con funzione sistolica normale o “conservata” è un’entità il cui significato, identificazione e trattamento rimangono poco chiari.13-17
Gli studi sperimentali che presentiamo qui sono stati eseguiti allo scopo di determinare i meccanismi miocardici coinvolti nel flusso transmitrale diastolico precoce. In particolare, volevamo sapere se la fase di rapido riempimento ventricolare è un processo di rilassamento o di contrazione.18 Per rispondere a questa domanda, esamineremo se la contrazione del segmento ascendente dell’ansa apicale coincide temporalmente con la cosiddetta fase di rilassamento isovolumico ventricolare sinistro e se l’induzione di ipocinesia o acinesia limitata a quel segmento ha un effetto negativo sul flusso transmitrale precoce, la velocità della caduta della pressione intraventricolare durante la fase isovolumica e la pressione minima raggiunta nel ventricolo sinistro.
METODI
Abbiamo studiato 12 maiali di entrambi i sessi con un peso medio di 28,2 (5,1) kg. Erano stati allevati nell’Unità Veterinaria del Centro di Ricerca del nostro ospedale. Gli esperimenti sono stati eseguiti in conformità con le linee guida spagnole ed europee per la “Protezione degli animali utilizzati a fini sperimentali e altri fini scientifici” (Real Decreto 223/1988 e Real Decreto 1201/2005). Le procedure chirurgiche sono state eseguite da ricercatori in possesso del certificato europeo di formazione in sperimentazione animale (Real Decreto 1201/2005).
Preparazione degli esperimenti
Il giorno dell’esperimento, gli animali vengono preanestetizzati e sedati nelle loro stalle mediante iniezione intramuscolare di midazolam (0,5 mg/kg di peso corporeo) e ketamina (10 mg/kg di peso corporeo). L’anestesia viene indotta nella sala operatoria sperimentale per via endovenosa (tiopental, 10 mg/kg di peso corporeo), e vengono effettuati l’intubazione endotracheale e il cateterismo della vena giugulare esterna. L’anestesia viene mantenuta con sevoflurano (2,5%) in una miscela di 40% di ossigeno e 60% di protossido d’azoto, erogata per mezzo di un ventilatore (Temel VT3, Spagna). L’analgesia e il rilassamento sono iniziati con vecuronio bromuro (0,08 mg/kg di peso corporeo) e morfina cloridrato (0,7 mg/kg di peso corporeo) e sono mantenuti con vecuronio bromuro (0,08 mg/kg di peso corporeo) e 20 mg di morfina cloridrato in 50 mL di siero in una pompa di infusione ad un tasso di 12 mL/h. Viene eseguita una sternotomia mediana, seguita da una pericardiectomia. La ventilazione meccanica è regolata a un tasso tra 16 e 20 respiri al minuto e a un flusso di gas di circa 5 L/min, a seconda delle ossimetrie nel sangue. L’elettrocardiogramma periferico, il pH del sangue, i gas del sangue, l’ematocrito e la temperatura rettale sono monitorati durante l’intero esperimento. La temperatura viene mantenuta con una coperta elettrica.
Funzione segmentaria
Tre coppie di microcristalli a ultrasuoni (Biopac Systems, Santa Barbara, California, USA) sono impiantate nel miocardio: una coppia nel mesocardio (ad una profondità di circa 4 a 5 mm) della faccia laterale del ventricolo sinistro corrispondente all’ansa basale, segmento laterale sinistro (P1), seguendo la direzione dell’asse longitudinale del cuore; un’altra coppia nel subendocardio della faccia anteriore del terzo medio del ventricolo sinistro, tra il primo e il secondo ramo diagonale dell’arteria discendente anteriore e tangenziale ad esso, una zona corrispondente al segmento discendente dell’ansa apicale (P2); e, infine, un’altra coppia nel sottoepicardio (a una profondità da 1 a 2 mm) della faccia anteriore del ventricolo sinistro, tra il primo e il secondo ramo diagonale dell’arteria discendente anteriore e parallelo all’arteria discendente anteriore verso la radice aortica, in una zona corrispondente al segmento ascendente dell’ansa apicale (P3) (Figura 1). Le coppie di microcristalli sono allineate seguendo la direzione delle fibre muscolari della zona in cui si trovano. Sono separati da circa 2 cm. Le coppie P2 vengono ancorate nel sottoendocardio mediante puntura transettale, raggiungendo la cavità ventricolare e ritraendole per depositarle nel sottoendocardio, formando una croce con le coppie P3 nel sottoepicardio. Le coppie di cristalli ci permettono di conoscere lo spostamento relativo dei 2 punti del miocardio sui quali sono fissati e, quindi, le proprietà dinamiche del segmento contenuto tra loro. L’acquisizione delle curve di contrattilità miocardica regionale si ottiene con il sistema di misurazione ultrasonica digitale Sonometrics Corporation (London, Ontario, Canada).
Pressioni intracavitarie
Un catetere viene inserito attraverso la parete libera ventricolare sinistra per monitorare la pressione ventricolare sinistra e un altro viene inserito attraverso l’auricola per misurare la pressione atriale sinistra; entrambi i cateteri sono collegati a trasduttori di pressione (Transpac IV, USA).
Flusso aortico
La radice aortica è sezionato e un misuratore di flusso elettromagnetico è posto (Transonic Systems, New York, Stati Uniti).
Flusso transmitrale
È stato eseguito un ecocardiogramma Doppler (Interspec XL Doppler, USA) con una sonda 5-MHz, direttamente sopra l’epicardio, per registrare il flusso transmitrale da una vista apicale a quattro camere, prima in condizioni di base e poi dopo l’iniezione di formaldeide diluita nella parete miocardica.
Induzione di akinesi segmentale
Questo comporta iniezioni di formaldeide19 diluito al 2,5%, utilizzando un ago atraumatico, nel sottoepicardio (ad una profondità di 1 a 2 mm) del segmento ascendente del ciclo apicale, dove le coppie P2 di cristalli sono situati. Si inietta un massimo di 0,8 mL della diluizione indicata, distribuiti tra 3 e 4 iniezioni. Dopo ogni iniezione, l’effetto prodotto sulla frazione di accorciamento del segmento viene monitorato fino al raggiungimento di acinesia o discinesia nel segmento dato.
Raccolta dati
Le registrazioni corrispondenti a: ECG (I, II o III), pressione ventricolare sinistra in mm Hg, pressione atriale sinistra in mm Hg, flusso aortico (mL/min) e dati sonometrici dei 3 segmenti di banda miocardica indicati sono digitalizzati e conservati in una memoria elettronica (BIOPAC Systems Inc, Santa Barbara, California, Stati Uniti). Le curve di velocità del flusso transmitrale e i valori ottenuti con l’ecocardiografia Doppler (m/s) vengono memorizzati separatamente.
Una volta completati gli esperimenti, gli animali vengono sacrificati sotto anestesia mediante un’iniezione endovenosa di cloruro di potassio. Dopo la rimozione della struttura anatomica (il cuore), viene verificato il sito anatomico delle 3 coppie di cristalli, viene sezionata la parete ventricolare anteriore sinistra, seguendo il percorso dell’arteria interventricolare, e viene verificata la profondità alla quale ogni cristallo è impiantato, così come la regione del muscolo infiltrata con formaldeide.
Parametri analizzati
Nell’ecocardiogramma Doppler, si studiano le velocità massime del flusso transmitrale all’inizio (E) e alla fine (A) della diastole e il rapporto E/A. Le curve di pressione intracavitaria forniscono la massima pressione sistolica ventricolare sinistra, la minima pressione ventricolare sinistra, la pressione end-diastolica ventricolare sinistra (LVEDP), il tempo trascorso dalla chiusura della valvola aortica fino alla pressione intraventricolare supera la pressione end-diastolica di 10 mm Hg, che corrisponde al tempo di rilassamento isovolumico12; a questo punto, possiamo essere sicuri che questa è la fase isovolumica con la valvola mitrale ancora chiusa. Le curve di funzione segmentale rivelano la frazione di accorciamento, e le curve di flusso aortico mostrano il flusso aortico medio e la relazione temporale tra la fine della contrazione di ciascuno dei tre segmenti (P1, P2, e P3) e la sospensione del flusso aortico (tempo chiusura aortica-contrazione P1, P2, P3). Tutti questi parametri sono analizzati prima e dopo l’iniezione di formaldeide nel segmento ascendente. La frazione di accorciamento viene misurata dopo ogni iniezione di formaldeide fino a verificare un cambiamento adeguato nel segmento iniettato.
Analisi dei risultati
Le variabili studiate sono continue, e i risultati sono espressi come media più o meno la deviazione standard. Sono stati studiati i cambiamenti nelle variabili dopo il blocco con formaldeide rispetto alle condizioni di base. Il confronto delle medie è stato effettuato utilizzando il test t di Student per campioni appaiati o il test non parametrico di Mann-Whitney per i dati che non mostravano una distribuzione normale. Un valore P inferiore a .05 è stato considerato significativo. È stato utilizzato il pacchetto statistico SPSS (versione 9.0).
RISULTATI
Cambiamenti emodinamici (Tabella 1)
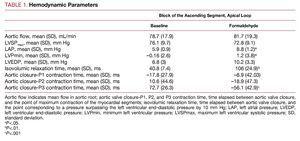
L’iniezione di formaldeide prolunga significativamente il tempo necessario per superare la pressione end-diastolica ventricolare sinistra di 10 mm Hg dopo la chiusura della valvola aortica, aumenta la pressione ventricolare sinistra minima che viene raggiunta all’inizio della diastole, passando da pressioni negative a positive, alza – anche se non in modo molto significativo – la LVEDP e aumenta significativamente la pressione atriale media. Non ci sono cambiamenti significativi immediati nel flusso aortico o nella pressione ventricolare sinistra durante la sistole (Figura 2).
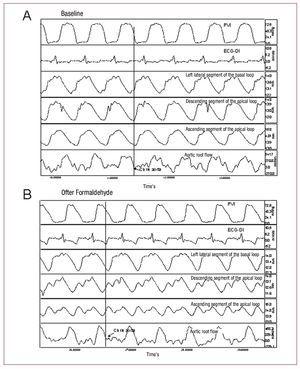
Figura 2. Registrazione della pressione ventricolare sinistra (PVI); elettrocardiogramma (ECG-DI); contrattilità segmentale nel segmento laterale sinistro dell’ansa basale, segmento discendente dell’ansa apicale e segmento ascendente dell’ansa apicale; e flusso della radice aortica in condizioni basali (A) e dopo l’iniezione di formaldeide (B). Le frecce indicano i punti corrispondenti alla chiusura della valvola aortica. I cambiamenti indotti dall’iniezione di formaldeide sono descritti nel testo.
Fine della contrazione miocardica e inizio della diastole
Per determinare l’inizio della fase di rilassamento isovolumico, abbiamo identificato il momento in cui l’espulsione di sangue cessa nella curva del flusso aortico e la fase di contrazione segmentale nelle curve sonometriche corrispondenti (Figura 2).
In tutti gli esperimenti, il segmento ascendente (P3) era in contrazione dopo la cessazione del flusso aortico e la chiusura della valvola aortica. La contrazione dell’ultimo segmento miocardico si è conclusa in un tempo medio di 72.7 (26.3) ms dopo la chiusura della valvola aortica, in coincidenza con la cosiddetta fase di rilassamento isovolumico nella diastole iniziale (Figura 2), mentre il segmento discendente (P2) ha raggiunto la contrazione massima 10.6 (44.6) ms dopo la chiusura della valvola aortica, e la fine della contrazione del segmento P1 (ciclo basale) ha preceduto la chiusura della valvola aortica (Tabella 1).
Flusso trasmissivo
La tabella 2 mostra l’effetto prodotto nella frazione di accorciamento del segmento monitorato dall’iniezione di formaldeide nel segmento ascendente dell’ansa apicale. C’è una diminuzione a livelli di discinesia (secondo il protocollo) nel segmento iniettato (P3, segmento ascendente) e ipocinesia nel segmento vicino, il segmento discendente (P2) dell’ansa apicale. Le zone corrispondenti al segmento laterale sinistro dell’ansa basale (P1) non sono alterate. Parallelamente, il flusso transmitrale è interessato, con cambiamenti nei tassi di riempimento ventricolare nella diastole precoce e nel rapporto E/A; l’onda E è diminuita all’aumentare dell’onda A, il rapporto E/A è significativamente ridotto (P
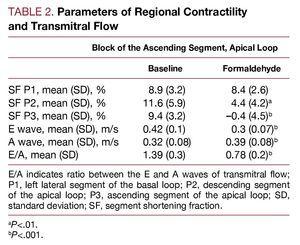
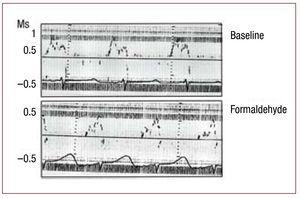
Figura 3. Cambiamenti immediati nella portata trasmissiva, misurata mediante ecocardiografia Doppler, secondaria all’infiltrazione con formaldeide al 2,5% nel segmento ascendente dell’ansa apicale. Figura corretta per la riproduzione.
DISCUSSIONE
Quando il ventricolo cessa di espellere il sangue, la sistole finisce e inizia la diastole. Da questo momento, e fino all’apertura della valvola mitrale, c’è un periodo di tempo durante il quale entrambe le valvole sono chiuse, che è noto come fase di rilassamento isovolumico. Durante questa fase, la pressione intraventricolare scende ad un ritmo costante12 e porta a gradienti di pressione transmurali e transvalvolari verso l’interno della camera. Si produce un effetto di aspirazione, al quale viene immediatamente attribuita la rapidità del riempimento ventricolare precoce e la cui perdita totale o parziale è causa della disfunzione diastolica ventricolare sinistra, il substrato fisiopatologico dell’insufficienza cardiaca con funzione sistolica conservata.
Nella pratica clinica,16,20,21 la diagnosi di insufficienza cardiaca dovuta a disfunzione diastolica dipende da 3 condizioni: la presenza di segni o sintomi di insufficienza cardiaca, una frazione di eiezione ventricolare sinistra normale o leggermente diminuita, e un aumento della pressione di riempimento ventricolare sinistra. Quest’ultimo fattore ha un impatto e può essere misurato nella curva di riempimento ventricolare sinistro dell’ecocardiogramma Doppler, nel prolungamento del periodo di rilassamento isovolumico, nella diminuzione della velocità diastolica iniziale (E), nel prolungamento del tempo di decelerazione, nell’aumento della velocità end-diastolica (A) e nella riduzione del rapporto E/A.
Il riempimento ventricolare, che identifica il tempo diastolico, è stato attribuito alla contrazione atriale fino al 1954.3,4 È ormai accettato che il ventricolo sinistro partecipa attivamente con la forza di aspirazione di cui abbiamo parlato sopra. Si tratta di un processo attivo22,23 che consuma energia e coinvolge lo scambio di Ca2+. Alcuni autori considerano la diastole come una conseguenza dell’allungamento delle fibre miocardiche delle pareti di una camera chiusa. Sarebbe un fenomeno legato al rilassamento muscolare (separazione dei filamenti di miosina) e al recupero elastico delle fibre, in cui interviene l’elastina contenuta in una rete di collagene che costituisce il tessuto connettivo extrafibrillare, nonché la proteina titina come elemento di recupero del sarcomero deformato durante la sistole.10,11 L’attivazione meccanica ventricolare durante la diastole è eterogenea, con gradienti di rilassamento subendocardico-subepicardico all’inizio della diastole.22,24,25
Nella teoria di Torrent-Guasp, è un fenomeno sistolico legato alla contrazione muscolare.23,26 L’espulsione del sangue è una conseguenza della contrazione del segmento discendente dell’ansa apicale; la sua contrazione “avvita” la base sull’apice, avvicinando le 2 parti. Il prossimo e ultimo segmento della fascia muscolare è il segmento ascendente dell’ansa apicale, che copre il segmento discendente, formando l’epicardio della faccia anteriore fino alla radice aortica, e che è stato “allungato e arrotolato” dalla contrazione del segmento precedente. Quando si contrae, il segmento ascendente compie un movimento che “svita” la base, allontanandola dall’apice, aumentando l’asse longitudinale del cuore e producendo un risucchio come quello che avverrebbe all’interno di un cilindro che si allontana dal suo pistone, dinamiche che sono state osservate nell’uomo in immagini di risonanza magnetica.27
In questo studio, abbiamo contribuito con dati che dimostrano che la forza di aspirazione prodotta durante la fase di rilassamento isovolumico dipende dalla contrazione perché è prodotta durante la fase di contrazione segmentale e, inoltre, che la sua funzionalità è fortemente legata alla contrazione del segmento ascendente dell’ansa apicale, in particolare:
1. Abbiamo dimostrato che, all’inizio e durante la fase di rilassamento isovolumico del ventricolo sinistro, il segmento ascendente dell’ansa apicale si contrae.
2. L’infiltrazione del segmento ascendente dell’ansa apicale con formaldeide diluita influenza direttamente la capacità di ridurre la pressione intraventricolare o, in altre parole, la forza di aspirazione. Questo aspetto è stato dimostrato dal prolungamento del tempo necessario affinché la pressione intraventricolare scenda a 10 mm Hg al di sopra della pressione end-diastolica, un livello che ci permette di garantire che la valvola mitrale sia ancora chiusa e che la minore velocità (cioè il maggior tempo trascorso) nella caduta della pressione sia in una camera chiusa (isovolumica). È stato anche dimostrato dalla minore pressione minima intraventricolare raggiunta nella prima diastole, che è significativamente influenzata quando infiltriamo detto segmento ascendente.
3. Come conseguenza di una minore velocità di caduta e di una diminuzione finale meno marcata della pressione intraventricolare durante la fase isovolumica, l’effetto di aspirazione è minore e la velocità di riempimento ventricolare diminuisce durante la diastole iniziale, aumentando in compensazione durante la diastole finale, come conseguenza di una contrazione dell’atrio sinistro più “pieno”. Questo è stato dimostrato dai cambiamenti nei valori di E, A, e il rapporto E/A, così come l’aumento progressivo della pressione atriale che inizia nella diastole iniziale.
Limitazioni dello studio
L’uso dei cristalli ultrasonici è appropriato se si assume che la struttura del miocardio è organizzata parzialmente o totalmente in una banda e che abbiamo impiantato i cristalli ultrasonici nella stessa linea che segna la direzione del movimento delle fibre. Questo metodo non è in grado di isolare la funzione di un singolo segmento, poiché fa parte dello stesso continuum degli altri. Così, l’alterazione di un qualsiasi segmento cambierebbe la contrazione in tutta la banda, come avviene nel nostro modello, in cui l’iniezione nel segmento ascendente modifica significativamente anche la contrazione delle fibre contenute in P2, identificate come appartenenti al segmento discendente, che confina con il segmento iniettato.
Per l’identificazione dei segmenti e la direzione delle loro fibre, così come la conferma post mortem nei campioni anatomici, siamo stati consigliati dal dottor Torrent-Guasp. Le fibre subendocardiche del segmento discendente nella zona della faccia anteriore del ventricolo sinistro attraversano il mesocardio ad una certa profondità, incrociandosi perpendicolarmente con quelle del segmento ascendente,28 circostanza che abbiamo confermato nei campioni anatomici. Per questo motivo, i cristalli ancorati nel sottoendocardio seguivano una direzione che la coppia impiantata nell’epicardio corrispondente (segmento ascendente) attraversava perpendicolarmente.
Il coinvolgimento muscolare secondario all’iniezione di formaldeide diluita è difficile da standardizzare e, naturalmente, colpisce tutte le proprietà attive e passive della fibra, riducendo contrazione, rilassamento ed elasticità ai loro limiti minimi. Si è cercato di minimizzare i cambiamenti prodotti dalla formaldeide, limitando la quantità e il numero di iniezioni in tutti gli esperimenti, e monitorando l’effetto in funzione dell’alterazione della contrattilità del segmento iniettato e verificando il cambiamento del flusso transmitrale. Per molti ricercatori, le teorie del dottor Torrent-Guasp hanno aperto delle strade da seguire per progredire nella comprensione della fisiologia del muscolo cardiaco. Altri punti continuano ad essere difficili da conciliare con i dati precedenti.18
CONCLUSIONI
In questa nuova concezione della funzione diastolica, parteciperebbero le 3 proprietà delle fibre miocardiche, seguendo un certo ordine e, allo stesso tempo, sovrapponendosi. L’aspirazione iniziale con la camera chiusa sarebbe una conseguenza della contrazione dell’ultimo segmento della fascia, come abbiamo cercato di dimostrare con gli esperimenti qui presentati; il rilassamento delle fibre dei segmenti successivi con la valvola mitrale aperta permetterebbe un riempimento rapido e, infine, la distensibilità renderebbe possibile il cedimento della parete miocardica in risposta all’aumento di pressione/volume prodotto dall’iniezione nell’atrio.
Riconoscimenti
Questo studio è stato realizzato in memoria del dottor Francisco Torrent-Guasp.
Questo studio è stato finanziato dalla sovvenzione n. 99/1002 del Fondo de Investigaciones Sanitarias (FIS) spagnolo.