- Cavità assiali senza cromatina appaiono in piante con contenuto medio di DNA 2C superiore a 0.8 pg per cromosoma
- La condensazione/decondensazione dei cromosomi può essere visualizzata in sezioni semisottili di N. damascena dopo la colorazione con 4′,6-diamidino-2-fenilindolo (DAPI)
- Condensazione cromosomica durante la mitosi analizzata dopo l’incorporazione di 5-etinil-2′-deossiuridina (EdU)
- Condensazione cromosomica durante la mitosi analizzata dalla microscopia elettronica
Cavità assiali senza cromatina appaiono in piante con contenuto medio di DNA 2C superiore a 0.8 pg per cromosoma
Cromatidi anafase e telofase di alcune piante contengono cavità senza cromatina nelle regioni assiali, che distinguono queste piante dalla maggior parte delle altre piante e animali studiati fino ad oggi (Fig. 1a, b). A nostra conoscenza, i rapporti che descrivono tale organizzazione cromosomica sono limitati a piante con grandi genomi, e si può supporre che tale organizzazione morfologica sia una caratteristica specifica per queste piante. Per accertare questo suggerimento, abbiamo anche analizzato cromatidi anafase e telofase da 12 specie utilizzando la microscopia elettronica (Tabella 1; Fig. 1a, b; Additional file 1: Figura S1). La figura 1c dimostra che le cavità assiali prive di cromatina erano chiaramente visibili solo all’interno dei cromosomi delle piante con genomi grandi e con cromosomi grandi, ma sembrava che la dimensione media dei cromosomi fosse meglio correlata alla presenza o all’assenza di queste cavità. Tra le piante con cavità assiali, Hordeum vulgare aveva il genoma più piccolo e il più piccolo contenuto medio di DNA 2C per cromosoma (0,79 pg). Quindi, questa organizzazione cromosomica è una caratteristica dei cromosomi delle piante il cui contenuto di DNA 2C può essere stimato approssimativamente come superiore a 0,8 pg per cromosoma.
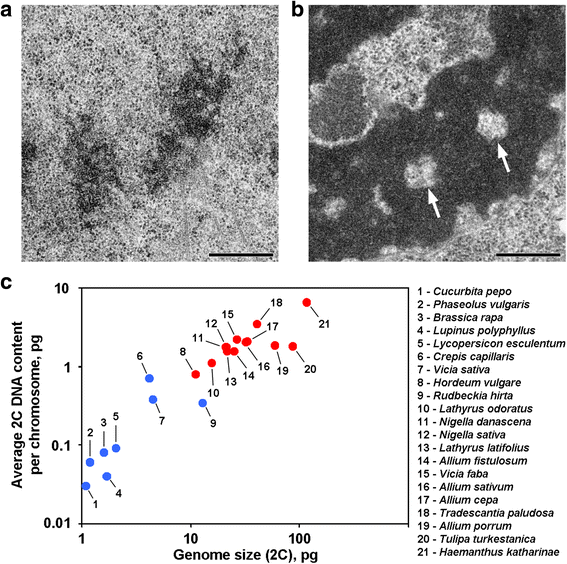
Due varianti di organizzazione cromosomica nelle piante. a Cromosomi in telofase del fagiolo comune (Phaseolus vulgaris) come esempio di cromosomi senza cavità assiali senza cromatina. b Cromosomi in telofase di N. damascena con cavità assiali senza cromatina chiaramente visibili (frecce). c La presenza di cavità assiali senza cromatina dipende dal genoma e dalle dimensioni del cromosoma. I punti blu rappresentano piante in cui i cromosomi non contengono cavità senza cromatina assiale; i punti rossi rappresentano piante in cui i cromosomi contengono cavità senza cromatina assiale. Barra della scala: 0.5 μm
La condensazione/decondensazione dei cromosomi può essere visualizzata in sezioni semisottili di N. damascena dopo la colorazione con 4′,6-diamidino-2-fenilindolo (DAPI)
L’oggetto più conveniente per lo studio dei cromosomi vegetali, il meristema apicale delle radici, non permette l’acquisizione di immagini ad alta risoluzione a causa della fluorescenza fuori fuoco. Qui, abbiamo usato un metodo basato sull’applicazione di sezioni semi-sottili (200-250 nm) di radici incorporate in LR White medium. Lo spessore di queste sezioni era significativamente inferiore a quello delle sezioni ottiche anche se veniva usato un microscopio confocale. Per trovare le caratteristiche morfologiche che ci hanno permesso di identificare le cellule in diverse fasi mitotiche, abbiamo analizzato la morfologia delle cellule colorate con DAPI.
C’erano diverse trasformazioni dell’organizzazione cromosomica di N. damascena che erano facilmente visibili anche al microscopio a fluorescenza. All’interno dei primi nuclei in profase, erano visibili parti di cromosomi sottili (circa 0,6 μm di diametro) (Fig. 2a). A metà della profase, si sono formati cromosomi più spessi (circa 1,2 μm), all’interno dei quali è stato possibile distinguere la presenza di fibre più sottili, che probabilmente corrispondevano ai cromosomi piegati della prima profase (Fig. 2b). I cromosomi della tarda profase (Fig. 2c), della metafase (Fig. 2d) e dell’anafase (Fig. 2e) erano densamente condensati e non è stata rilevata alcuna organizzazione interna. Durante la decondensazione in telofase, la separazione delle fibre di cromatina con un diametro di circa 0,4 um ha portato alla comparsa di cavità senza cromatina nelle regioni assiali dei cromatidi (Fig. 2f), la cui dimensione è stata gradualmente aumentata durante la telofase (Fig. 2g e h). Il diametro delle fibre di cromatina nei cromosomi della telofase era paragonabile alle dimensioni dei cromosomi della prima fase della profase. Così, tutte le fasi mitotiche di N. damascena sono state facilmente rilevate in sezioni semi-sottili colorate con DAPI.
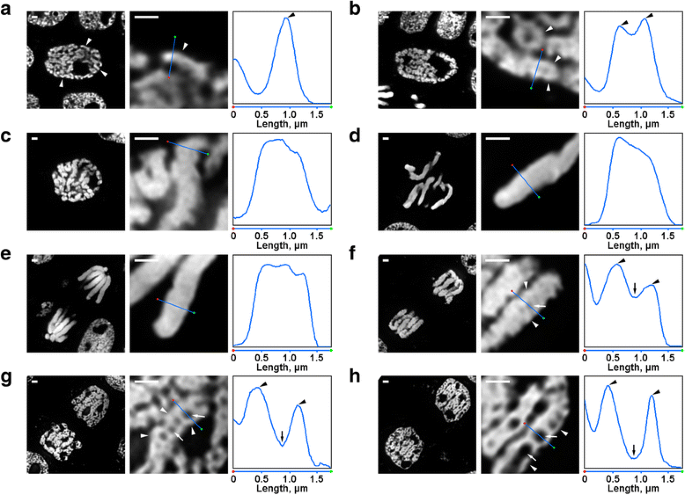
Morfologia dei cromosomi mitotici di N. damascena. I pannelli sinistro e centrale rappresentano immagini di microscopia a fluorescenza di sezioni semisottili colorate con DAPI (vista generale e frammento); il pannello destro rappresenta un grafico di densità attraverso la linea nei pannelli centrali. a Profase iniziale (i cromosomi sono indicati dalle punte di freccia). b Profase media (le fibre che formano i cromosomi, che sembrano corrispondere ai cromosomi della profase precoce, sono indicate dalle punte di freccia). c Profase tardiva. d Metafase. e Anafase. f Telofase precoce (le cavità assiali prive di cromatina sono indicate dalle frecce, le fibre che formano i cromosomi della telofase sono indicate dalle punte di freccia). g Telofase tardiva. h G1-fase. Barre di scala: 1 μm
Condensazione cromosomica durante la mitosi analizzata dopo l’incorporazione di 5-etinil-2′-deossiuridina (EdU)
Durante la profase, i cromosomi sottili della prima profase sono stati trasformati in cromosomi spessi della tarda profase. L’ispessimento dei cromosomi della profase può essere il risultato del ripiegamento dei cromosomi della prima profase o il risultato del loro graduale ispessimento. Per indagare questi due possibili meccanismi, è stato necessario contrassegnare i focolai cromosomici discreti che erano linearmente disposti all’interno dei cromosomi della prima fase e poi analizzare i loro riarrangiamenti spaziali durante la condensazione della profase. Come illustrato in Fig. 3a, durante la transizione dalla prima alla tarda profase, tali foci perderebbero la disposizione lineare (ripiegamento) o manterrebbero la disposizione lineare e allungherebbero i foci in bande sottili (ispessimento). Per etichettare le regioni cromosomiche, abbiamo incorporato il nucleotide sintetico, EdU, che può essere rilevato dalla chimica del click, nella cromatina durante la replicazione.
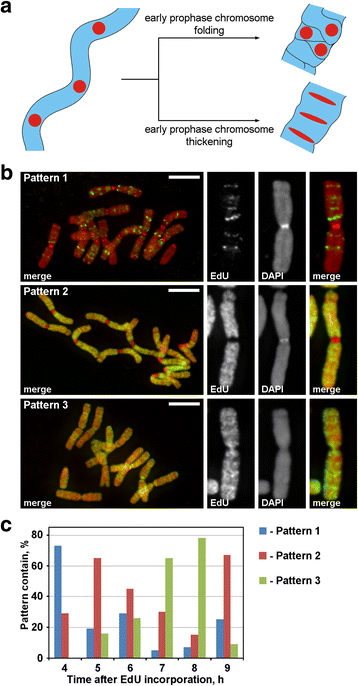
Etichettatura dei cromosomi con EdU. a La localizzazione e la morfologia delle regioni etichettate hanno rivelato il principio della condensazione dei cromosomi in profase. Linearmente disposti, regioni cromosomiche etichettati durante la transizione dalla profase precoce alla tarda avrebbe perso la disposizione linearità (ripiegamento) o mantenere la disposizione lineare (ispessimento). b Tre modelli di incorporazione EdU sono stati rilevati nei cromosomi: etichettatura di regioni discrete (modello 1), etichettatura di braccia cromosomiche, ma non centromeri (modello 2) e l’etichettatura di entrambe le braccia cromosomiche e centromeri (modello 3). c Frequenze di diversi modelli di etichettatura a diversi punti di tempo dopo incorporazione EdU. Barre di scala: 5 μm
EdU è stato incorporato per 30 min nelle radici di N. damascena, e dopo diversi periodi di inseguimento (da 2 a 14 h), i cromosomi si sono diffusi. Tre modelli di etichettatura cromosomica sono stati rilevati: etichettatura di regioni discrete (modello 1), etichettatura di braccia cromosomiche ma non centromeri (modello 2) e l’etichettatura di entrambe le braccia cromosomiche e centromeri (modello 3) (Fig. 3b). Il modello 1 è stato osservato più spesso a 4 ore dopo l’incorporazione di EdU, indicando che tale etichettatura era tipica per la tarda fase S (Fig. 3c; Additional file 2: Figura S2). Nel caso del modello 1, l’etichettatura dei cromosomi omologhi era simile (Additional file 3: Figura S3), indicando un modello specifico di incorporazione EdU. I bracci cromosomici sono stati etichettati durante il resto della fase S (modelli 2 e 3), ma le regioni centromeriche sono stati etichettati anche circa al confine tra l’inizio e la fine della fase S (modello 3) (Fig. 3c).
Abbiamo analizzato le transizioni dall’inizio alla fine della profase utilizzando cromosomi in cui la cromatina tardiva-replicazione è stata etichettata (modello 3). Nei primi cromosomi della profase, le regioni etichettate erano distribuite linearmente lungo i cromosomi sottili (Fig. 4a). Nei cromosomi della tarda profase, che erano all’incirca due volte più spessi di quelli della prima profase, le regioni etichettate hanno perso la linearità della distribuzione (Fig. 4b). Questa osservazione non era completamente valida in quanto i cromosomi in profase e metafase sono costituiti da due cromatidi, che gradualmente segregano, e questo può portare ad una perdita della linearità della distribuzione delle regioni etichettate. Pertanto, abbiamo ulteriormente analizzato i cromatidi dell’anafase (cioè, cromosomi completamente compattati dopo la segregazione dei cromatidi). In cromatidi anafase con un diametro approssimativamente uguale al diametro dei cromosomi tardo-profase, le regioni cromatina etichettati non erano linearmente disposti, ma sono stati distribuiti in tutto il volume dei cromatidi (Fig. 4c). Alla telofase, le cavità prive di cromatina erano chiaramente visibili nelle regioni assiali dei cromatidi, permettendo il rilevamento delle fibre di cromatina all’interno delle quali le regioni etichettate erano disposte linearmente (Fig. 4d). Quindi, durante la transizione dalla prima alla tarda profase, si è verificato il ripiegamento dei cromosomi della prima profase. Questo risultato è in accordo con le osservazioni dei cromosomi della profase media colorati con DAPI (Fig. 2b), all’interno dei quali erano chiaramente visibili sottili fibre ripiegate.
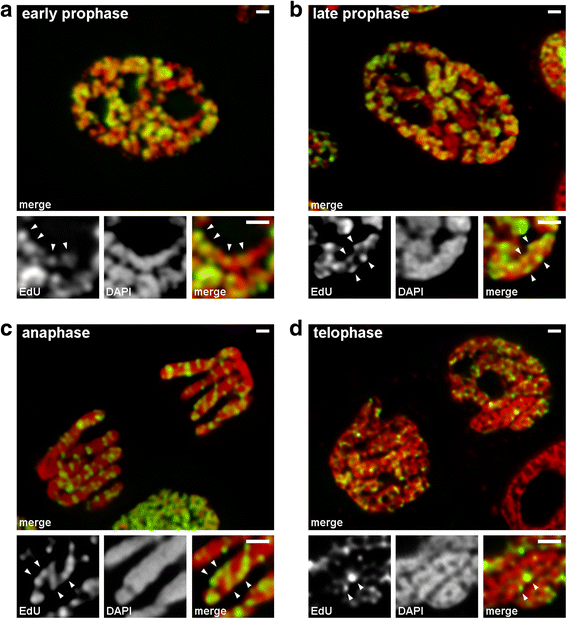
Condensazione/decondensazione dei cromosomi durante la mitosi di N. damascena (cellule mitotiche i cui cromosomi includevano EdU durante la tarda fase S). a All’inizio della profase, le regioni marcate erano distribuite linearmente in cromosomi sottili, che coprivano quasi interamente la larghezza del cromosoma. b Alla fine della profase, le regioni marcate erano sparse in tutto il volume del cromosoma. c All’anafase, il modello di marcatura era simile a quello dei cromosomi della tarda profase. d Alla tarda telofase, la decondensazione rivelava sottili fibre che formavano cromatidi all’interno dei quali le regioni marcate erano distribuite in modo simile a quello dei cromosomi della prima profase. Barre di scala: 1 μm
Condensazione cromosomica durante la mitosi analizzata dalla microscopia elettronica
Per il rilevamento dell’organizzazione interna delle fibre di cromatina, il cui ripiegamento è stato descritto utilizzando la microscopia ottica, abbiamo utilizzato la microscopia elettronica. Per rilevare e misurare le sottostrutture fibrillari della cromatina, abbiamo analizzato le cavità prive di cromatina, che separavano le fibre di cromatina come avevamo ipotizzato (Additional file 4: Figura S4; Tabella 2).
I nuclei interfasici erano pieni di una rete di fibre spesse 234 ± 49 nm (media ± S.D.) (Fig. 5a), che possono essere indicati come ‘cromonemi interfasici’, come discusso altrove. La microscopia elettronica ha permesso il rilevamento di tre fasi di condensazione cromosomica in profase, la prima delle quali non è stato possibile rilevare utilizzando la microscopia ottica, e sarà indicato qui come ‘preprofase’. Il secondo e il terzo stadio corrispondono alla prima e alla terza fase, come descritto sopra (Fig. 2a e c, rispettivamente).
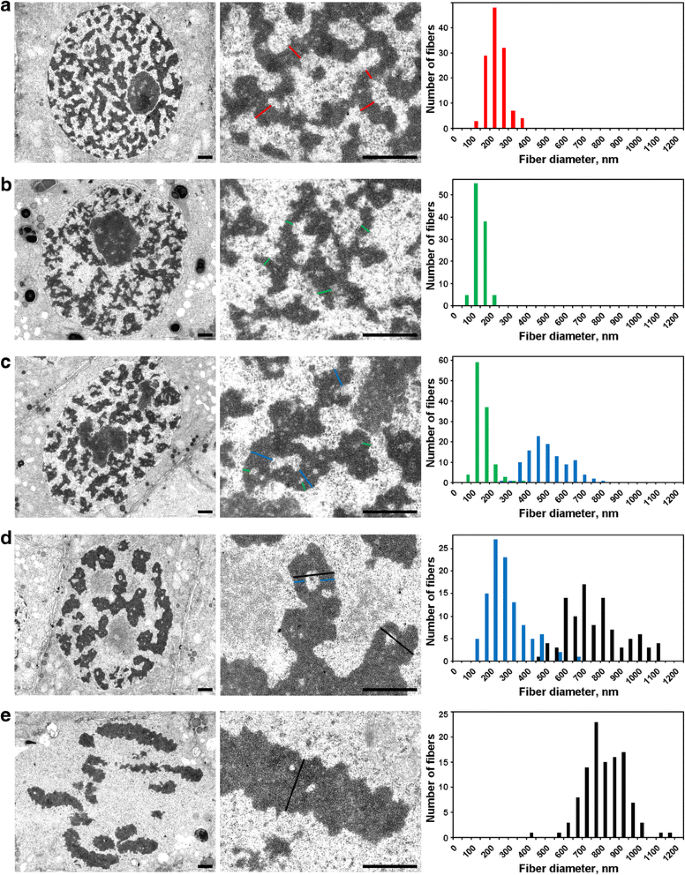
Morfometria al microscopio elettronico dei cromosomi di N. damascena: condensazione cromosomica da interfase a metafase. I pannelli di sinistra e centrale mostrano l’organizzazione ultrastrutturale (vista generale e frammento), i pannelli di destra mostrano gli istogrammi che descrivono la distribuzione della larghezza delle fibre cromosomiche e cromatiniche. a Interfase. b Preprofase. c Profase iniziale. d Profase tardiva. e Metafase. Le tipiche sezioni trasversali dei cromosomi e/o delle fibrille di cromatina sono indicate con linee colorate: rosso – cromonemi in interfase (eterocromatina), verde – cromonemi; blu – “fibre di 300 nm”; nero – cromosomi. Barre di scala: 1 μm
(1) Nella preprofase, i cromosomi erano scarsamente separati gli uni dagli altri, e non abbiamo potuto misurare accuratamente il loro diametro (Fig. 5b). I cromosomi in preprofase erano formati da fibre con un diametro di 148 ± 30 nm (Tabella 2), che molto probabilmente corrispondevano alle fibre con un diametro di 100-130 nm (cromonema), che sono la principale sottostruttura cromosomica dei cromosomi in profase e telofase nelle cellule animali. I dati non ci hanno permesso di stabilire l’identità dei cromonemi interfasici e mitotici, ma i dati precedentemente riportati indicano che i cromonemi interfasici sono complessi formati da cromonemi ripiegati.
(2) All’inizio della profase, la separazione dei cromosomi è avvenuta (Fig. 5c). Il diametro dei cromosomi era di 527 ± 107 nm, e anche questi cromosomi erano formati da cromonemi con un diametro di 158 ± 46 nm.
(3) Infine, abbiamo analizzato le cellule in tarda profase, che contenevano cromosomi ispessiti con un diametro di 809 ± 185 nm (Fig. 5d). Alcuni cromosomi in tarda profase contenevano cavità nelle regioni assiali che ci hanno permesso di distinguere le fibre con un diametro di 285 ± 102 nm (“fibra da 300 nm”). L’analisi utilizzando i segmenti di cromosoma etichettati ha dimostrato che i cromosomi della prima fase si sono piegati per formare cromosomi più spessi della tarda fase (Fig. 4). Pertanto, è possibile ipotizzare che le fibre di 285 ± 102 nm e i cromosomi di 527 ± 107 nm della prima profase fossero le stesse fibre. La diminuzione del diametro delle fibre può essere associata alla compattazione della cromatina dei cromosomi della prima profase, che era anche indicata dalla scomparsa dei cromonemi visibili.
La cromatina all’interno dei cromosomi della metafase (Fig. 5e) e dei cromatidi dell’anafase (Fig. 6a) era altamente compattata e, sebbene fossero visibili rare cavità senza cromatina al loro interno, era impossibile distinguere con precisione le sottostrutture fibrillari. Nei primi cromosomi in telofase, sono stati chiaramente rilevati due tipi di cavità (Fig. 6b). Grandi cavità si trovavano nella regione assiale dei cromatidi, permettendoci di identificare e misurare le fibre con un diametro di 422 ± 78 nm. Nelle regioni centrali di queste fibre, abbiamo rilevato piccole cavità che hanno permesso l’identificazione di un secondo tipo di fibra con un diametro di 182 ± 47 nm. Il primo tipo di fibre potrebbe corrispondere alle “fibre da 300 nm” all’interno dei cromosomi in tarda profase, il secondo tipo potrebbe corrispondere ai cromonemi.

Morfometria al microscopio elettronico dei cromosomi di N. damascena: decondensazione cromosomica dall’anafase alla fase G1. I pannelli sinistro e centrale mostrano l’organizzazione ultrastrutturale (vista generale e frammento), il pannello destro mostra gli istogrammi che rappresentano la distribuzione della larghezza dei cromatidi e delle fibre cromatiniche. a Anafase. b Telofase precoce. c Telofase tardiva. d Fase G1. Le tipiche sezioni trasversali dei cromosomi e/o delle fibrille di cromatina sono indicate con linee colorate: rosso – cromonemi in interfase, verde – cromonemi; blu – “fibre di 300 nm”; nero – cromatidi. Barre di scala: 1 μm
Alla tarda telofase (Fig. 6c) e alla fase G1 (Fig. 6d), i cromosomi sono stati decondensati in domini cromosomici nei nuclei figli dove non possono essere facilmente osservati. Tuttavia, è stato possibile identificare frammenti di cromatidi separati. In questa fase, i cromatidi erano formati da fibre con un diametro di circa 250 nm, che corrisponde approssimativamente al diametro dei cromatidi in interfase. Questa osservazione, oltre alla scomparsa delle fibre di cromatema, indicava che, in questa fase della mitosi, le fibre di cromatina si erano ripiegate per formare complessi interfasici di cromatina condensata.