ミエリンは神経系の重要な部分で、最適な認知機能には欠かせない存在です。 この記事では、体内のミエリンを増加させる可能性のある天然要因の背後にある科学について説明します。
- 概要
- 髄鞘を増やす要因
- 医者にかかるタイミング
- Lifestyle Choices
- 1) Sleep
- 2)運動
- 3) 社会化と新しい経験
- 4) 新しい複合スキルの習得
- 栄養/食事要因
- 1) 魚/DHA(脳)
- 3) ビタミンC
- 5) 亜鉛
- 6) コリンとレシチン
- 7) ビタミンB12
- 8) 鉄
- 9) ビタミンK
- 10) ビオチン
- 11) 葉酸/ビタミンB9(脳)
- 13) 銅
- 14) ホスファチジルセリン
- 15)チアミン
- 16)ケト食
- サプリメント
- 1) Gotu Kola
- 2) ウリジン
- 3) アシュワガンダ
- 4) SAMeとメチル化
- 5) Myoinositol
- 6) オゾン
- 7) グレープシードエキス(本体)
- 8) ライオンズマン
- 9) イチョウ(体)
- 10) リチウムの補足
- Other
- その他の要因&ミエリンを増やす可能性のある経路
- 1)メラトニン
- 2) プロゲステロン
- 3) IGF-1
- 4) 甲状腺ホルモン
- 5) テストステロン
- 6) プロラクチン
- 7) VIP
- 8) Erythropoietin
- 9) アセチルコリンとアセチルコリンエステラーゼ阻害剤
- 10) 脳由来神経栄養因子
- 11) 神経成長因子
- 12)。 CB1カンナビノイド受容体
- 13) GSK3b阻害剤
- 14) N-acetylaspartate
- 15) RXRgamma
- 16)。 PPARデルタとPPARガンマ
- 17) Neuregulin 1
- 18) GDNF
- 19) プレグネノロン
- その他
- Factors that May Reduce Myelination
- 1) 炎症
- 2) アルコール
- 3) スタチン
- 4) EMF Exposure
- 5-6) SIRT1とAMPKの活性化
- 制限と警告
- 要点
- Learn More
概要
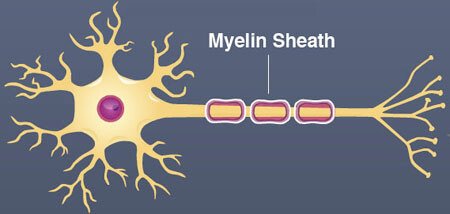
ミエリン鞘は、神経細胞の軸索(突起)を包む脂肪とタンパク質でできた保護カバーです。 神経細胞が電気信号をより速く、より効率的に送ることができるように、神経細胞を絶縁しています。 これは、脳の健康と神経系の機能をサポートします。
髄鞘を増やす要因
医者にかかるタイミング
認知機能障害を含む神経系の問題を改善するために髄鞘を増やすことが目的なら、特にあなたの症状が日常生活に大きな影響を与えている場合は、医者に話をすることが重要です。
医師は、あなたの症状を引き起こしている状態を診断し、治療する必要があります。
さらに、脳の構造は、以下に挙げるようなアプローチで、人が勝手に変えられるものではありません。
ただし、以下に挙げた要因のほとんどが髄鞘に与える影響については、ヒトでは研究されていません。
そのため、以下に挙げた追加の戦略が適切だと医師と判断した場合には、それらを試すこともできます。
Lifestyle Choices
1) Sleep
Animal studies suggests that sleep increases the oligodendrocyte precursor cells (OPCs) amounts in the body, which can lead to increase myelin formation.Therapy for a rapid rapid rapid myelin formation. 睡眠は、髄鞘形成をコードする遺伝子の高い発現と関連しています。
研究者たちは、ミエリンを作る細胞(オリゴデンドロサイト)の生産率が、マウスが眠っている間に2倍になることを発見しました。
一方、細胞死やストレス反応に関わる遺伝子は、マウスを強制的に起こさせたときにオンになりました。
安眠を十分にとることは、脳全体の健康や幸福によいのです。 睡眠が髄鞘形成に及ぼす影響を調べるには、ヒトでの研究が必要です。
2)運動
動物実験では、運動が損傷後やアルツハイマー病のマウスモデルで髄鞘を増やすことが示唆されています。
運動はまた、高脂肪食を与えた動物でミトコンドリア機能を高め、それが髄鞘を増やすように思われます 。
ヒトで運動がミエリンにどのように影響するかはまだわかっていませんが、定期的な運動が脳の健康をサポートすることはわかっています。
3) 社会化と新しい経験
限られた研究では、社会化や充実した環境が、特に初期の発達段階でミエリン形成をサポートするかもしれないと示唆されています。
追加の遊び道具や社会的相互作用によって豊かになった環境で育ったラットの視覚野では、髄鞘形成オリゴデンドロサイトの数が27~33%増加した。
豊かな環境はサルやラットの脳梁の髄鞘軸索数を増やした。
早期体験は、行動テストの成績向上と並行して、人間の乳児の白質構造(内果と前頭葉)を増加させた .
重度の幼児期のネグレクトに苦しむ子どもたちは、脳梁領域が17%減少している .
4) 新しい複合スキルの習得
ピアノ演奏などの複合スキルを習得すると、音楽パフォーマンスに関わる脳領域で白質が増えている .
4) 新しい複合スキルの習得は、音楽パフォーマンスに関わる白質構造の増加によって、より良いものになる。
白質は、各被験者が楽器を練習した時間数に比例して増加し、特定のスキルを身につけると白質が増加することを示しています。
栄養/食事要因
1) 魚/DHA(脳)
DHAは妊娠後期から生後2年の間に大脳皮質に加速的に蓄積されます … 続きを読む
この早期のDHA沈着速度の加速は、DHAの蓄積と貯蔵に敏感なプロセスである髄鞘化の開始と一致する。
食事中のDHAの減少は、脳内のDHA濃度に悪影響を及ぼす。
動物モデルでは、食事によるDHA不足の結果として、脳の脂肪酸組成における高いω6/ω3比と学習および記憶の欠陥が生じることが示唆された。
研究者たちは、これは神経突起の伸長と髄鞘形成にマイナスの影響があるためではないかと考えています。
さらなる臨床データが必要です。 動物実験では、ビタミンD3は顔面神経損傷のラットモデルにおいて、機能回復と髄鞘の増加を誘導する可能性があることが示されています。 ビタミンD受容体がオリゴデンドロサイトの産生を増加させるかどうか、科学者たちが研究しています。 ヒトでの研究が必要です。
3) ビタミンC
動物実験によると、ビタミンCはミエリンの形成を助けるかもしれません。
ビタミンCはアスコルビン酸としても知られ、いくつかの酵素反応における補酵素として重要な役割を担っています。 科学者たちは、アスコルビン酸依存のコラーゲン合成が髄鞘形成に役立つかもしれないと疑っています。 アスコルビン酸をラットのシュワン細胞や神経細胞に添加したところ、ミエリンの形成が促進されたそうです。 動物実験では、ヨウ素の欠乏が髄鞘形成に障害を与える可能性があることが示唆されています。 ヨウ素の補給は神経細胞のミエリン形成を改善するのに役立ちますが、この知見を裏付ける臨床データはありません。
5) 亜鉛
一部の研究者は、ミエリンタンパク質が正しく機能するために亜鉛が必要だと考えています。 亜鉛の欠乏は、ミエリンの形成と欠陥のある鞘の問題を引き起こすかもしれません。
6) コリンとレシチン
多発性硬化症の動物モデルでは、コリン経路がミエリン鞘の再ミネーションを助けるようです。 ミエリンの修復を促進するのです。 この経路は、MSを持つ人々で調査されていない。
CDP-コリンは、多発性硬化症の動物モデルで髄鞘を改善した。
薬剤による脱髄後、CDP-コリンは髄鞘再生を高め、運動調整障害を逆転させた 。
再ミエリン化の増加は、増殖オリゴデンドロサイトおよびオリゴデンドロサイト前駆細胞の数の増加から生じた。
レシチンはミエリンの成分である。
これらの化合物のヒトにおける髄鞘形成への影響はまだ研究されていません。
7) ビタミンB12
ビタミンB12の欠乏は脱髄や初期の脳の発達に問題を起こす可能性があります。 したがって、十分なビタミンB12の摂取は、鞘の形成に役立つと考えられます。
8) 鉄
鉄は、適切な細胞機能に重要な役割を果たします。 いくつかの研究では、ミエリンの形成には正常な鉄レベルが必要であることが示唆されています。 鉄の欠乏は髄鞘形成の不良と関連しています。 したがって、鉄は体内(オリゴデンドロサイト)の髄鞘形成をサポートする可能性がありますが、より多くのヒトのデータが必要です .
9) ビタミンK
ミエリン膜は、ガラクトシルセラミド(GalCer)およびその硫酸化体であるスルファチドなどの糖脂質が特に豊富です。
動物実験では、脳の発達中に、脳の脊髄化の増加と並行してスルファチドの濃度が増加することが示唆されました。
ミエリン・スルファチドの含有量の減少や分子構造の変化は、ミエリン構造の崩壊や、それに伴う軸索の絶縁体としてのミエリンの効率の低下の重要な要因であると考えられている。
加齢によるミエリン・スルファチドの含有量の減少は、通常の老化や老化に伴う神経障害に見られる行動障害と関係があると考えられている。
理論的には、十分な量のビタミンKを摂取することで、髄鞘形成が促進されると考えられています。 ビタミンKはスルファチドの増加に関与しており、スルファチドとビタミンKの関連性が示唆されている。 脳内では、ビタミンKは主にビタミンK2またはメナキノン-4(MK-4)として存在します。
ヒトでのデータが必要です。
10) ビオチン
一部の科学者は、ビオチンがエネルギー生産と髄鞘合成に関わる酵素を活性化すると考えています。
ある小さな研究で、ビオチン高用量で臨床的に改善した人は、約91.3%の多発性硬化症(MS)の人たちでした。 改善は、治療開始後2ヶ月から8ヶ月に遅れた。 .
2つの多施設共同二重盲検プラセボ対照試験が現在進行中である。 我々はまだ彼らの結果は、MSにビオチンの使用をサポートするかどうかを参照してくださいしている.
11) 葉酸/ビタミンB9(脳)
妊娠中の葉酸欠乏は、ラットの子供の髄鞘形成を低下させた。 葉酸を十分に摂取することは、神経系が形成される妊娠初期に特に重要である。 しかし、髄鞘形成は赤ちゃんの発達の後半に起こります。 出生前の葉酸摂取がどのように影響するのか、正確にはまだ解明されていない。) パントテン酸/ビタミンB5
パントテン酸は、脂肪酸の合成をサポートすることで間接的にミエリンの形成を助けるかもしれない(ミエリンは脂質に富む) .
パントテン酸を欠乏した鶏は、皮膚炎症、羽の異常、ミエリン鞘の変性に伴う脊髄神経損傷を発症した .
ヒトでのデータは不足している .
13) 銅
銅は髄鞘(オリゴデンドロサイト)に重要かもしれないが、これを確認するための臨床試験が必要である。 銅と結合する薬剤を動物に投与すると、脱髄が起こる
14) ホスファチジルセリン
いくつかの研究では、ホスファチジルセリンと認知活動、認知老化、認知機能能力の保持の間の相互作用について述べています。 ホスファチジルセリンのミエリンへの影響について、ヒトでは結論を出すにはデータが不十分ですが、 .
初期の研究では、ホスファチジルセリンは健康な神経細胞膜とミエリンに必要であることが示唆されています。
さらに、人間の脳の老化は、神経伝達を損なう生化学的変化および構造的劣化と関連しています。
サプリメント ホスファチジルセリン (300 ~ 800 mg/d) は、人間でよく吸収され、おそらく血液脳関門を通過すると思われます。 科学者たちは、神経細胞における生化学的変化と構造的劣化を遅らせたり、止めたり、あるいは逆転させたりするかどうかを調査しています。 また、新しい記憶の作成、既存の記憶の取り出し、情報の学習と呼び出し、注意の集中、推論と問題解決、口頭でのコミュニケーションなどの能力に影響を与えるという仮説もあります。
15)チアミン
ビタミンB1は、チアミン欠乏ラットでの研究によると、髄鞘の発生を助けるかもしれません。 科学者たちは、神経細胞と神経系の他の支持細胞の両方で必要とされていると考えています .
このビタミンBは、パーキンソン病、アルツハイマー病、ハンチントン病などの神経変性疾患で研究されています .
16)ケト食
ケト食の髄膜への影響はまだ不明で、適切な臨床試験が不足しています。 ケト系ダイエットに切り替える前に、慎重に医師に相談してください。
一部の科学者は、ケトン(3-ヒドロキシブチレート)がエネルギー源や脂質の燃料となることで、ミエリンの成長をサポートする可能性を提案しています。
ケト系ダイエットは、特定の酵素(オリゴデンドロサイトのN-アセチラスパルトを作るのを助けるAGC1)が不足していると発作や発達不全が生じることを補うことで髄鞘の改善をもたらすかもしれないそうです。 ケトジェニックダイエットがこの稀なタイプの遺伝性疾患を持つ人々に有益であるかどうかを確認するためには、さらに多くの研究が必要である。) コレステロール
コレステロールはミエリンに不可欠な成分です。 ミエリンの乾燥質量は、約70~85%が脂質で占められています。 コレステロールはミエリン膜の成長に必要である。 コレステロールは過剰に摂取すると有害ですが、卵、イワシ、ヨーグルトなどの栄養価の高い食品から十分な量を摂取することが、健康的でミエリン形成によいのかどうか、臨床試験で検証する必要があります。 しかし、高コレステロール食品の摂取量を増やす前に、必ず医師に相談してください。
サプリメント
いかなるサプリメントの摂取前にも必ず医師に相談すること。 ビタミンやハーブのサプリメントを含め、処方箋や市販の薬を服用している場合は、その旨を医師に伝えてください。
サプリメントが良いアイデアであることにあなたと医師が同意した場合、信頼できる、信頼できるメーカーが製造した製品を選びましょう。 サプリメントには一般的に、確かな臨床研究がありません。 規制によって製造基準は定められていますが、安全性や効果を保証するものではありません。
以下に挙げるサプリメントは、いずれも髄鞘形成に推奨できる根拠が不足しています。 初期の動物または細胞研究では、以下のサプリメントがミエリンを増やすかどうかを調査しています:
1) Gotu Kola
Gotu kolaは、ラットが神経損傷後により迅速に機能回復し、より多くの髄鞘軸索を作ることを助けます。
2) ウリジン
ウリジンは動物のミエリン鞘の病変を減らすかもしれません。
3) アシュワガンダ
アシュワガンダにはウィダノサイドIVという活性成分があります。 マウスでは、withanoside IVはミエリンのレベルを増加させた。
4) SAMeとメチル化
S-adenosylmethionine (SAMe) はDNAメチル化を制御するのに役立つ。 DNAのメチル化はミエリンの発達に重要な役割を果たします。 科学者たちは、SAMeが神経細胞の髄鞘形成を増加させることができるかどうかを調査しています。
妊娠中の葉酸とB12の欠乏もラットの子供の髄鞘の低下を引き起こす。
5) Myoinositol
慢性的に血液中のナトリウムレベルが低いとミエリンの破壊を引き起こすかもしれない。 ミオイノシトールはミエリンの損失を減らし、動物の血中ナトリウム濃度を正常にしたようです。
6) オゾン
オゾンは顔面神経の健康を改善し、ラットではミエリン鞘が厚くなりました .
7) グレープシードエキス(本体)
糖尿病ラットにおいて、グレープシードエキスは脱髄(シュワン細胞)から保護しました .
8) ライオンズマン
キノコのライオンズマン(Hericium erinaceusエキス)は動物の髄鞘の過程を早め、髄鞘の正常発達を促進しました .8) オゾン(本体) 糖尿病ラットにおいて、グレープシードエキッドは糖尿病ラットの脱髄を早めました。
9) イチョウ(体)
損傷後、イチョウは動物とシュワン細胞でミエリン化を増加させた .
10) リチウムの補足
一部の研究者は、リチウムが(GSK3b阻害効果によって)ミエリンを増やすのに役立つかどうかを調べている .
顔面神経粉砕損傷後の成体マウスにリチウムを投与すると、ミエリン遺伝子の発現が促され、ミエリン構造が回復し、ウィスカー運動の回復が促進されました .
リチウムはまた粉砕後の坐骨神経の再石灰化を促進しました .
ヒトでの通常および低量リチウムの髄膜への作用は不明です .
リチウムがミエリンを増やす作用があるかは不明です …。
Other
科学者たちは、以下のことを調査しています:
- PQQはシュワン細胞のミエリンを増やす。
- Quercetinは損傷後にミエリン生産細胞(オリゴデンドロサイト)を増加させる。
- 抗酸化フラボノイドのルテオリン、ケルセチン、フィセチンは、マクロファージが分解するミエリンの量(貪食)を減らすことができる
これらの化合物の髄鞘への影響は、動物やヒトでは調査されていない。
その他の要因&ミエリンを増やす可能性のある経路
このセクションでは、ミエリンを増やす可能性のあるホルモン、細胞、薬剤関連の要因に関する科学を要約している。 研究成果を議論することが目的です。
ここに挙げた物質の中には、不適切に使用すると健康に有害な影響を及ぼすものがあるため、医師に相談せずに摂取しないようにしてください。
1)メラトニン
脳卒中を起こしたラットでは、メラトニンは髄鞘形成を促進するのに役立ちます。 白質炎症を減少させ、神経細胞の髄鞘を増加させました。
2) プロゲステロン
プロゲステロンは動物モデルで髄鞘の形成、修復、再生を促進します。
プロゲストロンは医師の処方によってのみ入手できます。
しかし、天然プロゲステロンの送達は、消化管および肝臓での代謝のために課題を表している。
最近、プロゲステロンの経鼻投与経路は、簡単かつ効率的に脳をターゲットにするために研究上の注目を浴びている。 臨床試験では、これらの製剤をさらに検討する必要があります。
脳内のプロゲステロンは、腺から、または神経細胞による局所合成に由来します。 プロゲステロンの自然な形成を刺激することは、神経保護、軸索再生、ミエリン修復の代替戦略として現在検討されています。
3) IGF-1
Insulin-like growth factor-1 (IGF-1) は、シュワン細胞およびオリゴデンドロサイトにおける髄鞘化の初期イベントを刺激して、ミエル化を促進する成長因子として特定されている …
IGF-1はPI3K/Aktシグナル経路を介して2つの重要な脂肪酸合成酵素を刺激します。
4) 甲状腺ホルモン
科学者は、ミエリン細胞(オリゴデンドロサイト)を早く成熟させることによって、トリヨードサイロニン(T3)が大人の脳における髄膜タンパク質遺伝子と再髄鞘形成を刺激するかどうかを検討しています … 続きを読む
5) テストステロン
推定では、男性は女性よりも多発性硬化症を発症しにくい。
限られた研究によると、テストステロンは、動物の慢性脱髄脳病変(アンドロゲン受容体を介して働くオリゴデンドロサイト)において新しい髄鞘形成を刺激し髄鞘損傷を逆転させる …
臨床試験(第II相)では、テストステロンによる治療は、多発性硬化症の男性で灰白質を増加させることができることがわかりました。 しかし、ミエリンがある白質への効果はまだ調べられていません。
6) プロラクチン
妊娠中のプロラクチンはミエリンの増加に必要である .
7) VIP
動物研究により、VIP(およびPACAP)はミエリンの成熟と合成を含むミエリン化プロセスに貢献し、ミエリンタンパク質の発現を調節するのを助けるかもしれないことが示唆されている .
8) Erythropoietin
研究者は、オリゴデンドロサイトのミエリン遺伝子発現をエリスロポエチン(EPO)に誘導するのかを研究中である。 これらの遺伝子は、おそらくミエリン損傷後の再ミエリン化を誘導することによって、ニューロンの修復と関連している。 しかし、これは赤血球生成促進因子EPO受容体(EPOR)を発現するCG4細胞でのみ起こることである .
9) アセチルコリンとアセチルコリンエステラーゼ阻害剤
アセチルコリンエステラーゼ阻害剤(AChEI)などのコリン作動性治療は、髄鞘形成、髄鞘修復、および髄鞘完全性に対して有益な効果を持つかもしれません。
コリン作動性刺激を増加させると、髄鞘形成プロセスを助けます .
ニコチン、フペルジンA、ガランタミンなどのコリン作動性治療は、発達中の髄鞘形成と高齢での髄鞘修復の促進に役立つ可能性がある .
アセチルコリン・ムスカリン受容体は、髄鞘を増やす前駆細胞の生存を増やすかもしれない .
ニコチン、フペルジンA、ガランタミンなどのコリン作動性治療は、発達中の髄鞘形成を促進する可能性がある。
10) 脳由来神経栄養因子
神経栄養因子である脳由来神経栄養因子(BDNF)は、神経系におけるミエリン形成の調節に役立ちます。 BDNFレベルの増加は、動物および細胞研究において、髄鞘形成速度の増加と関連しています。 科学者たちは、これがミエリンの量と厚さの増加を引き起こすと考えている。
11) 神経成長因子
一部の研究者は、神経成長因子(NGF)がミエリンの損傷を修復するのを助けるかもしれないと仮定している。 また、髄鞘の増加を助ける別の物質の産生を誘導する可能性もあります。
細胞研究では、NGFが軸索再生、生存、保護、オリゴデンドロサイトの生産を促進し、ミエリン損傷部位への移動を容易にするかどうかを調べています。
12)。 CB1カンナビノイド受容体
天然に生成されるカンナビノイドによって活性化されるCB1カンナビノイド受容体は、オリゴデンドロサイトのミエリン形成を(mTORとAKTを介して)増加させることが研究されている .
13) GSK3b阻害剤
GSK3bはミエリン依存性の軸索伸長を阻害する。理論的にはGSK3bの阻害はミエリンを増やす可能性がある .
研究が進んでいない説では、化学的に脱髄した後にミエリン形成細胞の再生と再ミエル化を促進する(オリゴデンドロサイト) .
14) N-acetylaspartate
N-acetylaspartate(NAA)は、ミエリン合成にアセチル基を供給していると思われます。 ミエリンの形成と維持に必要であると考える研究者もいます。
15) RXRgamma
レチノイドX受容体γ(RXRγ)と呼ばれるタンパク質はオリゴデンドロサイト前駆細胞を促進するようです .
RXRγはビタミンD受容体と結合して遺伝子発現を誘導しこのミエリン産生細胞を作らなければなりません .
動物や人のデータはありません
16)。 PPARデルタとPPARガンマ
PPAR デルタは、エネルギー消費と体重減少に関連するタンパク質である。 ミエリン細胞を増殖させるという説もありますが、ヒトでのデータは不足しています。
PPAR-γは抗炎症作用が期待されるタンパク質です。 ミエリンの形成や成長(オリゴデンドロサイト)を促進するかどうかを研究している。
様々な要因がその機能を増加/減少させるかもしれない。
17) Neuregulin 1
NRG1はシュワン細胞を増やすのに役立つタンパク質である。 科学者たちは、ニューレグリン1がシナプス可塑性、扁桃体の抑制(不安をシャットダウンする)、髄鞘形成(シュワン細胞の成熟、生存、運動)、心臓機能(心臓成長因子)にとって重要だと考えています。 ヒトでの研究が必要 .
18) GDNF
Glial cell line-derived neurotrophic factor (GDNF) は細胞内で軸索再生ミエリンを増加することができると思われるが、動物やヒトでの効果は不明 .
19) プレグネノロン
プレグネノロンが動物やヒトの髄鞘形成にどのような影響を及ぼすかは分かっていない。 プレグネノロンは、FDAによって未承認薬と見なされています。 摂取しないことを強くお勧めします。
プレグネノロンは体内で生成される神経ステロイドの一種です。 ある説によると、このニューロステロイドとして知られる脳内生成ホルモンは、ミエリンの合成と修復を調節しているのではないかと言われています。 この説は検証されていませんが。
プレグネノロンは、他のステロイドホルモンの前駆体でもあります。 シュワン細胞の研究では、プレグネノロンの自然な増加がミエリン形成を高めることができるかどうかを研究している。
その他
上皮成長因子受容体(EGFR)とErbB3受容体チロシンキナーゼ:
- 上皮成長因子受容体は髄鞘化と再ミエル化で重要な役割を演じています。 EGFRシグナルは仮説的にミエリンの修復と髄鞘形成を増加させる。
- ErbB3 receptor tyrosine kinaseはシュワン細胞上にある受容体である。
Factors that May Reduce Myelination
髄鞘を減少させる可能性のある因子については、信頼できる情報が十分でない。 以下に概説する研究のほとんどは、関連性を扱っているか、動物または細胞で実施されたものである。
私たちは、以下の要因について、研究結果のみを提示しています。
髄鞘について心配な方は、医師に相談して、正確な診断、治療、毎日の生活に取り入れられる、脳によい補完的習慣についての推奨を受けましょう。
1) 炎症
炎症性サイトカインが髄鞘を減らすと考えられています .
TNFαやリンパトキシン(LT)などのサイトカインにさらされた培養標本ではミエリンとオリゴデンドロサイト(OL)の破壊が起こる .
多発性硬化症は脱髄を起こす疾患であると言われています .
ミエリンやオリゴデンドロサイト(OL)の破壊は、ミエリンの減少を引き起こすと言われています .
炎症は髄鞘を減らすと考えられています。 いくつかの研究では、これらのサイトカインや他のサイトカインが病変部位や多発性硬化症(MS)患者の脳脊髄液中で上昇することが示されており、動物モデルでも同様の所見が得られている。 より多くのヒトでの研究が必要である。
2) アルコール
十代の乱飲は前頭葉白質完全性の低さと関連している。
ラットでは、思春期の乱飲は脳梁のサイズを小さくし、灰白質中の髄膜基本蛋白質を劣化させた 。
暴飲暴食をした思春期のラットでは、前頭前野(内側)の軸索でもミエリンが損傷しており、飲酒量が多いほど成人後のワーキングメモリ課題の成績が悪くなることが予測されました。
これらの知見は、ミエリンに対する随伴アルコールの因果関係を確立し、アルコールに敏感で、早期発症の飲酒やアルコール依存症に伴う行動・認知障害の原因となりうる特定の前頭前野軸索についての洞察を与える。
3) スタチン
スタチンとは心臓疾患の治療に役立つ薬剤である。 いくつかの議論のある動物実験では、スタチンがオリゴデンドロサイトとミエリンの形成に悪影響を及ぼす可能性が示唆されている。 これらの主張を検証するためには、大規模なヒトでのデータが必要です。
4) EMF Exposure
ある研究では、携帯電話やWi-FiなどからのEMFがミエリンの劣化を引き起こすと結論づけています。 ヒトでのデータは不足しています。
5-6) SIRT1とAMPKの活性化
SIRT1とAMPKの活性化は、通常は良いことと考えられていますが、ミエリンに関しては、あまり良くないかもしれないと科学者は指摘しています。
SIRT1の不活性化はオリゴデンドロサイト(髄膜産生細胞)の産生を増やします。 マウスでは、SIRT1不活性化は、オリゴデンドロサイトの生産をもたらし、その後、ミエリンの形成と白質異常を増加させます.
同様に、動物でAMPKレベルが高い場合、ミエリンの生産は遅くなります.
マウスでは、SIRT1不活性化は、オリゴデンドロサイトの生産をもたらし、ミエリンの形成を増加させます.
AMPKレベルは、ミエリンの生産を遅くしています。
ヒトの研究では、これらの関連性を探る必要があります。
制限と警告
ある要因がミエリンを増やしたり減らしたりするかもしれないと言うとき、さまざまなモデルが引用されます。 前述したように、持ち込まれた研究は、それらがヒトのミエリンを増加させるという結論を出すのに十分な証拠を提供していません。
記事は、ヒトのミエリンを増加させる潜在的な候補としてこれらを単にリストアップしています。この記事は、あなたがさらに研究を行うための踏み台として使用することです
要点
ミエリン鞘は脳細胞の周囲を包み、高速で信号を発信できるようにしています。 しかし、髄鞘を改善する可能性のある戦略は、ほとんどが小規模なヒト研究または動物実験によるデータに依存しています。
髄鞘を強化する可能性のある健康的な方法には、十分な睡眠、運動、日光、新しい技術の習得が含まれます。
最後に、大量の飲酒や携帯電話の常時使用などの不健康な習慣を避けるのもよいでしょう。これらは、実験的研究でミエリンを破壊するようです。
Learn More
- Myelin Sheath Definition, Function & Demyelinating Diseases