Introduktion
Prostatacancer är den vanligaste formen av malignitet och den näst vanligaste orsaken till dödsfall i cancer bland män.1 Kadaverstudier visar att risken för att utveckla mikrofoci för prostatacancer ökar med åldern (30 % under livets fjärde decennium, 40 % under det femte decenniet osv.).2
Vidare vissa cancerformer är aggressiva, medan andra har liten eller ingen metastaserande potential.3 Många män med lågriskprostatacancer kommer inte att utvecklas eller få kliniska symtom under sin livstid.4 På grund av denna variation har olika behandlingsalternativ introducerats, som erbjuder jämförbara terapeutiska effekter med radikal prostatektomi (RP), samtidigt som sexuell funktion och kontinens bevaras. I detta scenario kan aktiv övervakning (AS) erbjuda minskad morbiditet och förbättrad livskvalitet.5 Små, icke-aggressiva tumörer är de idealiska kandidaterna för AS, även om ingen konsensus har uppnåtts. Låg risksjukdom definieras som Gleason score (GS) 6 och prostataspecifikt antigen (PSA)
ng/ml. Patienter med kliniskt stadium >T2a brukar uteslutas.6
Historisk grad är en oberoende faktor för sjukdomsprognos och överlevnad.7 GS graderingssystemet är den mest allmänt accepterade klassificeringen,8 men många studier har visat att den GS som erhålls vid prostatabiopsi inte alltid korrelerar med den slutgiltiga patologiska graderingen av de kirurgiska proverna. Uppgradering av GS (ökning av GS med minst en poäng) har rapporterats i upp till 57 % av fallen.9,10 Fel i tilldelningen av GS kan leda till olämplig övervakning av biologiskt aggressiva tumörer eller till val av behandlingar med sämre botningsgrad vid högrisksjukdom, vilket i slutändan kan ha en negativ inverkan på patientens resultat.11 Därför har flera nyligen genomförda studier sökt efter faktorer som kan förutsäga uppgradering till GS.12
Låg prostatavolym (PV) och mer specifikt hög prostataspecifik antigentäthet (PSAD) har i många studier visat sig vara prediktorer för riskprogression, vilket återspeglar möjligheten av oupptäckt aggressiv cancer.6 Flera studier har visat ett starkt samband mellan PSAD och prostatacancerns aggressivitet.13 PSAD har föreslagits som en stark prediktor för uppgradering av GS hos patienter med biopsibekräftad Gleason 6-sjukdom, men det finns ingen allmän konsensus om gränsvärdet.11-17
Det huvudsakliga syftet med vår studie var att identifiera de oberoende prediktorerna för GS-uppgradering och bestämma det bästa cut-off-värdet för PSAD för att identifiera riskpatienter.
Material och metoder
Vi samlade in studieuppgifterna från vår sjukhuscentrals prospektivt underhållna databas. Patienter med kliniskt lokaliserad prostatacancer som genomgick radikal prostatektomi (RP) och hade en preoperativ prostatabiopsi inom tidsramen januari 2004 till februari 2015 valdes ut. Upptäckten av GS 3+3 vid prostatabiopsi togs som inklusionskriterier. All klinisk, avbildnings-, laboratorie- och patologisk information hämtades från databasen och bekräftades av patienternas kliniska journaler.
Vi inkluderade preoperativ patientålder, kliniskt sjukdomsstadium, PSA före biopsi, preoperativ PSAD, GS vid biopsi, totalt antal tagna biopsikärnor och antal biopsikärnor med cancer och analyserade sambandet mellan dessa faktorer och GS-uppgradering efter RP. Olika gränsvärden användes för varje variabel för att identifiera och kvantifiera ett potentiellt samband med Gleason-uppgradering. Vi analyserade också sambandet mellan GS-uppgradering och variabler för det metabola syndromet, såsom diabetes mellitus (DM), högt blodtryck (HBP) och fetma, som hämtades från patienternas kliniska journaler. De sistnämnda variablerna inkluderades eftersom tidigare studier har visat att de är associerade med sämre prognos och högre återfallsfrekvens.18,19
PSAD beräknades genom att dividera det preoperativa PSA-värdet med PV. PV beräknades med transrektalt ultraljud med hjälp av den maximala tvärgående diametern (D1), den maximala anteroposteriordiametern (D2) och den maximala longitudinella diametern (D3) med hjälp av formeln D1×D2×D3×ϖ/6 baserad på teorin om prostatans ellipsdimension.14 Prostatabiopsi utfördes enligt vårt sjukhus tidigare beskrivna protokoll. Alla patienter var lätt sederade och en enda i.v. dos av piperacillin/tazobaktam administrerades 15min före ingreppet.20 Vi använde en 18-gauge nål med en automatisk biopsipistol för att få fram prostatavävnad. För den första biopsin hämtades 12-18 kärnor, beroende på prostatans storlek och förekomsten av misstänkta knölar.21 Alla prover placerades i en separat behållare som identifierade motsvarande plats och skickades till patologtjänsten på vårt sjukhus.
Deskriptiv statistik presenterades som medelvärde ± standardavvikelse (SD) och median/IQR för kontinuerliga variabler och som absolut frekvens och fördelningsprocent för kategoriska variabler. Patienter som postoperativt uppgraderades till GS 7 eller högre jämfördes med de som inte uppgraderades. För att fastställa genomsnittliga skillnader och likheter jämfördes de kategoriska variablerna med hjälp av Pearsons chi-två-test och de kontinuerliga variablerna med median-testet och Student’s t-testet. Ett univariat regressionstest användes för att upptäcka betydande oberoende prediktorer för uppgradering. En ROC-kurva (receiver operating characteristic) användes och arean under kurvan (AUC) beräknades för att visa det optimala gränsvärdet för variabler med prediktiv betydelse för GS-uppgradering. Vi uppskattade sensitivitet, specificitet, positivt prediktivt värde och negativt prediktivt värde för olika gränsvärden som föreslagits av andra författare, tillämpade dem på vår population och jämförde dem sedan med vårt gränsvärde. Alla tester var tvåsidiga och ett p-värde på
Resultat
Från totalt 342 patienter i vår databas exkluderades 144 (42,1 %) eftersom de hade ett GS ≥4 i prostatabiopsin. Därmed återstod 198 (57,9 %) patienter som uppfyllde våra inklusionskriterier för GS 6 (3+3). Sjuttiotre av dessa patienter exkluderades på grund av ofullständig klinisk information från journalen.
Medianålder för patienten var 65,1±6,3 år, kroppsmasseindex (BMI) var 26,7±3,6kg/m2, antalet tagna kärnor var 13,4±3,5, antalet positiva kärnor var 2,5±2 och preoperativ PSAD var 0,26±0,23ng/ml2. Det preoperativa medianvärdet för PSA var 7,2 IQR 5,67-10,05 och PV var 38 IQR 26,5-55,5. Kliniskt stadium baserat på digital rektalundersökning var T1c hos 86 (69,6 %) patienter, T2a hos 28 (22,4 %), T2b hos 7 (5,6 %), T2c hos 2 (1,6 %) och T3 hos en (0,8 %) patient.
Preoperativt PSA kategoriserades enligt följande: 6 (4,8 %) patienter hade PSA-värden
ng/ml, 88 (70,4 %) låg mellan 4 och 9,9ng/ml, 23 (18,4 %) låg mellan 10 och 19,9ng/ml och 8 (6,4 %) hade PSA ≥20ng/ml. Biopsi-GS och kirurgiskt GS förblev detsamma hos 71 (56,8 %) patienter med GS 3+3, medan 54 (43,2 %) patienter hade en uppgradering. Av de patienter med uppgradering steg 70 % till GS 7 och 30 % steg till ≥8.
Tabell 1 visar de demografiska och kliniska egenskaperna hos patienter med och utan GS-uppgradering. Vi fann en statistiskt signifikant korrelation mellan postoperativ uppgradering och det preoperativa PSAD-värdet (p0,001), preoperativt PSA (p=0,039), PV (p=0,004) och patientens ålder ≥70 år (p=0.011).
Karakteristika för patienter med och utan uppgradering av Gleasonpoäng efter radikal prostatektomi.
| Karakteristik | Uppgradering | Ingen uppgradering | p-Value |
|---|---|---|---|
| Nej. av patienter (%) | 54 (43,2 %) | 71 (56.8%) | |
| Ålder (år) | |||
| Medel±SD | 66.22±6.5 | 64.28±6.0 | 0.092b |
| Age (no.) | |||
| >70 år | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| Medelvärde±SD | 26.22±4.0 | 27.14±3.1 | 0.178c |
| PSA (ng/ml) | |||
| Median/IQR | 8/6.5-12.6 | 6.8/5.4-9 | 0.039*,c |
| Prostatavolym (ml) | |||
| Median/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Medel±SD | .36±.27 | .19±.16 | *,c |
| Biopsikärnor (nr.) | |||
| Medel±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Positiva kärnor (antal) | |||
| Medel±SD | 2.9±2.4 | 2.1±1.6 | 0.0702c |
| Fetthet (antal) | |||
| Positiv | 9 (16.6%) | 16 (22.5%) | 0.500a |
| Negativ | 45 (83,4 %) | 55 (77.5%) | |
| DM (no.) | |||
| Positivt | 16 (29,6%) | 14 (19.7%) | 0.150a |
| Negativt | 38 (70,4%) | 57 (80.3%) | |
| HBP (nr.) | |||
| Positiv | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Negativt | 33 (61,1%) | 41 (57.8%) | |
IQR: interkvartilområde; BMI: kroppsmasseindex; PSA: prostataspecifikt antigen; PSAD: prostataspecifik antigentäthet; DM: diabetes mellitus; HBP: högt blodtryck.
X2-test.
Studentens t-test.
Median test.
Statistiskt signifikant med ett p-värde
Vi uppskattade ett optimalt PSAD-gränsvärde på 0.17ng/ml2 genom ROC-analys, med en AUC på 0,675 (p=0,001, 95%CI .580-.770), och analyserade sedan de gränsvärden som föreslagits av andra författare och jämförde dem. Tabell 2 och figur 1 visar dessa resultat.
Analys av olika cutoff-värden för PSAD som en prediktor för GS-uppgradering.
| Uppgradering | Ingen uppgradering | p | Odds förhållande | Sens % | Spec % | PPV % | NPV % | ||
|---|---|---|---|---|---|---|---|---|---|
| PSAD (nr.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8%) | ||||||||
| PSAD (nr.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7%) | ||||||||
| PSAD (nr.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4%) | 49 (69%) | ||||||||
PSAD: prostataspecifikt antigen.
X2-test.
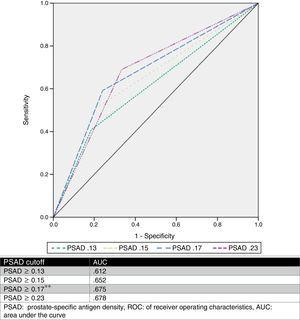
ROC-kurva.
Tabell 3 visar resultaten från den univariata regressionen för att upptäcka oberoende prediktorer för uppgradering.
Oberoende prediktorer för uppgradering (univariat regression).
| Karakteristika | HR | 95 CI | p-värde |
|---|---|---|---|
| Ålder | 0.5 | 0,99-1,11 | 0,09 |
| >70 år | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0.166 |
| PSAD ≥0.13 | 1.11 | 1.32-6.99 | 0.009* |
| PSAD ≥0.15 | 1.39 | 1.79-9.03 | 0.001* |
| PSAD ≥0.17 | 1.51 | 2.98-9.99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Prostatavolym | 0.02 | 1.01-1.04 | 0.008* |
| Positiva biopsikärnor | 0.06 | 0.98-1.18 | 0.24 |
| Fetma | 0.31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0.152 |
| HBP | 0.10 | 0.53-2.29 | 0.775 |
BMI: kroppsmasseindex; PSA: prostataspecifikt antigen; PSAD: prostataspecifik antigentäthet; DM: diabetes mellitus; HBP: högt blodtryck.
Diskussion
Flera studier har funnit bristande överensstämmelse mellan GS-rapporten från prostatabiopsi och rapporten från radikal prostatektomi. I en nyligen genomförd metaanalys som omfattade 14 839 patienter uppskattade författarna en uppgradering av GS hos 30 % av patienterna och endast 63 % förblev oförändrade efter prostatektomi22 . Gleason-uppgradering har hittats i 29-58 % av fallen,23 och är värre i undergruppen av patienter med ett biopsi-GS 3+3 (upp till 63,3 %).14 På vårt sjukhuscenter fann vi en GS-uppgradering hos 42,1 % av alla patienter som genomgick radikal prostatektomi och hos 43,2 % av patienterna med ett biopsi-Gleason-poäng 3+3.
Flera författare har försökt att hitta prediktorer för GS-uppgradering, särskilt med den för närvarande ökande populariteten av AS-protokollen. Tidigare beskrivna prediktorer är ålder >60 år, PSA-värde >5,0ng/ml och >25 % positiva kärnor under biopsi.24
PSAD har analyserats och flera cut-off-värden har beskrivits (t.ex. ≥0,13ng/ml, ≥0,15ng/ml och ≥0,23ng/ml).11,13,16,17 Trots detta finns det ingen konsensus om hur detta värde ska användas för att exakt förutse en GS-uppgradering. Baserat på våra resultat föreslog vi ett gränsvärde på ≥0,17ng/ml, som hade en AUC på 0,675, en sensitivitet på 75,9 %, en specificitet på 59,2 %, en PPV på 58,5 % och en NPV på 76,3 % för förutsägelse av GS-uppgradering. Vi valde denna brytpunkt, eftersom när vi analyserade andra föreslagna värden i förhållande till vår fallserie erhölls den bästa AUC med ett värde ≥0,23ng/ml (0,678), men det hade en sämre sensitivitet och en hög falskt negativ frekvens (33,33 %). När vi däremot använde värdena ≥0,13ng/ml och ≥0,15ng/ml hade de å andra sidan en falskt positiv frekvens på 59 % respektive 49 %. Den falskt negativa och falskt positiva frekvensen för den avgränsning som föreslagits av vårt team var 24 % respektive 41 %, vilket vi ansåg vara den mest användbara. Figur 2 visar ett diagram över vår population.

Studiepopulationen, som visar de olika prostataspecifika antigentätheterna och uppgraderingsdata.
Vår studie inkluderade endast patienter med ett biopsi-GS på 3+3, på grund av betydelsen av denna variabel när man överväger att ta en patient för AS. Med tanke på att det finns andra faktorer som beaktas vid aktiv övervakning kan vi inte förklara att risken för uppgradering av GS och PSAD är avgörande variabler för att föreslå en terapeutisk strategi, men vi anser definitivt att de bör diskuteras innan ett beslut fattas. En andra biopsi skulle kunna vara indicerad för patienter med en PSAD ≥0,17ng/ml, med tanke på risken för underklassificering, för att bekräfta GS. Prostata-MRI och MR-styrda fusionsbiopsier har visat hög sensitivitet och specificitet för att lokalisera oidentifierad signifikant cancer25 . Dessa alternativ är dock inte allmänt tillgängliga i Mexiko, så transrektal ultraljudsstyrd mättnads- eller schablonbiopsi kan vara ett mer gångbart alternativ för att öka den diagnostiska noggrannheten.
Nyligen framkomna bevis har föreslagit ett samband mellan de olika komponenterna i metabolt syndrom och prostatacancer, vilket ökar risken för att få sjukdomen och att dö av den,21 liksom en högre grad av biokemiskt återfall efter radikal behandling.22 I vår studie kunde vi dock inte påvisa något samband med uppgradering av Gleason score.
Prostatavolym, som är direkt relaterad till ålder, kan vara ett distraherande element. När en slumpmässig ultraljudsstyrd biopsi utförs i en stor prostata finns det en potentiell risk att lämna större underprovtagna områden, vilket utgör en högre risk att missa en betydande tumör.
AS har gett lovande resultat hos patienter med lågriskprostatacancer, med förbättringar av livskvaliteten, bevarande av erektilfunktion och urininkontinens, och av andra komplikationer i samband med radikala behandlingar.6 Det finns dock en risk för att en aggressiv cancer feldiagnostiseras och att olämplig behandling fördröjs, vilket påverkar patientens prognos. Det finns många kriterier för att välja AS-kandidater, och D’Amicos riskklassificering26 och Epstein-kriterierna27 är de mest använda för detta ändamål. Den förstnämnda inkluderar inte PSAD, men i Epstein-kriterierna föreslås användning av ett gränsvärde ≥0,15ng/ml. På vårt sjukhus använder vi mycket strikta kriterier och PSAD-gränsvärdet ≥0,17ng/ml kommer att ingå som en del av diskussionen när vi väljer ut en möjlig kandidat för AS.
Den retrospektiva karaktären hos vår studie var dess främsta begränsning. Det potentiella urvalet reducerades ytterligare på grund av ofullständiga uppgifter i de kliniska journalerna. En annan begränsning var att vi inte hade alla data från biopsiproverna, så vi kunde inte analysera patienter med de fullständiga AS-kriterierna. Med den mängd patienter som ingick i studien erhölls dock signifikanta resultat och dessa kan användas för att överväga risken för GS-uppgradering hos patienter med GS 3+3.
Slutsatser
Vi drar slutsatsen att det är viktigt att använda så många verktyg som möjligt för att fatta korrekta beslut och för att identifiera de patienter som löper en hög risk för patologisk uppgradering och som skulle kunna gynnas av en noggrannare utvärdering och/eller aggressiv behandling. PSAD bör användas rutinmässigt för att identifiera patienter med till synes lågriskcancer med risk för GS-uppgradering, vilket resulterar i ett mer exakt urval av kandidater för AS. Enligt våra uppgifter kan vi undvika en potentiellt felaktig GS-stagning i cirka 43 % av fallen.
Vi fann en hög frekvens av GS-uppgradering i vår population. I vår studie var PSAD-värdena signifikant associerade med uppgradering och det mest exakta avgränsningsvärdet var 0,17ng/ml2. Vi rekommenderar att en lokal översyn av GS-uppgraderingsrisken och dess potentiella prediktorer utförs på alla sjukhuscentra innan man erbjuder aktiv övervakning till potentiella kandidater.
Etiska upplysningarSkydd av människor och djur
Författarna förklarar att inga experiment utfördes på människor eller djur för den här studien.
Sekretess för data
Författarna förklarar att inga patientdata förekommer i den här artikeln.
Rätt till personlig integritet och informerat samtycke
Författarna förklarar att inga patientuppgifter förekommer i denna artikel.
Finansiering
Ingen sponsring av något slag har erhållits för att genomföra denna artikel.
Intressekonflikt
Författarna förklarar att de inte har någon intressekonflikt, och att de inte heller har erhållit någon sponsring för studien.