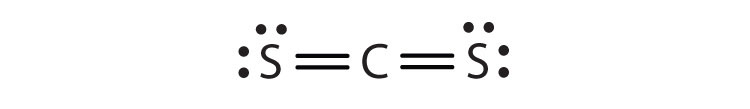4.3 Flera kovalenta bindningar
Lärandemål
- Känn igen molekyler som sannolikt har flera kovalenta bindningar.
I många molekyler skulle oktetregeln inte vara uppfylld om varje par av bundna atomer delar två elektroner. Tänk på koldioxid (CO2). Om varje syreatom delar en elektron med kolatomen får vi följande:
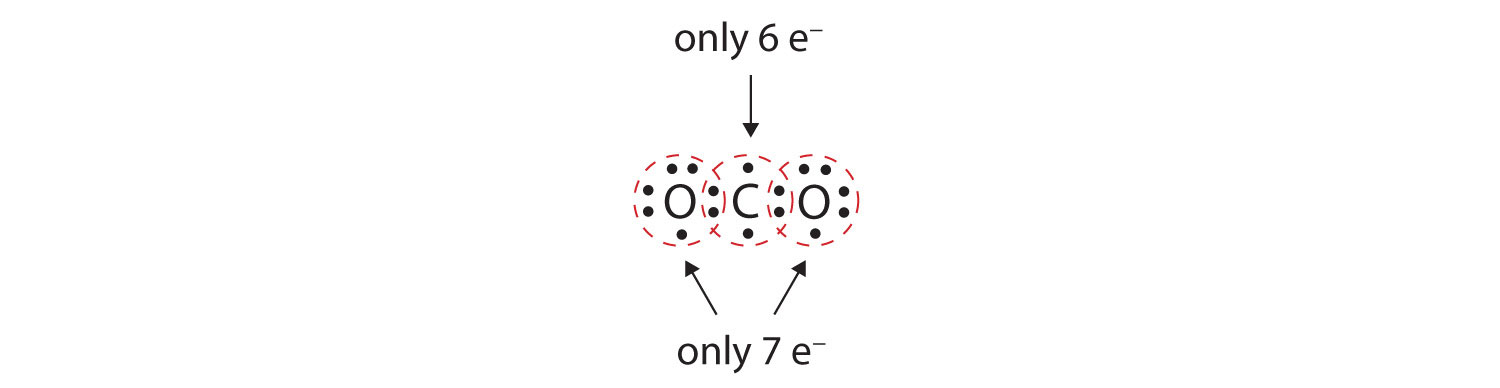
Detta ger inte kolatomen en fullständig oktett; du hittar bara sex elektroner i dess valensskal. Dessutom har varje syreatom endast sju elektroner i sitt valensskal. Slutligen gör ingen atom det antal bindningar som den vanligtvis bildar (figur 4.2 ”Hur många kovalenta bindningar bildas?”). Detta arrangemang av delade elektroner är långt ifrån tillfredsställande.
Ibland måste mer än ett elektronpar delas mellan två atomer för att båda atomerna ska ha en oktett. I koldioxid delas också en andra elektron från varje syreatom med den centrala kolatomen, och kolatomen delar ytterligare en elektron med varje syreatom:
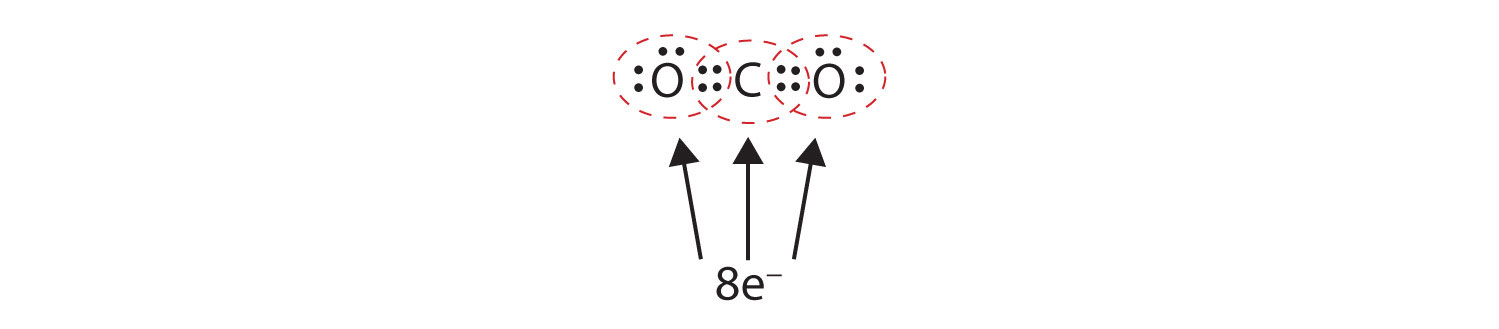
I detta arrangemang delar kolatomen fyra elektroner (två par) med syreatomen till vänster och fyra elektroner med syreatomen till höger. Det finns nu åtta elektroner runt varje atom. Två elektronpar som delas av två atomer bildar en dubbelbindningTvå elektronpar som delas av två atomer i en molekyl. mellan atomerna, vilket representeras av ett dubbelt streck:
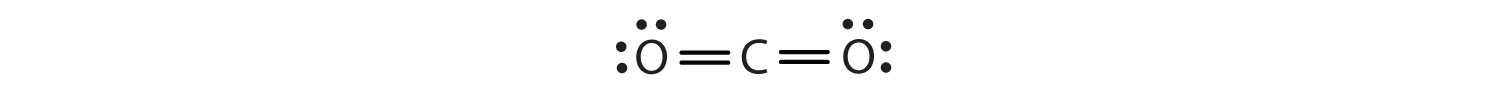
Vissa molekyler innehåller trippelbindningarTre elektronpar som delas av två atomer i en molekyl., kovalenta bindningar där tre elektronpar delas av två atomer. En enkel förening som har en trippelbindning är acetylen (C2H2), vars Lewisdiagram ser ut på följande sätt:

Exempel 5
Rita Lewisdiagrammet för varje molekyl.
- N2
- CH2O (Kolatomen är den centrala atomen.)
Lösning
-
Bindningen mellan de två kväveatomerna är en trippelbindning. Lewisdiagrammet för N2 är följande:

-
I CH2O är centralatomen omgiven av två olika typer av atomer. Lewisdiagrammet som fyller varje atoms valenselektronskal är följande:

Note
Ett användningsområde för CH2O, även kallat formaldehyd, är konservering av biologiska prover. Vattenlösningar av CH2O kallas formalin och har en skarp, karakteristisk (stickande) lukt.
Färdighetsövning
-
O2
-
C2H4
Rita Lewisdiagrammet för varje molekyl.
Konceptgenomgångsövning
-
Vad är en ledtråd till att en molekyl har en flerbindning?
Svar
-
Om enkelbindningar mellan alla atomer inte ger alla atomer (utom väte) en oktett kan flera kovalenta bindningar finnas.
Nyckelupplevelser
- Vissa molekyler måste ha flera kovalenta bindningar mellan atomer för att uppfylla oktettregeln.
Övningar
-
Alla molekyler innehåller flera bindningar. Rita Lewisdiagrammet för var och en av dem. Det första elementet är den centrala atomen.
- CS2
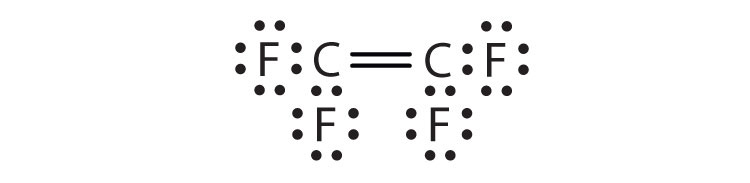
- C2F4
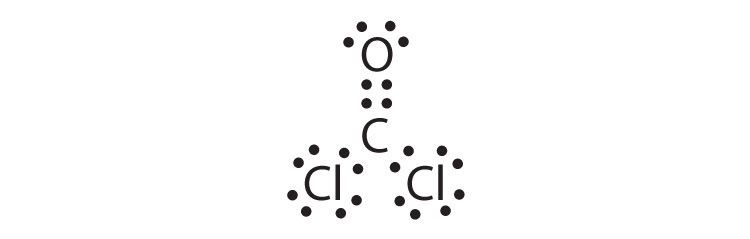
- COCl2
-
Varje molekyl innehåller dubbelbindningar. Rita Lewisdiagrammet för var och en av dem. Anta att det första elementet är den centrala atomen, om inget annat anges.
- N2
- HCN (Kolatomen är den centrala atomen.)
- POCl (Fosforatomen är den centrala atomen.)
-
Förklara varför väteatomer inte bildar dubbelbindningar.
-
Varför är det felaktigt att rita en dubbelbindning i Lewisdiagrammet för MgO?
Svar
-
-
-
Väte kan bara ta emot ytterligare en elektron; Flerbindningar kräver att mer än ett elektronpar delas.