- Introduktion
- Material och metoder
- Subjekt och experimentellt paradigm
- Funktionell magnetresonanstomografi och blodsyrenivåberoende signaler
- Väljning av intresseområden för blodsyrenivåberoende signaler från lillhjärnan/hjärnstammen
- Beräkning av medelvärdet av blod-oxygennivåberoende, slag till slag-intervall och andningsvågor
- Resultat
- Diskussion
- Koincidens mellan andningsvågor och respiratorisk blodsyresnivåberoende artefakt
- Rytmisk neuronal aktivering associerad med neurala blodsyresnivåberoende svängningar
- Neural aktivitet fungerar som ”drivkraft” för långsamma hjärtrytmoscillationer
- Begränsningar och framtida utsikter
- Slutsats
- Datatillgänglighet
- Etikutlåtande
- Författarbidrag
- Intressekonfliktförklaring
- Acknowledgments
- Abkortningar
Introduktion
Respiratorisk sinusarytmi (RSA) återspeglar hjärtfrekvensens (HR) acceleration under inspiration och HR-deceleration under utandning. Det är en grundläggande princip (Yasuma och Hayano, 2004) och kärnfenomenet i paced resonansandning vid 6/min som förknippas med förstärkt lågfrekvent hjärtfrekvensvariabilitet (HRV), ökat känslomässigt välbefinnande (Mather och Thayer, 2018) och förbättrad bearbetning av negativa känslor (Zaccaro et al., 2018). Intressant nog finns det undantag från RSA med HR beat-to-beat interval (RRI) ökar under inspiration och med RRI-fasen ledande i förhållande till andningsrytmen (Rassler et al., 2018). Denna ovanliga paradoxala RSA hittades hos en minoritet av friska deltagare under skanning med funktionell magnetisk resonanstomografi (fMRI), en obekväm, ibland klaustrofobisk situation som vanligtvis är förknippad med ökad tillståndsångest (Munn et al., 2015; Pfurtscheller et al., 2018).
Långsamma spontana andningsvågor med en hastighet på mellan 6 och 9 andetag/min åtföljs även de av förhöjd HRV och skulle därmed kunna underlätta bearbetningen av obehagliga känslor som ångest och stress (Thayer och Lane, 2009). På grund av RRI:s ledande roll över andningssvängningar under det ovanliga upphörandet av RSA (Rassler et al., 2018) verkar en autonom neuronal oscillator (central pacemaker; Julien, 2006) i hjärnan trolig, som fungerar som en källa för långsamma RRI-svängningar. Det är anmärkningsvärt att Perlitz et al. (2004) rapporterade om en ny typ av kardiovaskulär rytm i 0,15 Hz-bandet hos människa och hund med ett gemensamt ursprung i hjärnstammen. Den mest intressanta egenskapen hos denna bredbandiga ”0,15 Hz-rytm” (som även omfattar frekvenskomponenter nära 0,1 Hz) är att perioder av spindelvågorna är faskopplade med andningen i förhållandet 1:1. Vårt huvudsakliga forskningsintresse var att identifiera denna pacemaker, som föreslås vara lokaliserad i hjärnstammen (Lambertz och Langhorst, 1998; Perlitz et al, 2004), genom att analysera BOLD-signaler.
BOLD-signalen kvantifierar inte direkt den neurala aktiviteten i sig, men är känslig för förändringar i den cerebrala ämnesomsättningen, det cerebrala blodflödet och den cerebrala blodvolymen (Obrig et al., 2000; Buxton et al., 2004) och för flera typer av rörelser (rörelser i bröstet och blodkärlen; Birn et al., 2006). Därför kan BOLD-signaler bestå av neurala och icke-neurala (t.ex. kärlrörelser) komponenter. Det förväntas att två BOLD-signaler av olika ursprung skulle kunna identifieras i hjärnstammen med dess stora blodkärl (arteria basilaris) och den postulerade neurala 0,15 Hz-källan (Perlitz et al., 2004). Vi antar att en av dem är resultatet av blodkärlens rörelse (BOLDv) och indikerar starten på en långsam andningsåtgärd eftersom den inträffar nästan samtidigt med den neurala aktiveringen av andningsneuronerna. Den andra antas vara förknippad med neuronal aktivering (BOLDn) fördröjd av den neurovaskulära kopplingstiden på 2-3 s (Mateo et al., 2017). Vi spekulerar i att båda BOLD-signalerna pekar på en central pacemaker i hjärnstammen.
Material och metoder
Subjekt och experimentellt paradigm
Den studerade gruppen av försökspersoner var densamma (ålder 23,8 ± 3,3 år) som nyligen analyserats av Rassler et al. (2018). Inspelning och förbehandling av EKG och andning beskrevs i den artikeln. Alla deltagare gav informerat skriftligt samtycke till protokollet för studien, som hade godkänts av den lokala etikkommittén vid universitetet i Graz.
Funktionell magnetresonanstomografi och blodsyrenivåberoende signaler
Funktionella bilder förvärvades med en 3 T-skanner (Magnetom Skyra) med en multibands GE-EPI-sekvens (Moeller et al, 2010) med en samtidig sexbandsvärvning med TE/TR = 34/871 ms, 52° flipvinkel, 2 mm × 2 mm × 2 mm voxelstorlek, 66 sammanhängande axiella skikt (11 × 6), värderingsmatris på 90 × 104 och en FOV på 180 mm × 208 mm. Denna skanningshastighet på 871 ms (1,15 Hz samplingsfrekvens) gör det möjligt att studera långsamma svängningar i intervallet 0,1-0,15 Hz. För mer information om förbehandling se Pfurtscheller et al. (2018). Atlasen för automatiserad anatomisk märkning (AAL) (Tzourio-Mazoyer et al., 2002) användes för att extrahera tidsförlopp av BOLD-signaler i 116 regioner av intresse (ROIs). Denna atlas visar inga ROIs i hjärnstammen, utan endast i nära anslutning till cerebellum och vermis. På grund av dessa regioners närhet och på grund av en större artärs anknytning är det rimligt att anta att den signal som samlas in från AAL ROIs märkta ”cerebellum” delvis återspeglar hjärnstamsaktivitet.
Väljning av intresseområden för blodsyrenivåberoende signaler från lillhjärnan/hjärnstammen
Av de 116 ROI:erna i AAL-atlasen motsvarar ROI 91 till ROI 108 axiella skivor från lillhjärnan inklusive hjärnstammen (Tzourio-Mazoyer et al, 2002). T1-bilder från den axiella skivan (Talairach space z = -34) dokumenterar närheten mellan lillhjärnan och hjärnstammen (figur 1). På grund av det lilla antalet voxlar (<200) uteslöts ROI 107 och 108 från vidare analys. ROI:er från lillhjärnan/hjärnstammen inspekterades visuellt för att söka efter lämpliga ROI:er, dvs. ROI:er med ett bra signal-brusförhållande och dominerande långsamma BOLD-vågor. Följande ROI:er identifierades: 96, 98, 100, 103 och 105. Siffrorna anger ROI-beteckningarna enligt AAL-atlasen. Udda och jämna nummer betecknar vänster respektive höger hemisfär.
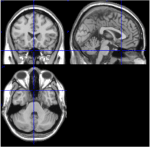
Figur 1. T1-bilder från mediala, sagittala och axiella skikt från en försöksperson (Talairach space 0, 20, -34). I den sagittala skivan (övre högra bilden) syns pons tydligt och i den axiella skivan (nedre bilden) dokumenteras närheten till lillhjärnan och hjärnstammen.
Beräkning av medelvärdet av blod-oxygennivåberoende, slag till slag-intervall och andningsvågor
Medelvärdeberäkning gör det möjligt att förbättra signal-brus-förhållandet, men det kräver att man använder en trigger. Eftersom inga sådana triggers finns tillgängliga i vilodata användes de rytmiskt förekommande maxima (toppar) i RRI-signalen (Pfurtscheller et al., 2017): Först identifierades de mest framträdande topparna i RRI-signalerna med minst flera sekunders mellanrum. När det gäller 0,1 Hz-svängningar var dessa intervall mellan topparna cirka 10 s, och när det gäller 0,15 Hz-svängningar var de cirka 7 s (ett exempel visas i figur 2 med de nästan lika långa streckade vertikala linjerna). De markerade RRI-topparna användes som utlösare för medelvärdesbildning (epoker med 6 s före och 6 s efter utlösaren) över BOLD-, RRI- och andningssignalerna.
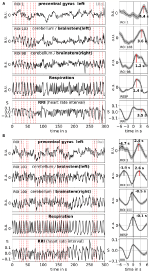
Figur 2. Exempel på pågående BOLD-, RRI- och andningssignaler och motsvarande genomsnittliga vågor (±SE) för två försökspersoner, en med dominerande 0,1 Hz och en med dominerande 0,15 Hz-svängningar . De vertikala streckade linjerna i panelerna på vänster sida anger maxima (toppar) för RRI-svängningar som används som trigger för medelvärdesbildning. Toppar av de medelvärdesberäknade vågorna anges i panelerna på höger sida.
Resultat
Låga BOLD-svängningar i lillhjärnan/hjärnstammen kännetecknas av sin gynnsamma signalkvalitet, men ännu viktigare är att de sammanfaller med svängningar i RRI och andning. Som rapporterats i Rassler et al. (2018) rådde 0,1 Hz-svängningar under ~37 % av inspelningstiden, medan 0,15 Hz-svängningar rådde under ~45 %. Två karakteristiska exempel på 0,1-Hz-svängningar (försöksperson 1Rb1) och 0,15-Hz-svängningar (försöksperson 11Ra1) visas i figur 2. I båda fallen sammanfaller RRI-svängningar av stor magnitud med andningen i form av en RRI-ökning under inspiration och återspeglas också tydligt i BOLD-signalerna i hjärnstammen. Den varierande dynamiken hos spontana oscillationer respektive singelvågor i vila ger starka bevis för att det inte bara finns en utan flera olika kardiovaskulära rytmer med frekvenskomponenter nära 0,1 och 0,15 Hz. Vissa av dessa rytmer förstärks under ångestbearbetning, andra inte, och vissa är synkroniserade i prefrontal cortex och hjärnstammen och andra inte.
Exempel på spontana signaler och medelvärdesbildade vågor från två karakteristiska försökspersoner visas i figur 2. De genomsnittliga vågorna med markerade topplatenser (avstånd från RRI-toppen) för alla försökspersoner visas i figur 3. Noterbart är att den relativt lilla variansen hos de genomsnittliga BOLD-vågorna i hjärnstammen understryker toppmätningarnas tillförlitlighet.
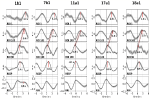
Figur 3. Genomsnittliga vågor (±SE) av BOLD-signaler från vänster precentral gyrus (ROI 1), vänster hjärnstam (BOLDn, ROI 103, 105), höger hjärnstam (BOLDv, 96, 98, 100), andning och RR-intervall (från toppen till botten) från alla fem försökspersoner. Topplatenserna (skillnad från RRI-toppen) från viktiga toppar är markerade. Tidsförskjutningen på 2-3 s mellan de två BOLD-signalerna från lillhjärnan/hjärnstammen anges med en streckad linje.
BOLD-vågen i den högra hjärnhalvan som föregick andningsvågen med 0,3 ± 0,2 s tolkades som BOLDv och BOLD-vågen i den vänstra hjärnhalvan som låg efter andningsvågen med 2,3 ± 0,5 s togs som BOLDn. Den största skillnaden mellan BOLDv- och BOLDn-vågorna var 2,6 ± 0,4 s.
De medelvärdesberäknade vågorna i figur 3 belyser den tydliga fasförskjutningen mellan de två BOLD-signalerna i hjärnstammen (BOLDn, BOLDv) hos alla fem försökspersoner. Toppskillnader anges med streckade linjer. Förutom de två BOLD-signalerna från hjärnstammen analyserades BOLD-signalen från vänster precentral gyrus (ROI 1) som kontroll. Även om de genomsnittliga BOLD-vågorna i prefrontal cortex (PFC) uppvisar en förhöjd varians (SE), stämmer de förvånansvärt väl överens med BOLDn-vågorna i cerebellum/hjärnstammen. Detta bekräftar den starka interaktionen mellan PFC och hjärnstammen i det långsamma frekvensområdet runt 0,1 Hz.
Diskussion
Koincidens mellan andningsvågor och respiratorisk blodsyresnivåberoende artefakt
Att andas åtföljs inte bara av bröstkorgsrörelser utan även av rörelser i de cerebrala blodkärlen (Birn et al., 2006). En stabil tidsförskjutning på 0,3 ± 0,2 s observerades mellan den positiva toppen av BOLDv-signalen i höger lillhjärna/hjärnstam och maximum för varje andningsvåg (början av utandning). Andningen var spontan, och andningstoppen fördröjde BOLDv-toppen, vilket möjligen tyder på en livlig vasomotion i arteria basilaris, ett stort blodkärl nära den rostrala sidan av pons. Denna vasomotion kan betraktas som en andningsartefakt som orsakas av en andningsmodulering av sympathoexcitatoriska neuroner i den rostroventrolaterala retikulära kärnan. Ett tydligt inflytande från den centrala andningsmönstergeneratorn på den sympatiska nervaktiviteten har observerats hos många arter, inklusive människan (Haselton och Guyenet, 1989; Häbler och Jänig, 1995; Eckberg, 2003; Mandel och Schreihofer, 2006). Minskad aktivitet hos dessa neuroner i rostroventrolaterala medulla (dvs. sympatisk depression) under inspiration och en plötslig återökning av aktiviteten när de freniska utbrotten upphör är ett av de dominerande mönstren för respiratorisk-sympatisk koppling (Haselton och Guyenet, 1989). Dessa andningsmodulerade sympatiska svängningar orsakar maximal vasodilatation i slutet av inspirationen (dvs, maximum av BOLD-signalen omedelbart före starten av expirationen) och vasokonstriktion under expirationen (minimum av BOLD-signalen strax före starten av inspirationen).
Rytmisk neuronal aktivering associerad med neurala blodsyresnivåberoende svängningar
BOLD-svängningar (BOLDn) låg 2 år efter den periodiska andningsartefakten (BOLDv).Båda BOLD-svängningarna registrerades samtidigt i axiella skivor, där BOLDn var förknippad med neuronal aktivitet som drivkraft för spontan andning och BOLDv reflekterade en kärlrörelse i samband med början av utandningen. Denna tidsfördröjning på 2-3 s motsvarar den neurovaskulära kopplingstiden (Mateo et al., 2017).
Varierade externa influenser på känslor som framkallas av den obekväma liggande positionen på rygg med försökspersonens huvud i ett begränsat bullerutrymme kan aktivera primära sensoriska områden först och följas av kortikal projektion till hjärnstammarnas andningsneuroner. Dessutom ändrar inre, beteendemässiga influenser som härrör från högre centra det metaboliska andningsmönstret. Den slutliga andningsutgången inbegriper en komplex interaktion mellan kortikala strukturer, hjärnstammen och det limbiska systemet och är karakteristisk för emotionell andning (Homma och Masaoka, 2008; Kato et al., 2018). Därför är det ganska troligt att oscillationerna i vänster precentral gyrus (ROI 1) var synkroniserade med de långsamma, neuralt inducerade BOLD-svängningarna i lillhjärnan/hjärnstammen.
Neural aktivitet fungerar som ”drivkraft” för långsamma hjärtrytmoscillationer
Den varierande dynamiken i kopplingsmönstren som observerades i viloläget pekar på en mängd olika kardiovaskulära rytmer i frekvensbandet mellan 0,1 och 0,15 Hz. Detta understryker vikten, flexibiliteten och komplexiteten i interaktionen mellan hjärna och hjärta och förtjänar ytterligare intensiv forskning.
I alla fem deltagarna var kopplingsmönstret mellan andning och HR helt motsatt den typiska RSA (Rassler et al., 2018), nämligen att RRI ökade under inspiration och minskade under utandning. Under ångestframkallande situationer tenderar andningen att vara snabbare och den vagala aktiviteten minskas, vilket leder till en högre HR (kortare RRI). När andningen däremot är omedvetet/autonomt minskad i en ångestframkallande situation kan den vagala aktiviteten öka, vilket resulterar i en lägre HR (större RRI). Det verkar som om inte bara kortikal aktivering inducerar en nästan samtidig RRI-ökning (Barry, 1983; Damen och Brunia, 1987; Pfurtscheller och Lopes da Silva, 1999; Pfurtscheller et al., 2013), utan vår studie ger för första gången belägg för att även en central pacemaker i lillhjärnan/hjärnstammen kan fungera som drivkraft för inneboende RRI-svängningar och spontana långsamma andningsvågor. Detta fynd stöder starkt Perlitz et al. (2004) arbete om ”0,15-Hz-rytmen”
Begränsningar och framtida utsikter
Utvalet av ROI:er med BOLD-signaler av god kvalitet i lillhjärnan/hjärnstammen gjordes genom visuell inspektion. Detta inkluderade differentiering mellan BOLD-svängningar av neuralt ursprung och rörelseartefakter. Det senare betecknar BOLD-signaler som är tidsbundna med andning. För vidare studier rekommenderas att beräkna faslåsningsvärden (PLV; Pfurtscheller et al., 2017) mellan RRI och enskilda BOLD-signaler i lillhjärnan/hjärnstammen. Dessutom kan den synkrona utvärderingen av ventilationsmetriker, t.ex. tidalvolym/respirationsvolym per tid, end-tidal pCO2 och typ av andning (näsa vs. mun), liksom användningen av olika denoisingmetoder i kliniska och djurexperimentella miljöer, ge djupare insikter i de komplexa interaktionerna mellan de inblandade regleringssystemen.
Den ”avstängda” respiratoriska sinusarytmin är ett undantag från ett fundamentalt fysiologiskt fenomen som kan förekomma t.ex. i ångestframkallande situationer. Bland 23 friska deltagare i en fMRI-studie uppvisade endast fem personer detta paradoxala kopplingsmönster.
En förutsättning för BOLD-analys (Bn och Bv) i hjärnstammen är ett sammanträffande av långsam andning och RRI-svängningar; en sådan 1:1-koppling kan dock endast hittas hos en minoritet av deltagarna. Därför är denna typ av analys begränsad till dessa sällsynta fall. Icke desto mindre skulle vi anta att en central pacemaker i hjärnstammen också är vanlig hos personer med normal RSA och 1:2- eller 1:3-koppling (två eller tre andetag under en RRI-cykel). De första resultaten från beräkningen av faskoppling (PLV) mellan BOLD-svängningar från hjärnstammen och RRI-svängningar i 0,1- till 0,15 Hz-bandet stöder detta antagande. Med denna metod är det möjligt att mäta pacemakeraktivitet i hjärnstammen oberoende av andningsfrekvensen. Detta arbete pågår.
Det måste noteras att nivån av statsångest hos individerna med långsam spontan andning varierade mellan AS = 14 och AS = 28 (möjligt intervall för AS-poäng: 10-40) och inte alla individer med förhöjda ångestpoäng uppvisade denna typ av långsam andning. Vi drar därför slutsatsen att det inte finns något tydligt samband mellan långsam spontanandning och ångestbearbetning.
Slutsats
1. BOLD-svängningar i vila från lillhjärnan/hjärnstammen kan ha växlande frekvenser mellan 0,1 och 0,15 Hz, liknande dem som rapporterats i RRI- och andningssignaler (Rassler et al., 2018).
2. Vissa BOLD-signaler från lillhjärnan/hjärnstammen kan påverkas av vasomotorik (arteria basilaris), medan andra kan vara förknippade med en central pacemakeraktivitet i hjärnstammen. Följaktligen skulle den faktiska tidpunkten för andningens början samt dess neurala källa kunna upptäckas i BOLD-signalerna.
3. Båda BOLD-signalerna med olika ursprung som registreras samtidigt karaktäriserar en gemensam källa, vilket stödjer Perlitz et al. (2004).
4. Resultaten tyder på att det finns belägg för en omedveten känslomässig andning vid 6-9/min (0,1-0,15 Hz), som – på samma sätt som en medveten resonansandning vid 6/min (0,1-0,15 Hz).1 Hz) främjar psykologiskt välbefinnande (Mather och Thayer, 2018) – också höjer HRV och kan underlätta bearbetningen av negativa känslor.
Datatillgänglighet
Datauppsättningarna som genererades för den här studien är tillgängliga på begäran till motsvarande författare.
Etikutlåtande
Den här studien genomfördes i enlighet med rekommendationerna i Helsingforsdeklarationen från 1964 med skriftligt informerat samtycke från alla försökspersoner. Alla försökspersoner gav skriftligt informerat samtycke i enlighet med Helsingforsdeklarationen. Protokollet godkändes av etikkommittén vid universitetet i Graz.
Författarbidrag
GP bidrog till konceptualisering och originalutkast. BR och AA hjälpte till med metodik, databehandling, statistik, skrivande och visualisering. AS, BR, GS, WK och JT granskade och redigerade manuskriptet.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Författarna vill tacka Thomas Zussner, David Fink och Karl Koschutnig, University of Graz, för stöd vid datainsamling.
Abkortningar
BOLD, Blood-oxygenation-level-dependent; EKG, elektrokardiogram; (f)MRI, (funktionell) magnetisk resonanstomografi; HR, hjärtfrekvens; HRV, hjärtfrekvensvariabilitet; PFC, prefrontala hjärnbarken; ROI, region av intresse; RRI, beat-to-beat-intervall; RSA, respiratorisk sinusarytmi.
Barry, R. J. (1983). Primär bradykardi och den framkallade hjärtresponsen i samband med operationssalen. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A. och Bandettini, P. A. (2006). Separering av andningsvariationsrelaterade fluktuationer från neuronala aktivitetsrelaterade fluktuationer i fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J. och Liu, T. T. (2004). Modellering av det hemodynamiska svaret på hjärnans aktivering. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). Förändringar i hjärtfrekvens och långsamma hjärnpotentialer relaterade till motorisk förberedelse och stimulusförväntning i en tidsbedömningsuppgift. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). Den mänskliga respiratoriska porten. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J. och Jänig, W. (1995). Samordning av sympatiska och respiratoriska system: neurofysiologiska experiment. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). Central respiratorisk modulering av medullära sympathoexcitatoriska neuroner hos råtta. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Andningsrytmer och känslor. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.04242424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Mayer-vågornas gåta: fakta och modeller. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K. och Homma, I. (2018). Samband mellan karaktärsdrag och andningsparametrar under lugn andning hos normala personer. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M. och Langhorst, P. (1998). Simultana förändringar av rytmisk organisation i hjärnstamsneuroner, andning, kardiovaskulärt system och EEG mellan 0,05 Hz och 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A. och Schreihofer, A. M. (2006). Central respiratorisk modulering av barosensitiva neuroner i råttans kaudala ventrolaterala medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y. och Kleinfeld, D. (2017). Entrainering av arteriole vasomotoriska fluktuationer av neuronal aktivitet är en grund för blod-oxygenationsnivåberoende ”vilotillstånds”-konnektivitet. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Hur hjärtfrekvensvariabilitet påverkar känsloreglerande hjärnnätverk. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI vid 7 Tesla, med 16-faldig acceleration med hjälp av partiell parallell avbildning med tillämpning på hög spatial och temporal fMRI för hela hjärnan. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D. och Murphy, F. (2015). Klaustrofobi vid magnetisk resonanstomografi: en systematisk översikt. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontana lågfrekventa svängningar av cerebral hemodynamik och metabolism hos vuxna människor. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Kardiovaskulära rytmer i 0,15 Hz-bandet: gemensamt ursprung för identiska fenomen hos människa och hund i hjärnstammens retikulära formation? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). Händelserelaterad EEG/MEG-synkronisering och desynkronisering: grundläggande principer. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Kommunikation mellan hjärna och hjärta: bevis för ”central pacemaker”-oscillationer med en dominerande frekvens på 0,1 Hz i cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synkronisering av inneboende 0,1-Hz blod-oxygennivåberoende oscillationer i amygdala och prefrontal cortex hos personer med ökad tillståndsångest. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C. och Müller-Putz, G. R. (2013). Brisk hjärtfrekvens och EEG-förändringar under utförande och undanhållande av cue-paced foot motor imagery. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S. och Pfurtscheller, G. (2018). ”Avstängning” av respiratorisk sinusarrytmi kan förekomma hos en minoritet av försökspersoner under funktionell magnetresonanstomografi (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard och kopplingen mellan hjärta och hjärna: vidareutveckling av en modell för neurovisceral integration. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automatiserad anatomisk märkning av aktiveringar i SPM med hjälp av en makroskopisk anatomisk parcellation av MNI MRI hjärnan för en enskild försöksperson. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Respiratorisk sinusarrytmi: varför synkroniseras hjärtslaget med andningsrytmen? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Hur andningskontroll kan förändra ditt liv: en systematisk genomgång av psykofyiologiska korrelat till långsam andning. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar
.