Introduktion
Neutrofiler är den vanligaste populationen av cirkulerande vita blodkroppar och värdens första försvarslinje mot invaderande patogener. Under normala förhållanden har cirkulerande neutrofiler en halveringstid på 6-12 timmar och är funktionellt vilande. Under inflammation anländer neutrofiler snabbt till infektions- och skadeplatserna, ökar den antimikrobiella aktiviteten och dör i den infiltrerade vävnaden . De spelar viktiga roller i det medfödda immunsystemet, och betydande neutrofila reaktioner observeras vid systemisk inflammation såsom trauma, brännskador, sepsis och större kirurgi .
Däremot kan dysreglering av neutrofila reaktioner såsom överdriven eller okontrollerad frisättning av proinflammatoriska cytokiner orsaka skador på vävnaden eller organet i värdväxten vid allvarlig sepsis och autoimmuna sjukdomar .
Terapi för avlägsnande av leukocyter (LRT), leukocytaferes (LCAP) eller granulocyt/monocytaferes (GMA) är en metod för terapeutisk aferes där perifera leukocyter avlägsnas via extrakorporeal cirkulation. Den har använts som icke-farmakologisk behandling vid ulcerös kolit (UC) och Crohns sjukdom (CD) och har visat utmärkt effekt på kort sikt .
LCAP med hjälp av Cellsorba, en kolonn av polyetenteleftalatfibrer (Asahi-Kasei Medical, Tokyo, Japan), har rapporterats kunna avlägsna ~100 % granulocyter/monocyter, ~60 % lymfocyter och ~50 % trombocyter från både in- och utloppet av Cellsorba-apparaten . Även om de exakta mekanismerna för LRT inte har undersökts till fullo har deras potentiella mekanismer rapporterats, vilket inkluderar en minskning av antalet aktiverade leukocyter eller proinflammatoriska cytokiner såsom tumörnekrosfaktor (TNF)-α, interleukin (IL)-1β, IL-6 och IL-8 .
Infektioner på operationsstället (SSI) är fortfarande en av de vanligaste orsakerna till sjuklighet vid större kirurgiska ingrepp, vilket förlänger sjukhusvistelsen och ökar sjukvårdskostnaderna . Den japanska prospektiva multicenterövervakningen visade att 19,5 % av patienterna med UC utvecklade SSI efter operation .
I en fall-kontrollstudie jämförde vi retrospektivt förekomsten av SSI mellan patienter som genomgick proktokolektomi med ileal pouch-anal anastomos (IPAA) (n=29) och de som genomgick IPAA med postoperativ LCAP (n=43). Postoperativ LCAP minskade signifikant SSI hos UC-patienter som genomgick proktokolektomi med IPAA (p<0,01) . I en prospektiv multicenterstudie som vi genomförde jämfördes förekomsten av SSI mellan UC-patienter som genomgick kirurgi (kontrollgrupp; n=103) och de som genomgick kirurgi med postoperativ LCAP (n=40). SSI förekom hos 4 av 37 patienter (10,8 %) i LCAP-gruppen, medan de förekom hos 29 av 103 patienter (28,2 %) i kontrollgruppen, även om skillnaden inte nådde statistisk signifikans (p=0,069) .
Dessa kliniska observationer tyder på att LCAP avlägsnar proinflammatoriska cytokinproducerande aktiverade leukocyter vid postoperativ systemisk inflammation på grund av större kolorektalkirurgi och kan undertrycka förekomsten av SSI. Vi har rapporterat ett samband mellan neutrofil dysfunktion och postoperativa infektionskomplikationer .
Neutrofiler är de vanligaste cellerna bland cirkulerande leukocyter och kan oftast avlägsnas av LCAP . Därför fokuserade vi på funktionerna hos cirkulerande neutrofiler som isolerats före och efter LCAP, för att klargöra de terapeutiska mekanismerna för postoperativ LCAP på förekomsten av SSI hos UC-patienter efter operation.
Material och metod
Patienter
Fyrtiotre patienter med UC som genomgick IPAA fick postoperativ LCAP vid avdelningen för gastrointestinal och pediatrisk kirurgi vid Mie University Graduate School of Medicine från 2004 till 2008. Diagnosen UC baserades på kliniska, radiografiska, endoskopiska, kirurgiska och histopatologiska data. Före operationen fick patienterna olika medicinska behandlingar inklusive antiinflammatoriska läkemedel (aminosalicylater, kortikosteroider) eller immunsupprimerande läkemedel (azathioprin, mercaptopurin, ciklosporin), eller båda. Postoperativ LCAP utfördes en gång inom 2 timmar efter operationen. Patienter med kliniska symtom på sepsis uteslöts från studien. Patienter med instabil hemodynamik efter operationen exkluderades också enligt protokollet. Skriftligt informerat samtycke inhämtades från alla patienter innan studien påbörjades, som utfördes i enlighet med Helsingforsdeklarationen och godkändes av Institutional Review Board (nr 474).
Neutrofil isolering
Nutrofiler före och efter LCAP isolerades från samma patienter före och efter operationen. Neutrofil isolering baserades på ett tidigare beskrivet förfarande . Blodproverna (10 ml) späddes med en lika stor volym fosfatbuffrad saltlösning (PBS), skiktades över en volym Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) och centrifugerades vid 600 × g i 30 minuter i rumstemperatur. Efter avlägsnande av mononukleära celler, plasma och Ficoll-Paque PLUS resuspenderades pelleten i 12 ml ammoniumkloridlösning för att lysera de röda blodkropparna, tvättades två gånger i PBS och resuspenderades i PBS. Neutrofilerna tvättades två gånger med PBS och återuppslammades i TCM-10 . Cellpreparaten testades med avseende på livsduglighet (>99%) genom trypanblåsexklusion och renhet (>95% CD13+, CD33+ granulocyter) genom flödescytometri.
Fagocytisk aktivitet
Ex vivo fagocytisk aktivitet hos cirkulerande neutrofiler mot Escherichia coli jämfördes mellan neutrofiler före och efter LCAP isolerade från identiska patienter.
Neutrofil fagocytos mättes med fluorescerande biopartiklar . För att opsonisera de bakteriella biopartiklarna blandades det rekonstituerade opsoniseringsreagenset och de bakteriella biopartiklarna (5 × 105), virvlades och inkuberades i 1 timme vid 37 °C i en befuktad inkubator med 5 % koldioxid. Efter två tvättar med PBS, separerade genom låghastighetscentrifugering (1500 × g, 15 min, 4 °C), inkuberades pelletsen med neutrofiler (5 × 105) i 1 ml medium utan antibiotika i 3 timmar vid 37 °C i en befuktad inkubator med 5 % koldioxid. Efter 3 timmars inkubation analyserades neutrofilernas fagocytiska aktivitet mot E. coli med hjälp av en FACScan (Becton-Dickinson, San Jose, CA, USA) och 10 000 händelser räknades per prov.
Förberedelse av E. coli
Escherichia coli (ATCC25922) köptes från American Type Culture Collection (Manassas, VA, USA) och odlades i Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokyo, Japan) i 10 timmar vid 37 °C. Odlingsmediet centrifugerades vid 1 700 × g i 10 minuter i rumstemperatur för att erhålla en pellet, som tvättades två gånger och resuspenderades i steril normal koksaltlösning. En alikvot (100 μL) av suspensionen späddes seriellt med steril koksaltlösning, plattades ut på Agar-B (Qbiogene, Carlsbad, CA, USA) och inkuberades i 18 timmar för att bestämma bakteriekoncentrationen. Återstoden förvarades vid -80°C fram till användning.
Ko-odling av neutrofiler med E. coli
Kurtigt före användning späddes E. coli-suspensionen i medium för att uppnå en slutkoncentration på 2,5 × 106 cfu/mL. Efter opsonisering av E. coli med autologt serum i 30 minuter vid 37 °C kokulturerades neutrofiler (2,5 × 105 /mL) i 1 ml medium utan antibiotika i 3 timmar vid 37 °C i en befuktad inkubator med 5 % CO2. Efter centrifugering av cellerna vid 600 × g i 10 min vid 4 °C samlades supernatanterna upp för att analysera cytokinproduktion, neutrofil elastas (NE) och neutrofilernas livsduglighet.
Neutrofilernas livsduglighet
Ex vivo livsduglighet hos cirkulerande neutrofiler mot E. coli jämfördes mellan neutrofiler före och efter LCAP som isolerats från identiska patienter. För att utvärdera neutrofilernas livskraft efter samodling med E. coli utfördes en apoptosanalys.
Apoptos hos neutrofiler efter samodling med E. coli kvantifierades genom flödescytometri med hjälp av ett Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA). Neutrofilerna inkuberades i 1X bindningsbuffert till vilken 5 μL Annexin V-fluoresceinisotiocyanat (FITC) och 5 μL propidiumjodid (PI) tillsattes. Efter inkubation i rumstemperatur i 5 minuter i mörker analyserades cellerna med hjälp av en FACScan och 10 000 händelser räknades per prov.
Kombinationen av Annexin V-FITC och PI kunde skilja mellan tidiga apoptotiska celler (Annexin V+, PI-), nekrotiska celler (Annexin V-, PI+), sena apoptotiska eller sekundära nekrotiska celler (Annexin V+, PI+) och livskraftiga celler (Annexin V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Cytokiner i patienternas serum före och efter LCAP och supernatanter efter samodling av neutrofiler före och efter LCAP med E. coli mättes med ELISA enligt tillverkarens instruktioner. Cytokinerna omfattade TNF-α, IL-1-receptorantagonist (IL-1Ra), IL-6, IL-8 och NE. TNF-α, IL-1Ra, IL-6 och IL-8 ELISA-kits köptes från R&D Systems (Minneapolis, MN, USA). NE ELISA-kit köptes från Immundiagnostik (Bensheim, Tyskland). Detektionsgränserna för TNF-α, IL-1Ra, IL-6, IL-8 och NE var 1, 2, 0,01 och 2 pg/mL respektive 0,12 ng/mL, och nivåer under dessa gränser betraktades som odetekterbara. Nivån för varje cytokin utvärderades i två exemplar och det genomsnittliga cytokinvärdet beräknades.
Statistisk analys
Alla statistiska analyser gjordes med hjälp av JMP version 5 (SAS Institute, Cary, NC, USA). Sambanden mellan kontinuerliga och kategoriska variabler utvärderades med hjälp av Mann-Whitney U-test eller parat t-test när så var lämpligt. P<0,05 ansågs statistiskt signifikant.
Resultat
Patientkarakteristik
Tjugonio UC-patienter som genomgick IPAA fick postoperativ LCAP. Patienternas egenskaper visas i tabell 1. Medelåldern vid diagnosen var 27 år (intervall 15-54 år) och medelåldern vid operationen var 33 år (intervall 16-61 år). Sjukdomsdurationen var 6,9 år (intervall 0,1-28 år). Vänstersidig kolit fanns hos 6/29 (21 %) patienter och pan-kolit hos 23/29 (79 %) patienter. 7 (24 %), 11 (38 %), 11 (38 %), 11 (38 %) och 4 (38 %) klassificerades som lindriga, måttliga och 4 (38 %) som svåra.
| Patientkarakteristik | ||
|---|---|---|
| Variabler | Patienter (n=29) Antal | |
| Kön. | ||
| Man | 19 | |
| Kvinna | 10 | |
| Anslutningsålder vid diagnos | 27( 15-54) | |
| Ålder vid operation | 33(16-61) | |
| Sjukdomens varaktighet | 6.9 (0.1-28) | |
| Sjukdomens svårighetsgrad | ||
| lätt | 7 | |
| moderat | 11 | |
| svårt | 4 | |
| Sjukdomens omfattning | ||
| Vänster-sido kolit | 6 | |
| Pan colitis | 23 | |
| Malts graderingssystem | ||
| 1 | 7 | |
| 2 | 11 | |
| 3 | 8 | |
| 4 | 4 | |
| Total steroiddos (mg) | 17285 (800-70000) | |
| Användning av immunsuppressiva medel | ||
| Ja | 5 | |
| Nej | 24 | |
| Operationstid (min) | 262.4 (118-496) | |
| Blodförlust (ml) | 307,9 (17-826) | |
Tabell 1: Patientens egenskaper.
Tidsförloppsförändring av antalet WBC, neutrofiler och trombocyter
WBC, neutrofiler och trombocyter räknades före operationen, före LCAP (efter operationen) respektive efter LCAP (inom 12 timmar efter LCAP). Som framgår av figur 1 var antalet WBC, neutrofiler och trombocyter betydligt lägre efter LCAP än före LCAP. Alla patienter som fick postoperativ LCAP hade inga hematologiska biverkningar.
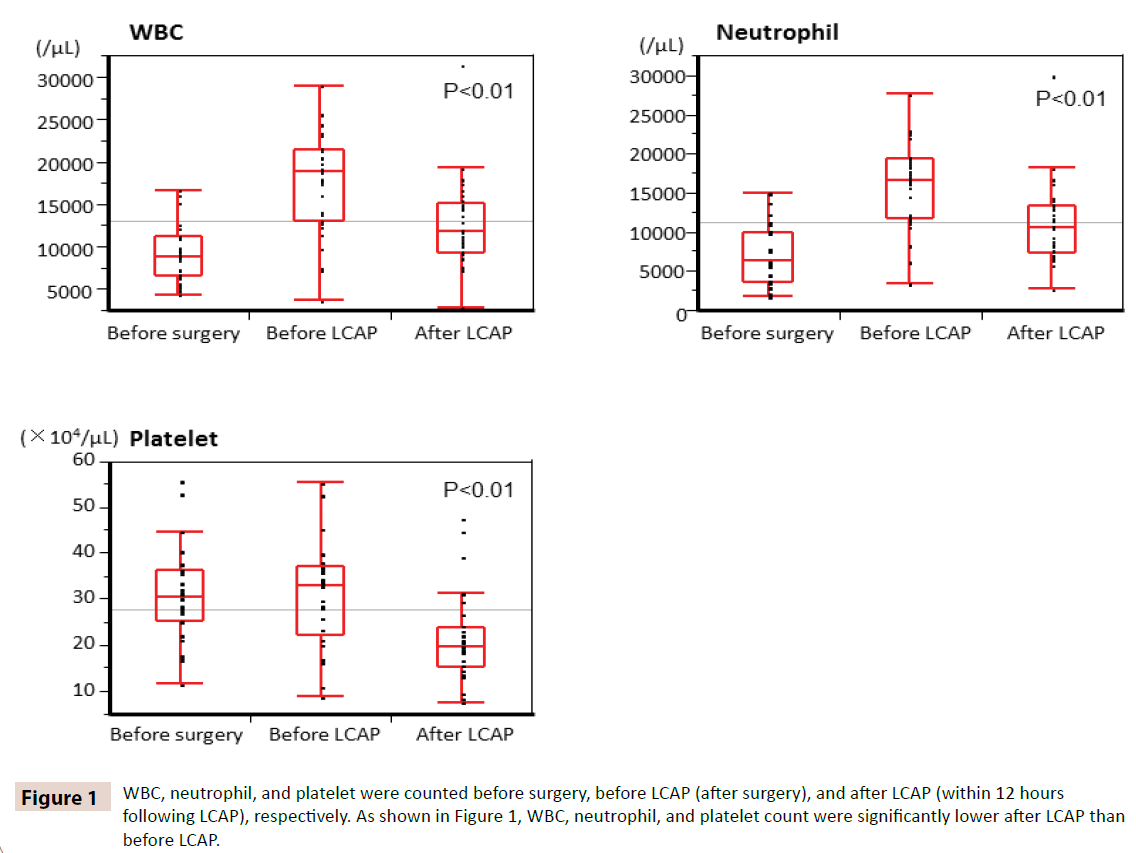
Figur 1: WBC, neutrofila och trombocyter räknades före operation, före LCAP (efter operation) respektive efter LCAP (inom 12 timmar efter LCAP). Som framgår av figur 1 var antalet WBC, neutrofiler och trombocyter signifikant lägre efter LCAP än före LCAP.
Fagocytisk aktivitet hos neutrofiler mot E. coli
För att klargöra om LCAP påverkar den fagocytiska aktiviteten hos cirkulerande neutrofiler jämfördes den fagocytiska aktiviteten mot E. coli mellan neutrofiler före och efter LCAP. Som visas i figur 2 observerades ingen signifikant skillnad i neutrofilernas fagocytiska aktivitet (genomsnittlig fluorescerande intensitet) mot E. coli mellan neutrofiler före LCAP (median 1259,4, intervall 50,8-3505,6) och efter LCAP (median 1077,6, intervall 24,4-4152,1) (P=0,72). Dessa resultat tyder på att LCAP inte påverkar den fagocytiska aktiviteten hos cirkulerande neutrofiler mot E. coli.
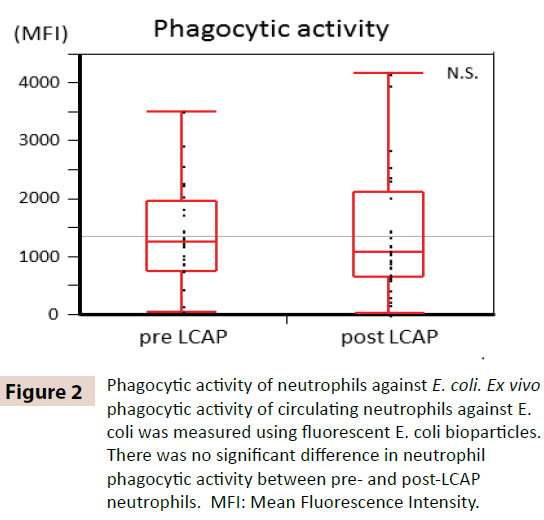
Figur 2: Neutrofilers fagocytiska aktivitet mot E. coli. Ex vivo fagocytisk aktivitet hos cirkulerande neutrofiler mot E. coli mättes med hjälp av fluorescerande E. coli-biopartiklar. Det fanns ingen signifikant skillnad i neutrofilernas fagocytiska aktivitet mellan neutrofiler före och efter LCAP. MFI: För att klargöra om LCAP påverkar neutrofilernas respons mot bakteriell infektion jämfördes neutrofilernas livsduglighet mot E. coli mellan neutrofiler före och efter LCAP. Procentandelen livskraftiga celler (Annexin V-, PI-), tidiga apoptotiska celler (Annexin V+, PI-), nekrotiska celler (Annexin V-, PI+) och sena apoptotiska eller sekundära nekrotiska celler (Annexin V+, PI+) jämfördes mellan neutrofiler före och efter LCAP. Som framgår av figur 3 var medianprocenten av livskraftiga neutrofiler som kokultiverats med E. coli högre i post-LCAP (median 34,2 %, intervall 1,16-77,7 %) än i pre-LCAP (median 27,9 %, intervall 0,53-89,7 %) neutrofiler, även om skillnaden inte uppnådde statistisk signifikans (P=0,82). Procentandelen nekrotiska neutrofiler som samodlades med E. coli var signifikant lägre hos neutrofiler efter LCAP (median 0,73 %, intervall 0,0-26,0 %) än hos neutrofiler före LCAP (median 1,14 %, intervall 0,0-26,0 %) (P=0,0232).
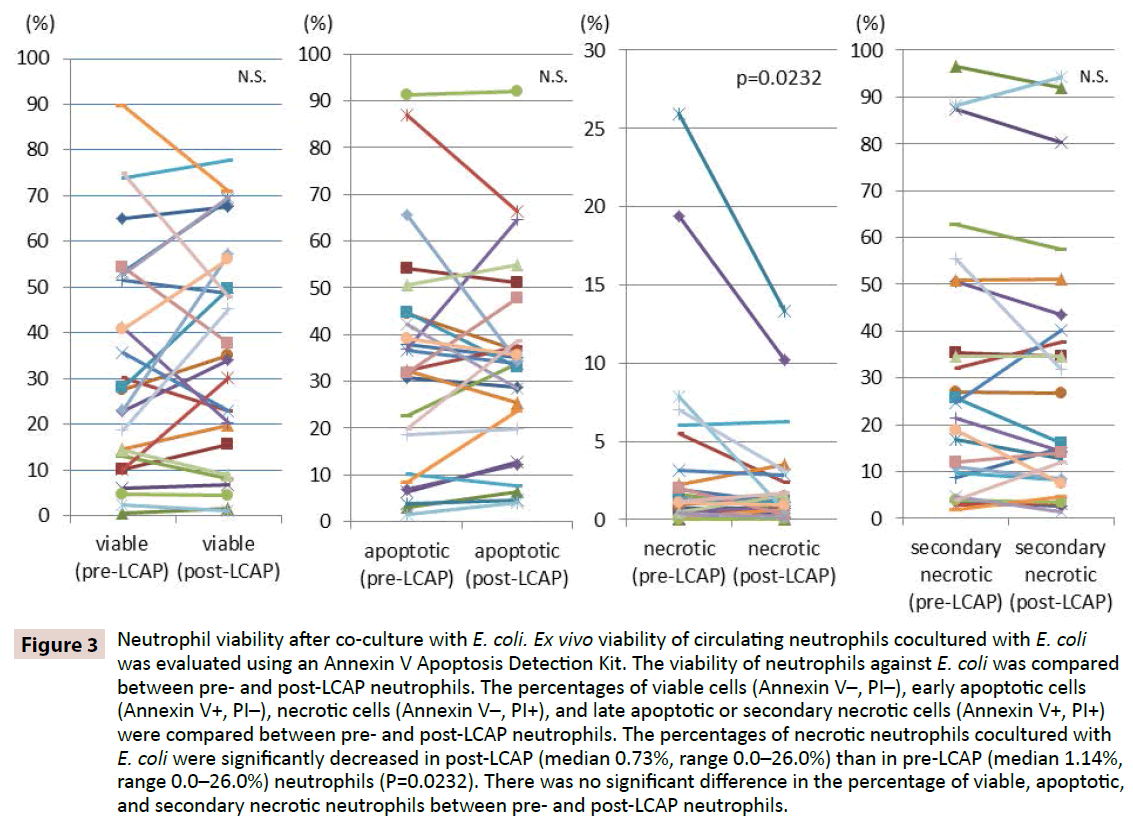
Figur 3: Neutrofilernas livsduglighet efter samodling med E. coli. Ex vivo-viabiliteten hos cirkulerande neutrofiler som kokulturerats med E. coli utvärderades med hjälp av ett Annexin V Apoptosis Detection Kit. Neutrofilernas livskraft mot E. coli jämfördes mellan neutrofiler före och efter LCAP. Procentandelen livskraftiga celler (Annexin V-, PI-), tidiga apoptotiska celler (Annexin V+, PI-), nekrotiska celler (Annexin V-, PI+) och sena apoptotiska eller sekundära nekrotiska celler (Annexin V+, PI+) jämfördes mellan neutrofiler före och efter LCAP. Procentandelen nekrotiska neutrofiler som kokultiverats med E. coli var signifikant lägre i post-LCAP (median 0,73 %, intervall 0,0-26,0 %) än i pre-LCAP (median 1,14 %, intervall 0,0-26,0 %) neutrofiler (P=0,0232). Det fanns ingen signifikant skillnad i andelen livskraftiga, apoptotiska och sekundärt nekrotiska neutrofiler mellan neutrofiler före och efter LCAP.
Ingen signifikant skillnad i andelen apoptotiska neutrofiler som kokulturerats med E. coli observerades mellan neutrofiler före LCAP (median 32,3 %, intervall 1,51-91,2 %) och efter LCAP (median 33,8 %, intervall 4,0-92,1 %) (P=0,57). Ingen signifikant skillnad i andelen sent apoptotiska eller sekundärt nekrotiska neutrofiler som kokulturerats med E. coli observerades också mellan neutrofiler före LCAP (median 23,1 %, intervall 1,81-96,5 %) och efter LCAP (median 16,1 %, intervall 1,44-94,3 %) (P=0.13).
Dessa resultat tyder på att LCAP kan minska den distinkta undergrupp av cirkulerande neutrofiler som inducerar nekros mot bakteriell infektion, och öka antalet livskraftiga (troligen oprimade) neutrofiler i den systemiska cirkulationen.
Cytokinproduktion av neutrofiler efter samodling med E. coli
För att klargöra om LCAP påverkar cytokinproduktionen av cirkulerande neutrofiler jämfördes cytokinnivåerna i odlingssupernatanter efter samodling med E. coli mellan neutrofiler före och efter LCAP. Som framgår av figur 4 fanns det ingen signifikant skillnad i NE-, TNF-α-, IL-6-, IL-8- och IL-1Ra-nivåerna i kultursupernatanter mellan neutrofiler före och efter LCAP. Dessa resultat tyder på att LCAP inte påverkar cytokinproduktionen hos cirkulerande neutrofiler mot E. coli.
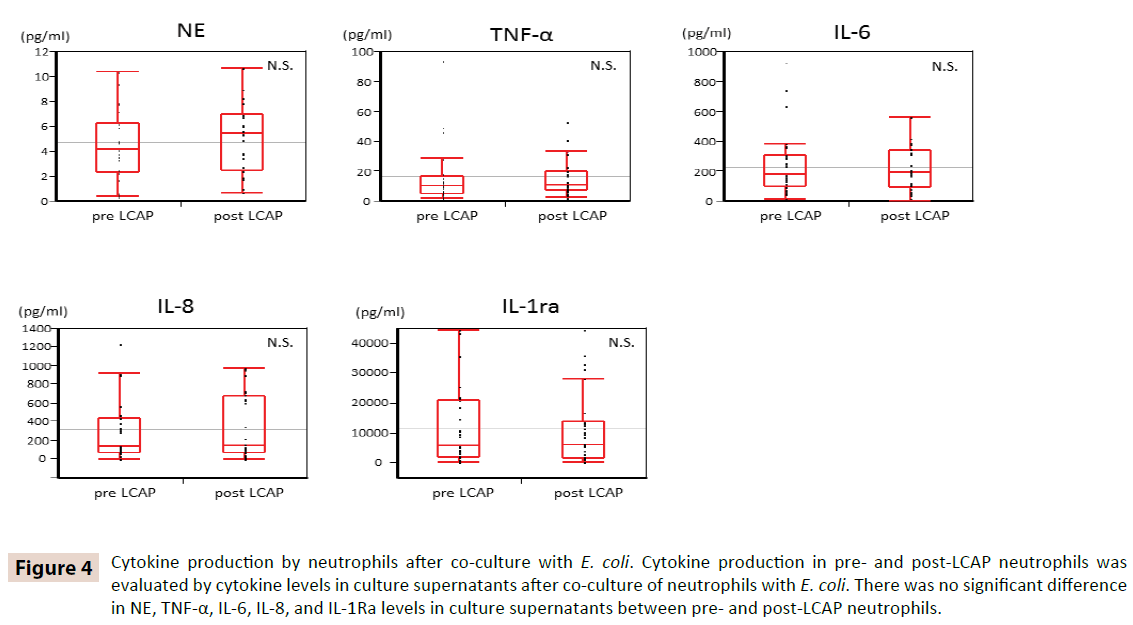
Figur 4: Cytokinproduktion av neutrofiler efter samodling med E. coli. Cytokinproduktionen i neutrofiler före och efter LCAP utvärderades genom cytokinnivåer i odlingssupernatanter efter samodling av neutrofiler med E. coli. Det fanns ingen signifikant skillnad i nivåerna av NE, TNF-α, IL-6, IL-8 och IL-1Ra i kultursupernatanter mellan neutrofiler före och efter LCAP.
Serumcytokiner före och efter LCAP
För att klargöra om LCAP påverkar värdens systemiska inflammatoriska svar mättes serumcytokiner med hjälp av blodprover som togs före och efter LCAP. Som framgår av figur 5 var serum NE efter LCAP (median 5,62 pg/mL, intervall 0,16-10,4 pg/mL) betydligt högre än före LCAP (median 2,87 pg/mL, intervall 0,15-7,61 pg/mL) (P=0,0251). Ingen signifikant skillnad hittades i serumnivåerna av TNF-α, IL-6, IL-8 och IL-1Ra före och efter LCAP.
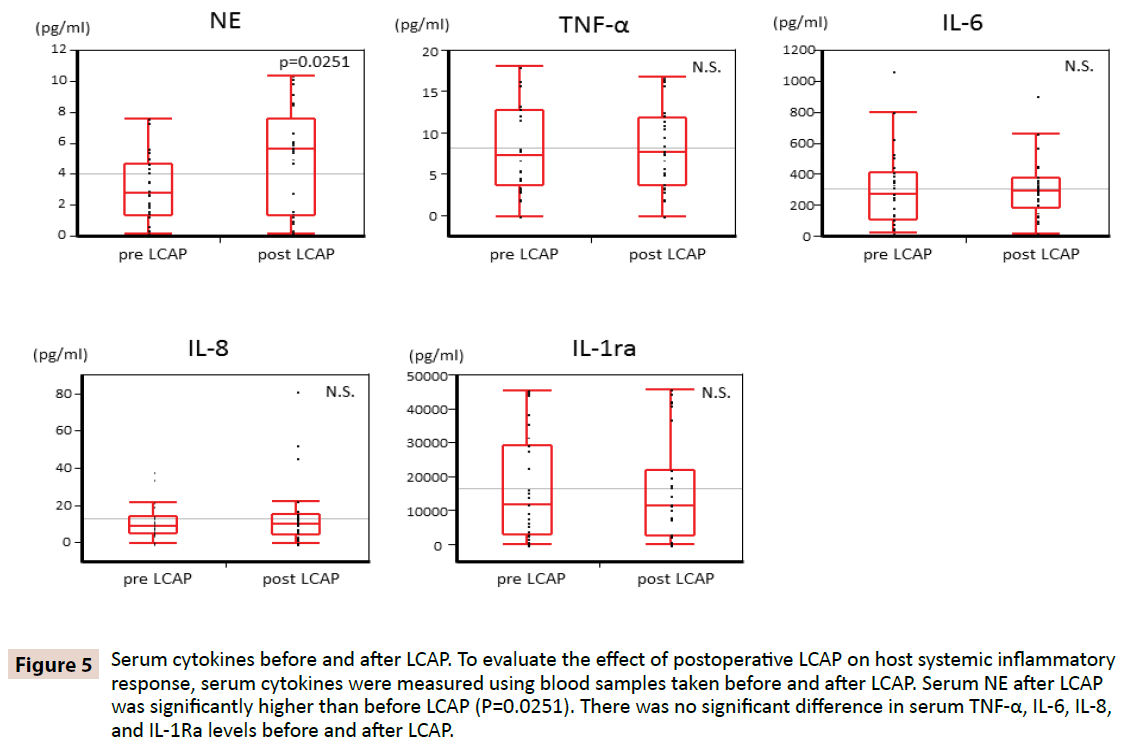
Figur 5: Serumcytokiner före och efter LCAP. För att utvärdera effekten av postoperativ LCAP på värdens systemiska inflammatoriska svar mättes serumcytokiner med hjälp av blodprover tagna före och efter LCAP. Serum NE efter LCAP var signifikant högre än före LCAP (P=0,0251). Det fanns ingen signifikant skillnad i nivåerna av TNF-α, IL-6, IL-8 och IL-1Ra i serum före och efter LCAP.
Samband mellan neutrofila funktioner efter LCAP och operationstid eller postoperativt antal neutrofiler
För att klargöra om cirkulerande neutrofila funktioner efter LCAP påverkar förekomsten av SSI undersökte vi sambandet mellan fagocytisk aktivitet eller cytokinproduktion av neutrofiler efter LCAP och riskfaktorer för SSI som är relaterade till kirurgisk stress, såsom operationstid, blodförlust och postoperativt antal neutrofiler.
Som framgår av figur 6 var NE i supernatanterna efter samodling av post-LCAP neutrofiler med E. coli signifikant högre hos patienter med operationstid >3 timmar (median 5,65 pg/mL, intervall 0,97-10.7 pg/mL) än hos dem med operationstid <3 h (median 1,05 pg/mL, intervall 0,72-2,44 pg/mL) (P=0,0158).
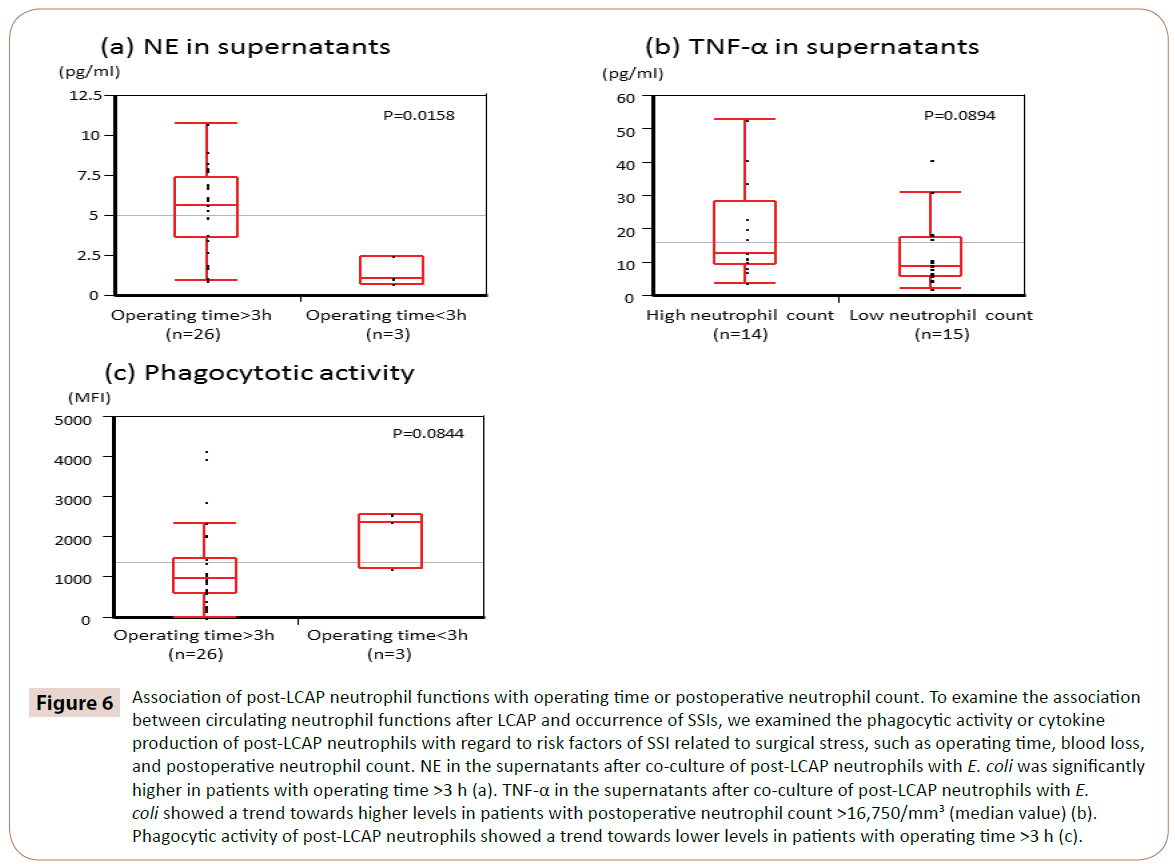
Figur 6: Samband mellan neutrofila funktioner efter LCAP och operationstid eller postoperativt neutrofilantal. För att undersöka sambandet mellan cirkulerande neutrofila funktioner efter LCAP och förekomst av SSI undersökte vi den fagocytiska aktiviteten eller cytokinproduktionen hos neutrofiler efter LCAP med avseende på riskfaktorer för SSI relaterade till kirurgisk stress, såsom operationstid, blodförlust och postoperativt neutrofilantal. NE i supernatanterna efter samodling av post-LCAP neutrofiler med E. coli var signifikant högre hos patienter med operationstid >3 timmar (a). TNF-α i supernatanterna efter samodling av post-LCAP neutrofiler med E. coli visade en trend mot högre nivåer hos patienter med postoperativt neutrofilantal >16 750/mm3 (medianvärde) (b). Den fagocytiska aktiviteten hos neutrofilerna efter LCAP visade en trend mot lägre nivåer hos patienter med operationstid >3 timmar (c).
TNF-α i supernatanterna efter samodling av neutrofilerna efter LCAP med E. coli visade en trend mot högre nivåer hos patienter med postoperativt neutrofilantal >16 750/mm3 (medianvärde) (P=0,0894).
Fagocytisk aktivitet hos neutrofiler efter LCAP mot E. coli visade en trend mot lägre nivåer hos patienter med operationstid >3 h (P=0,0844).
Samband mellan serum TNF-α efter LCAP och SSI
För att klargöra om värdens systemiska inflammatoriska svar efter LCAP påverkar förekomsten av SSI undersökte vi sambandet mellan serumcytokinnivåer efter LCAP och förekomst av SSI.
Som framgår av figur 7 visade serum TNF-α efter LCAP en trend mot högre nivåer hos patienter som utvecklade SSI än hos dem som inte utvecklade SSI (P=0,0714).
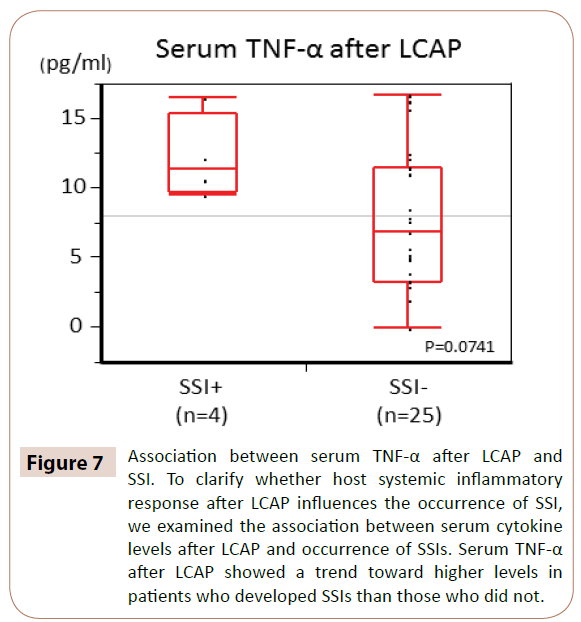
Figur 7: Sambandet mellan serum TNF-α efter LCAP och SSI. För att klargöra om värdens systemiska inflammatoriska svar efter LCAP påverkar förekomsten av SSI undersökte vi sambandet mellan serumcytokinnivåer efter LCAP och förekomst av SSI. Serum TNF-α efter LCAP visade en trend mot högre nivåer hos patienter som utvecklade SSI än de som inte gjorde det.
Det fanns ingen signifikant skillnad mellan serumnivåerna av IL-6, IL-8 och IL-1Ra efter LCAP och förekomst av SSI.
Diskussion
Flera möjliga verkningsmekanismer för LCAP eller GMA har rapporterats , även om deras exakta mekanismer inte har undersökts fullständigt. Variabiliteten i resultaten tycktes bero på skillnader i de blodceller som används för analyser (granulocyter, monocyter eller lymfocyter), metoder för blodprovstagning (tagna från inlopps- eller utloppsledningen eller perifer ven) och studieobjekten (friska frivilliga eller sjuka patienter).
De flesta undersökare använde sig av leukocyter som neutrofiler, monocyter eller lymfocyter som togs från inlopps- och utloppsledningarna i en extrakorporeal cirkulationsanordning . Leukocyter från utloppsledningarna är de återstående cellerna som filtreras av LCAP. De återförs omedelbart till patienternas systemiska cirkulation och blandas på nytt med de cirkulerande leukocyterna. Leukocyter från utloppslinjerna utgör den lilla andelen av alla cirkulerande leukocyter efter LCAP. För att klargöra LCAP:s systemiska effekt på värdens immunsystem använde vi cirkulerande neutrofiler som isolerats från perifera vener hos UC-patienter.
Strängt taget bör leukocytaferes (LCAP) benämnas som leukocytafiltrering, eftersom den inte bara kan avlägsna leukocyter utan också aktivera dem genom filtret. LCAP kan faktiskt inte absorbera och avlägsna alla blodkroppar som kommit in i den. Ett visst antal blodkroppar kan passera genom filtret och sedan återvända till cirkulationen. De filtrerade blodcellerna tros aktiveras genom filtrering av LCAP.
Neutrofiler är den mest rikliga populationen av leukocyter och de mest effektivt avlägsnade cellerna av LCAP. Det uppskattade antalet filtrerade leukocyter är nästan 1,1 × 1010 celler per enskild LCAP-session , vilket kan jämföras med avlägsnandet av nästan hälften av antalet cirkulerande neutrofiler (2 × 10-3 × 1010 celler). Vi undersökte därför den funktionella skillnaden mellan neutrofiler före LCAP och efter LCAP när det gäller svaret på E. coli för att klargöra de potentiella mekanismerna bakom den kliniska observationen att postoperativ LCAP minskade förekomsten av SSI. LCAP med hjälp av Cellsorba kan dock avlägsna och aktivera inte bara neutrofiler utan även de andra blodcellerna (monocyter, lymfocyter och trombocyter) med olika avlägsnandeeffekt. Därför är det nödvändigt att undersöka förändringen av svaret på E. coli på inte bara neutrofiler utan även de andra blodcellerna mellan före och efter LCAP, även om de inte bedömdes i den här studien.
Ett av de mest betydelsefulla resultaten i den här studien var det faktum att procentandelen nekrotiska neutrofiler reducerades signifikant när neutrofiler efter LCAP samkulturerades med E. coli, jämfört med neutrofiler före LCAP. Denna observation tyder på att LCAP minskar andelen neutrofiler som induceras till nekros av E. coli, och ökar andelen livsdugliga (troligen oprioriterade) neutrofiler i den systemiska cirkulationen.
Vid variation av procentandelen neutrofila livsdugliga, apoptos eller nekros vid samodling med E. coli observerades. I våra nyligen opublicerade data varierade procentandelen tidig apoptos (Annexin V+, PI-) i cirkulerande neutrofiler kraftigt från cirka 10 % till 90 % hos patienter med systemisk inflammation som t.ex. förhöjt C-reaktivt protein >0,3 mg/L. Dessa observationer tyder på att neutrofiler redan kan vara apoptotiska utan kokultur av E. coli på grund av högre kirurgiska insulter.
Nekros anses vara okontrollerad celldöd, och den verkar släppa ut giftiga syrearter och proteolytiska enzymer oväntat . Neutrofil nekros är känd som den primära orsaken till luftvägs- och lungskador i de intensivt inflammerade lungorna hos patienter med cystisk fibros . Postoperativ LCAP kan inducera rekrytering av en neutrofil undergrupp som är resistent mot oväntad eller okontrollerad nekrotisk celldöd mot bakteriell infektion i den systemiska cirkulationen, utöver avlägsnandet av aktiverade leukocyter som orsakar systemisk inflammation.
I motsats till ovanstående resultat av ex vivo-experiment var serum NE efter LCAP signifikant förhöjt. Den omedelbara minskningen av NE i serum efter LCAP observerades inte. En möjlig förklaring till detta är att en enda LCAP-session kanske inte i tillräcklig utsträckning undertrycker NE-frisättning från neutrofiler i hela kroppen vid operationsinducerad systemisk inflammation
Cirkulerande neutrofiler efter LCAP isolerade från patienter med längre operationstid (>3 h) eller högre postoperativt neutrofilantal (>16 750/mm3; medianvärde) uppvisade inte bara en högre produktionsaktivitet av NE eller TNF-α, utan även lägre fagocytisk aktivitet mot E. coli. Dessa resultat tyder på att neutrofiler isolerade från patienter med hög kirurgisk stress visar överdriven produktion av proinflammatoriska cytokiner eller försämrad fagocytisk aktivitet, även efter neutrofil förnyelse genom postoperativ LCAP.
Av 29 UC-patienter med postoperativ LCAP utvecklade endast fyra patienter (13,8 %) SSI. Deras serum TNF-α efter LCAP var högre än de utan SSI, även om skillnaden inte nådde statistisk signifikans. Därför kan serum TNF-α vara användbart för att identifiera patienter som kommer att utveckla SSI efter postoperativ LCAP. Däremot observerades inget samband mellan SSI-utveckling och neutrofilernas viabilitet, apoptos eller nekros vid samodling med E. coli, vilket delvis kan bero på liten provstorlek.
Nyligen har cirkulerande neutrofiler erkänts som en funktionellt heterogen population och differentiellt förberedda mot olika insulter . Vi har rapporterat den kliniska betydelsen av cirkulerande neutrofiler vid systemisk inflammation . Vi tror att cirkulerande neutrofiler kan vara det primära målet för att utforska den systemiska effekten av LCAP på värdens immunsystem.
Fortfarande har vissa forskare rapporterat att leukodepletion, som avlägsnar polymorfonukleära celler från den systemiska cirkulationen med hjälp av leukocytfilter, leder till en signifikant förbättring av lung- och njurfunktionen hos patienter som utvecklar ett systemiskt inflammatoriskt responssyndrom (SIRS) efter kardiopulmonär bypass . Leukodepletion med inriktning på neutrofiler kan vara fördelaktigt för att förhindra organsvikt på grund av SIRS .
Sammanfattningsvis tros detta vara den första rapporten som visar att postoperativ LCAP minskar den undergrupp av cirkulerande neutrofiler som inducerar nekros vid bakteriell infektion. Det kan vara fördelaktigt för förebyggande av SSI att minska den oväntade eller okontrollerade nekrotiska celldöd som orsakas av frisättning av toxiska eller proteolytiska substanser i den systemiska cirkulationen.
Acknowledgement
Författarna tackar Motoko Ueeda och Chihiro Hibi för att de har tillhandahållit utmärkt teknisk assistans.
Authorship Contribution
K.T., T.A. och M.K. utformade och utförde experimenten, analyserade och tolkade data och skrev manuskriptet. S.Y., Y.O. och S.K. utförde experimenten och analyserade data. Y.T., M.I., M.O., M.K., Y.I., K.U. och Y.M. utformade experimenten samt analyserade och tolkade data. C.M. och M.K. utformade experimenten och tolkade data.
Subventionsstöd och offentliggörande av finansiella arrangemang
Detta arbete stöddes delvis av bidrag från Japans ministerium för utbildning, kultur, sport, vetenskap och teknik (KAKENHI 23791523 till S.Y., 25861181 till Y.O. och 24791887 till M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Nuvarande status och framtida perspektiv för leukocytaferes vid inflammatorisk tarmsjukdom. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Faktorer som påverkar kort- och långtidseffekter av leukocytborttagningsbehandling vid aktiv ulcerös kolit. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Utvärdering av filtrationsleucocytaferes för användning vid behandling av patienter med reumatoid artrit. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytaferes med hjälp av ett filter för avlägsnande av leukocyter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunmodulerande effekter av granulocyt- och monocytadsorptionsaferes som behandling av patienter med ulcerös kolit. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro och in vivo utvärdering av Adacolumncytapheresis hos friska personer. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013)Riskfaktorer för kirurgiska infektioner hos japanska patienter med ulcerös kolit: en prospektiv multicenterstudie. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Faktorer som förutspår postoperativa infektionskomplikationer och tidig induktion av inflammatoriska mediatorer hos patienter med ulcerös kolit. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrofilrelaterad immunoinflammatorisk störning hos steroidöverdoserade ulcerös kolitpatienter. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunktion hos steroidöverdoserade patienter med ulcerös kolit: potentiell betydelse av macrophage migration inhibitory factor för ökad postoperativ morbiditet. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Klassificering av celldöd: rekommendationer från Nomenklaturkommittén för celldöd 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direkta bevis för sekundär nekros av neutrofiler under intensiv lunginflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse nya funktioner hos neutrofiler i immunitet, inflammation och bortom. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)Effekterna av leucodepletion hos patienter som utvecklar det systemiska inflammatoriska responssyndromet efter kardiopulmonär bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion av neutrofiler i blodet från patienter med sepsis: behandling för framtiden? IntImmunopharmacol17:1226-1232.