När ett ämne byter fas, det vill säga går från fast ämne till vätska eller från vätska till gas, krävs energi för att göra det. Den potentiella energin som finns lagrad i de interatomiska krafterna mellan molekylerna måste övervinnas av den kinetiska energin partiklarnas rörelse innan ämnet kan byta fas.
Om vi mäter temperaturen på ämnet som från början är fast när vi värmer upp det får vi fram ett diagram som figur 1.
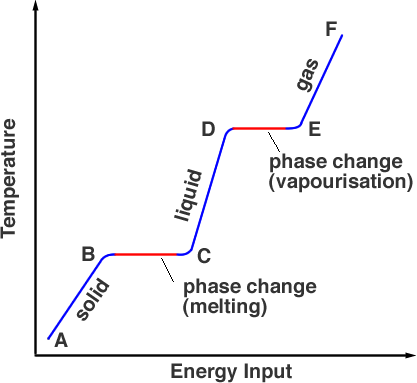
Med utgångspunkt från punkt A befinner sig ämnet i sin fasta fas, uppvärmning för temperaturen upp till smältpunkten, men materialet är fortfarande fast i punkt B. När det värms upp ytterligare går energin från värmekällan åt till att bryta de bindningar som håller atomerna på plats. Detta sker från B till C. I punkt C har hela den fasta fasen omvandlats till den flytande fasen. Återigen, när energi tillförs, går energin till partiklarnas rörelseenergi och höjer temperaturen (C till D). Vid punkt D har temperaturen nått kokpunkten men är fortfarande i flytande fas. Från punkt D till E övervinner värmeenergin bindningarna och partiklarna har tillräckligt med rörelseenergi för att fly från vätskan. Ämnet går in i gasfasen. Efter E kan ytterligare uppvärmning under tryck höja temperaturen ytterligare, det är så en tryckkokare fungerar.
Fusions- och förångningsvärme
Den energi som krävs för att byta fas hos ett ämne kallas latent värme. Ordet latent betyder gömd. När fasförändringen är från fast ämne till vätska måste vi använda den latenta fusionsvärmen, och när fasförändringen är från vätska till gas måste vi använda den latenta förångningsvärmen.
Den energi som krävs är Q= m L, där m är ämnets massa och L är den specifika latenta fusions- eller förångningsvärmen, som mäter värmeenergin för att förändra 1 kg av ett fast ämne till en vätska.
Tabell 1. visar
| Substans | Specifik latent fusionsvärme kJ.kg-1 |
°C | Specifik latent förångningsvärme kJ.kg-1 |
°C |
|---|---|---|---|---|
| Vatten | 334 | 0 | 2258 | 100 |
| Etanol | 109 | -114 | 838 | 78 |
| Ethansyra | 192 | 17 | 395 | 118 |
| Chloroform | 74 | -64 | 254 | 62 |
| Kvicksilver | 11 | -39 | 294 | 357 |
| Svavel | 54 | 115 | 1406 | 445 |
| Vätgas | 60 | -259 | 449 | -253 |
| Syra | 14 | -219 | 213 | -183 |
| Stickväte | 25 | -210 | 199 | -196 |
Heat Pipes
När tätheten av transitorer i en mikroprocessor ökar, ökar mängden värme som avges. En Pentium 4-processor (180 nm som körs vid 2 GHz) avger 55 watt effekt i form av värme. Dess yta är bara 131 mm2. Detta ger 55 W/(131/(102)) = 42 W cm-2. Som jämförelse kan nämnas att ett ångstrykjärn har en effekt på 5 W cm-2.
En lösning är värmeröret. Som namnet antyder överför det värme från områden med hög temperatur till områden med lägre temperatur där det finns mer utrymme för kylflänsar eller kylfläktar.
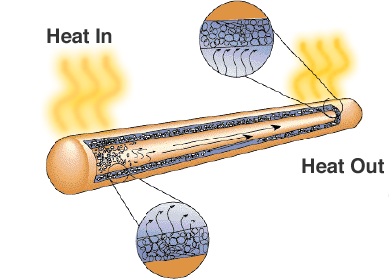
Trots att det bara ser ut som ett förseglat metallrör finns det en veke eller ett poröst material och en vätska med hög latent förångningsvärme. När röret värms upp använder vätskan värmen för att avdunsta och omvandlas till en gas, gasen rör sig till ett kallare område i värmeröret där den kondenserar och använder den latenta värmen för att åter omvandlas till en vätska. Värmerör är en tillförlitlig och kostnadseffektiv lösning för bärbara datorer där fläktar skulle minska batteritiden.