- Axiala kromatinfria hålrum uppträder i växter med en genomsnittlig 2C-DNA-halt över 0.8 pg per kromosom
- Kromosomkondensation/dekondensation kan visualiseras i halvtunna snitt av N. damascena-celler efter färgning med 4′,6-diamidino-2-fenylindol (DAPI)
- Kromosomkondensering/dekondensering under mitos analyserad efter inkorporering av 5-ethynyl-2′-deoxyuridin (EdU)
- Kromosomkondensation/dekondensation under mitos analyserad med elektronmikroskopi
Axiala kromatinfria hålrum uppträder i växter med en genomsnittlig 2C-DNA-halt över 0.8 pg per kromosom
Anafas- och telofaskromatider hos vissa växter innehåller kromatinfria håligheter i de axiella regionerna, vilket skiljer dessa växter från majoriteten av andra växter och djur som hittills undersökts (fig. 1a, b). Såvitt vi vet är rapporter som beskriver en sådan kromosomorganisation begränsade till växter med stora genomer, och man kan anta att en sådan morfologisk organisation är ett specifikt kännetecken för dessa växter. För att verifiera detta förslag analyserade vi också anafas- och telofas-kromatider från 12 arter med hjälp av elektronmikroskopi (Tabell 1; Fig. 1a, b; Additional file 1: Figure S1). Figur 1c visar att axiella kromatinfria håligheter tydligt sågs endast inuti kromosomerna hos växter med stora genomer och med stora kromosomer, men det verkade som om den genomsnittliga kromosomstorleken korrelerade bättre med närvaron eller frånvaron av dessa håligheter. Bland växter med axiella håligheter hade Hordeum vulgare det minsta genomet och det minsta genomsnittliga 2C-DNA-innehållet per kromosom (0,79 pg). Denna kromosomorganisation är således ett kännetecken för växtkromosomer vars 2C-DNA-innehåll kan grovt uppskattas överstiga 0,8 pg per kromosom.
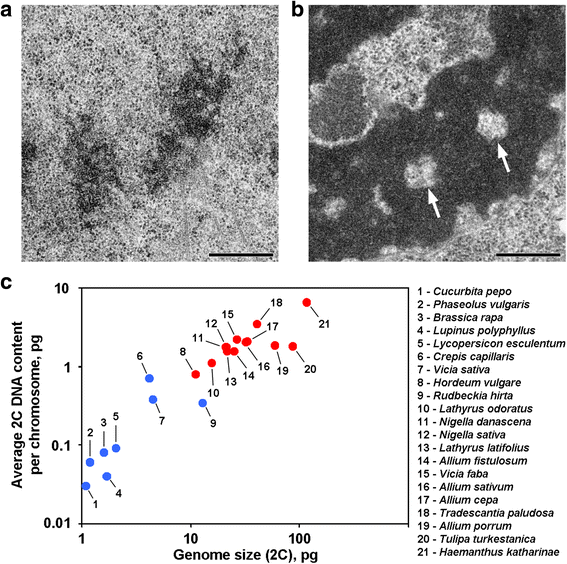
Två varianter av kromosomorganisation hos växter. a Telofas-kromosomer från vanlig böna (Phaseolus vulgaris) som exempel på kromosomer utan axiella kromatinfria håligheter. b Telofas-kromosomer från N. damascena med tydligt synliga axiella kromatinfria håligheter (pilar). c Närvaron av axiella kromatinfria håligheter beror på genomet och kromosomstorleken. Blå prickar representerar växter där kromosomerna inte innehåller axiella kromatinfria håligheter; röda prickar representerar växter där kromosomerna innehåller axiella kromatinfria håligheter. Skalstreck: Tabell 1 Kromatinfria hålrum i anafas/telofas-kromatider hos växter med olika genomstorlekar
Kromosomkondensation/dekondensation kan visualiseras i halvtunna snitt av N. damascena-celler efter färgning med 4′,6-diamidino-2-fenylindol (DAPI)
Det lämpligaste objektet för att studera växternas kromosomer, rot-apikala meristem, gör det inte möjligt att ta högupplösta bilder på grund av fluorescens som inte är fokuserad. Här använde vi en metod som bygger på applicering av halvtunna (200-250 nm) sektioner av rötter inbäddade i LR White-medium. Tjockleken på dessa sektioner var betydligt lägre än för optiska sektioner även om ett konfokalmikroskop användes. För att hitta de morfologiska egenskaper som gjorde att vi kunde identifiera celler i olika mitotiska stadier analyserade vi morfologin hos celler färgade med DAPI.
Det fanns flera omvandlingar av N. damascena kromosomorganisation som var lätt synliga även i fluorescensmikroskopet. Inne i de tidiga profaskärnorna syntes delar av tunna kromosomer (cirka 0,6 μm i diameter) (fig. 2a). Vid mitten av profasen bildades tjockare profas-kromosomer (cirka 1,2 μm), inuti vilka det var möjligt att urskilja förekomsten av tunnare fibrer, som troligen motsvarade veckade kromosomer från tidig profas (fig. 2b). Kromosomerna i sen profas (fig. 2c), metafas (fig. 2d) och anafas (fig. 2e) var tätt kondenserade, och ingen inre organisation kunde påvisas. Under dekondensationen i telofasen ledde separationen av kromatinfibrer med en diameter på cirka 0,4 μm till att kromatinfria hålrum uppstod i kromatidernas axiella regioner (fig. 2f), vars storlek gradvis ökade under telofasen (fig. 2g och h). Diametern på kromatinfibrerna i kromosomerna i telofasen var jämförbar med storleken på kromosomerna i den tidiga profasen. Således kunde alla mitotiska stadier hos N. damascena lätt upptäckas i halvtunna snitt färgade med DAPI.
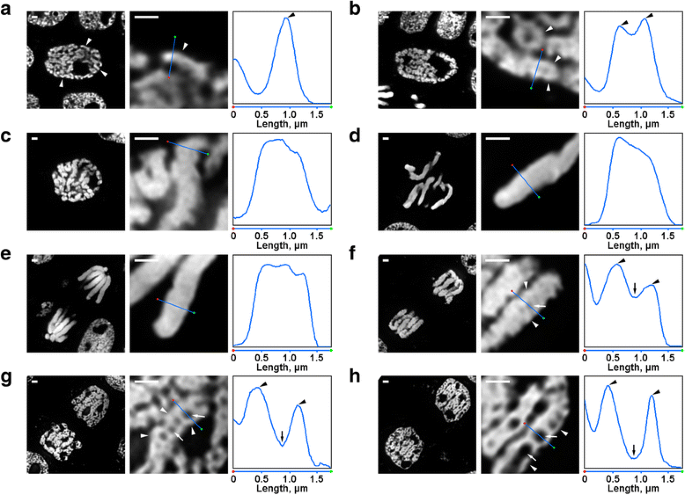
Morfologi hos de mitotiska kromosomerna hos N. damascena. Vänster och centrala paneler representerar fluorescensmikroskopiska bilder av DAPI-färgade halvtunna snitt (helhetsbild och fragment); den högra panelen representerar en densitetsplott genom linjen i de centrala panelerna. a Tidig profas (kromosomerna indikeras med pilspetsar). b Profas i mitten (fibrer som bildar kromosomer, som verkar motsvara kromosomer i tidig profas, anges med pilspetsar). c Sen profas. d Metafas. e Anafas. f Tidig telofas (axiella kromatinfria hålrum anges med pilar, fibrer som bildar kromosomer i telofas anges med pilspetsar). g Sen telofas. h G1-fas. Skala: 1 μm
Kromosomkondensering/dekondensering under mitos analyserad efter inkorporering av 5-ethynyl-2′-deoxyuridin (EdU)
Under profasen omvandlades tunna kromosomer från tidig profas till tjocka kromosomer från sen profas. Förtjockningen av profasens kromosomer kan vara ett resultat av antingen tidig profas kromosomveckning eller ett resultat av dess gradvisa förtjockning. För att undersöka dessa två möjliga mekanismer var det nödvändigt att markera de diskreta kromosomfoci som var linjärt ordnade inuti de tidiga profas-kromosomerna och sedan analysera deras rumsliga omarrangemang under profaskondensering. Enligt diagrammet i fig. 3a skulle sådana foci under övergången från tidig till sen profas antingen förlora det linjära arrangemanget (vikning) eller behålla det linjära arrangemanget och sträcka ut foci till tunna band (förtjockning). För att märka kromosomregionerna inkorporerade vi den syntetiska nukleoiden EdU, som kan detekteras genom klickkemi, i kromatin under replikationen.
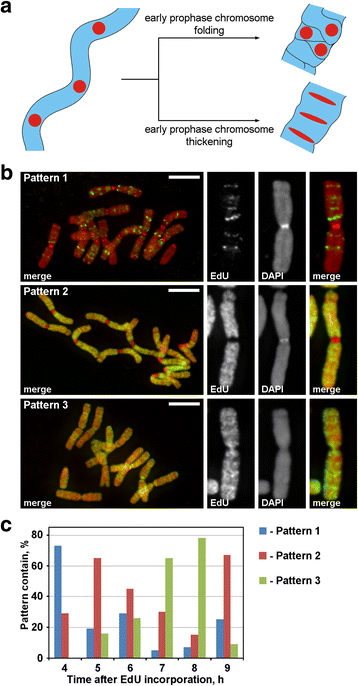
Kromosommärkning med EdU. a Märkta regioners lokalisering och morfologi avslöjade principen för kromosomkondensering i profas. Linjärt arrangerade, märkta kromosomregioner under övergången från tidig till sen profas skulle antingen förlora det linjära arrangemanget (vikning) eller behålla det linjära arrangemanget (förtjockning). b Tre mönster av EdU-inkorporering upptäcktes i kromosomerna: märkning av diskreta regioner (mönster 1), märkning av kromosomarmar men inte centromerer (mönster 2) och märkning av både kromosomarmar och centromerer (mönster 3). c Frekvenser av olika märkningsmönster vid olika tidpunkter efter EdU-inkorporering. Skala: EdU inkorporerades under 30 minuter i rötterna av N. damascena, och efter olika perioder (från 2 till 14 timmar) gjordes kromosomspridningar. Tre mönster av kromosommärkning upptäcktes: märkning av diskreta regioner (mönster 1), märkning av kromosomarmar men inte centromerer (mönster 2) och märkning av både kromosomarmar och centromerer (mönster 3) (fig. 3b). Mönster 1 observerades oftare 4 timmar efter EdU-inkorporering, vilket tyder på att sådan märkning var typisk för sen S-fas (Fig. 3c; Additional file 2: Figure S2). När det gäller mönster 1 var märkningen av de homologa kromosomerna likartad (Additional file 3: Figur S3), vilket tyder på ett specifikt mönster för EdU-inkorporering. Kromosomarmarna märktes under resten av S-fasen (mönster 2 och 3), men de centromeriska regionerna märktes också ungefär vid gränsen mellan tidig och sen S-fas (mönster 3) (figur 3c).
Vi analyserade övergångar från tidig till sen profas med hjälp av kromosomer där sent replikerande kromatin märktes (mönster 3). I kromosomer i tidig profas var de märkta regionerna linjärt fördelade längs tunna kromosomer (fig. 4a). I kromosomer i sen profas, som var ungefär dubbelt så tjocka jämfört med kromosomer i tidig profas, förlorade de märkta regionerna sin linjära fördelning (fig. 4b). Denna observation var inte helt giltig eftersom profas- och metafas-kromosomer består av två kromatider som gradvis segregerar , vilket kan leda till att de märkta regionernas fördelning förlorar sin linjäritet. Därför analyserade vi ytterligare anafasekromatider (dvs. helt komprimerade kromosomer efter kromatidsegregation). I anafas-kromatomer med en diameter som är ungefär lika stor som diametern hos de sena profas-kromosomerna var de märkta kromatinregionerna inte linjärt ordnade utan fördelade över kromatidernas volym (fig. 4c). Vid telofasen var de kromatinfria hålrummen tydligt synliga i kromatidernas axiella regioner, vilket gjorde det möjligt att upptäcka kromatinfibrerna inom vilka de märkta regionerna var linjärt ordnade (fig. 4d). Under övergången från tidig till sen profas skedde alltså en veckning av kromosomerna i tidig profas. Detta resultat stämmer överens med observationer av DAPI-färgade kromosomer i mitten av profasen (fig. 2b), inom vilka vikta tunna fibrer var tydligt synliga.
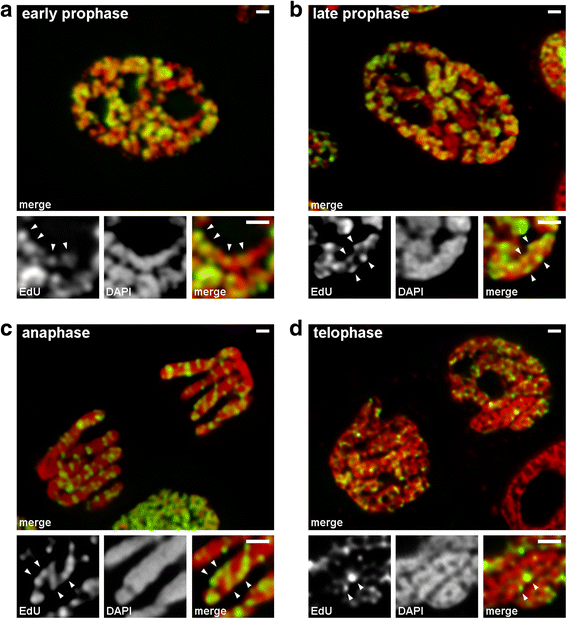
Kromosomkondensering/kondensering under mitos hos N. damascena (mitotiska celler vars kromosomer innehöll EdU under sen S-fas). a I tidig profas var märkta områden linjärt fördelade i tunna kromosomer som spände över kromosombredden nästan helt och hållet. b I sen profas var märkta områden utspridda i hela kromosomvolymen. c I anafas var märkningsmönstret likartat med det i kromosomer i sen profas. d I sen telofas avslöjade dekondensationen tunna fibrer som bildade kromatider inuti vilka märkta områden fördelades på liknande sätt som inuti kromosomer i tidig profas. Skalor: 1 μm
Kromosomkondensation/dekondensation under mitos analyserad med elektronmikroskopi
För att upptäcka den inre organisationen av kromatinfibrer, vars veckning beskrevs med hjälp av ljusmikroskopi, använde vi elektronmikroskopi. För att upptäcka och mäta kromatinfibrillära understrukturer analyserade vi kromatinfria hålrum, som separerade kromatinfibrerna som vi antog (Additional file 4: Figur S4; Tabell 2).
Interfaskärnor var fyllda med ett nät av tjocka 234 ± 49 nm (medelvärde ± S.D.) fibrer (Fig. 5a), som kan kallas ”interfas-kromonemata”, vilket diskuteras på annat håll . Elektronmikroskopi gjorde det möjligt att upptäcka tre stadier av profasens kromosomkondensering, varav det tidigaste inte var möjligt att upptäcka med ljusmikroskopi, och kommer här att kallas ”preprofas”. Det andra och det tredje stadiet motsvarade tidig och sen profas, enligt beskrivningen ovan (figur 2a respektive c).
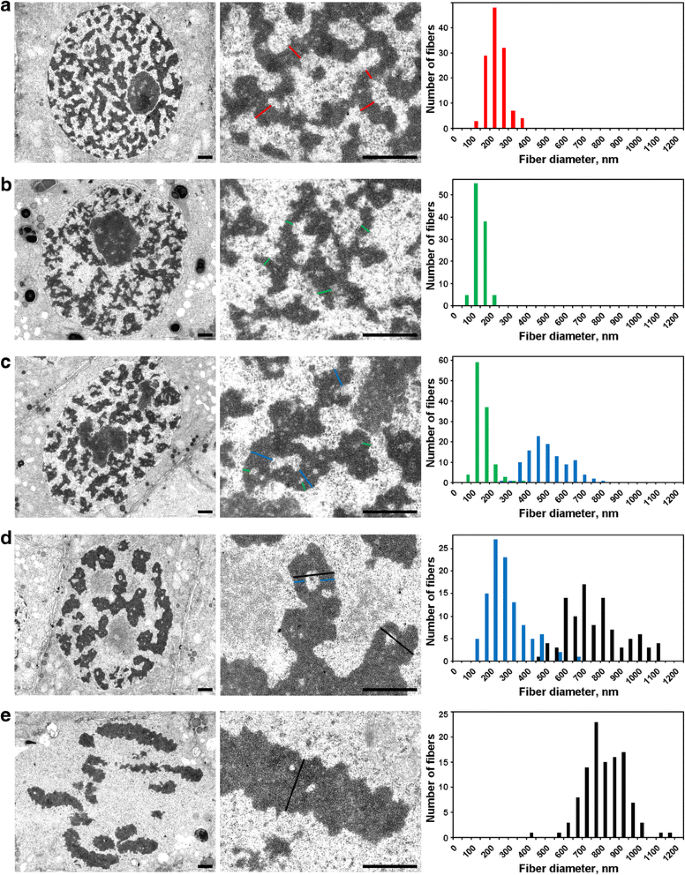
Elektronmikroskopimorfometri av N. damascena-kromosomer: kromosomkondensering från interfas till metafas. Vänster och centrala paneler visar ultrastrukturell organisation (allmän bild och fragment), högra paneler visar histogram som beskriver fördelningen av kromosom- och kromatinfiberbredd. a Interfas. b Preprofas. c Tidig profas. d Sen profas. e Metafas. De typiska tvärsnitten av kromosomerna och/eller kromatinfibrerna anges med färgade linjer: rött – kromonemata i interfasen (heterokromatin), grönt – kromonemata; blått – ”300 nm fibrer”; svart – kromosomer. Skalor: 1 μm
(1) I preprofasen var kromosomerna dåligt separerade från varandra och vi kunde inte exakt mäta deras diameter (fig. 5b). Preprofasens kromosomer bildades av fibrer med en diameter på 148 ± 30 nm (tabell 2), vilket sannolikt motsvarade fibrerna med en diameter på 100-130 nm (chromonema), som är den huvudsakliga kromosomunderstrukturen i profasens och telofasens kromosomer i djurceller . Uppgifterna gjorde det inte möjligt för oss att fastställa identiteten hos interfas- och mitotiska kromonemata, men tidigare rapporterade uppgifter tyder på att interfas-kromonemata är komplex som bildas av veckade kromonemata .
(2) Vid tidig profas inträffade separationen av kromosomerna (fig. 5c). Kromosomernas diameter var 527 ± 107 nm, och dessa kromosomer bildades också av kromonemata med en diameter på 158 ± 46 nm.
(3) Slutligen analyserade vi celler i sen profas, som innehöll förtjockade kromosomer med en diameter på 809 ± 185 nm (fig. 5d). Vissa sena profas-kromosomer innehöll håligheter i de axiella regionerna som gjorde att vi kunde urskilja fibrer med en diameter på 285 ± 102 nm (”300 nm fiber”). Analysen med hjälp av de märkta kromosomsegmenten visade att tidiga profas-kromosomer veckade sig för att bilda tjockare sena profas-kromosomer (fig. 4). Därför är det möjligt att anta att fibrerna på 285 ± 102 nm och kromosomerna på 527 ± 107 nm i tidig profas var samma fibrer. Den minskade diametern hos fibrerna kan vara förknippad med kromatinkompaktering av kromosomerna i tidig profas, vilket också indikerades av att synliga kromonemata försvann.
Kromatinet inuti metafasekromosomerna (fig. 5e) och anafasekromosomerna (fig. 6a) var starkt komprimerat, och även om sällsynta kromatinfria kaviteter inuti dem syntes, var det omöjligt att göra en noggrann distinktion av eventuella fibrillära understrukturer. I kromosomer i tidig telofas upptäcktes tydligt två typer av håligheter (fig. 6b). Stora håligheter fanns i kromatidernas axiella region, vilket gjorde att vi kunde identifiera och mäta fibrer med en diameter på 422 ± 78 nm. I de centrala regionerna av dessa fibrer upptäckte vi små håligheter som gjorde det möjligt att identifiera en andra typ av fiber med en diameter på 182 ± 47 nm. Den förstnämnda typen av fibrer kan motsvara ”300 nm fibrer” inuti kromosomer i sen profas, den andra typen kan motsvara kromonemata.

Elektronmikroskopisk morfometri av kromosomer från N. damascena: kromosomdekondensering från anafas till G1- fas. Vänster och central panel visar ultrastrukturell organisation (allmän bild och fragment), höger panel visar histogram som beskriver fördelningen av kromatid- och kromatinfiberbredd. a Anafas. b Tidig telofas. c Sen telofas. d G1-fas. De typiska tvärsnitten av kromosomerna och/eller kromatinfibrerna anges med färgade linjer: rött – interfas kromonemata, grönt – kromonemata; blått – ”300 nm fibrer”; svart – kromatider. Skala: 1 μm
I den sena telofasen (fig. 6c) och G1-fasen (fig. 6c) och G1-fasen (fig. 6d) har kromosomerna dekondenserats till kromosomdomäner i dotterkärnorna där de inte lätt kan observeras. Det var dock möjligt att identifiera separerade kromatidfragment. I detta skede bildades kromatiderna av fibrer med en diameter på cirka 250 nm, vilket ungefär motsvarar diametern hos kromosomerna i interfasen. Denna observation, förutom att kromonemafibrerna försvann, indikerade att kromatinfibrerna i detta mitosstadium veckades om för att bilda interfaskomplex av kondenserat kromatin.