Úvod
Velké neurokognitivní poruchy (NCD) nebo demence včetně Alzheimerovy nemoci (AD) jsou devastujícím problémem naší stárnoucí společnosti, který představuje obrovskou sociální, ekonomickou a zdravotní zátěž. Vzhledem k tomu, že v současné době nemáme k dispozici účinnou léčbu NCD, zaměřil se nedávný výzkum na detekci časných příznaků. Konvergující důkazy z mnoha nedávných studií odhalily, že patologický proces Alzheimerovy choroby začíná desítky let před prvními příznaky poklesu kognitivních funkcí (Mattsson et al., 2009). Velký zájem si získalo přechodné stadium mezi očekávaným poklesem kognitivních funkcí při fyziologickém stárnutí a závažným poklesem při demenci známé jako „mírná kognitivní porucha“ (MCI). „U MCI lze neuropsychologickými testy odhalit mírné zhoršení kognitivních schopností, zatímco globální kognitivní funkce a každodenní aktivity jsou zachovány“ (Petersen, 2004). Vyšší míra konverze do NCD u MCI udává klinický význam tohoto předchorobí. Konverze do NCD je u MCI 10-15 % ročně ve srovnání s 1-4 % ročně u průměrné starší populace (Petersen et al., 2001; Bischkopf et al., 2002). U většiny těchto pacientů se vyvine klinická AD. Je třeba poznamenat, že MCI může být také stabilní nebo reverzní stav nepřecházející v demenci. Longitudinální epidemiologické studie uvádějí variantní míru konverze a relativně častý návrat k normálnímu poznání (Larrieu et al., 2002; Ganguli et al., 2004). Různá zjištění naznačují nestabilitu diagnostické přesnosti a potřebu specifičtější identifikace mezi pacienty s MCI (Han et al., 2012). Vzhledem k výše uvedenému je pochopitelné, že se řada studií zaměřuje na příznaky a odlišnosti od průměrné populace, které úzce souvisejí s rozvojem demence, a lze je tedy využít jako pomoc při včasné diagnostice.
Pacienty s MCI lze dále rozdělit na amnestické (aMCI) a neamnestické MCI (naMCI). U aMCI převažuje ztráta paměti a je spojena s vysokým rizikem další konverze do AD (Grundman, 2004). Jedinci s naMCI mají poruchy v jiných oblastech než v paměti a mají vyšší riziko konverze do jiných forem demence, jako je například difuzní demence s Lewyho tělísky. Oba typy lze dále kategorizovat na jednodoménové a vícedoménové podtypy, avšak v tomto šetření nebyla další kategorizace provedena vzhledem k omezené velikosti vzorku. Byly testovány významné typy biomarkerů MCI s cílem identifikovat zvláštní rysy pacientů přecházejících do AD. Zatímco výsledky biomarkerů mozkomíšního moku (Hansson et al., 2006) a pozitronové emisní tomografie (Mosconi et al., 2004) poukázaly na vysoce variantní specificitu a senzitivitu, studie strukturální magnetické rezonance odhalily působivé výsledky (Jack et al., 1999; deToledo-Morrell et al., 2004). Je zajímavé, že několik předchozích studií zkoumalo rozdíly mezi subjekty s MCI a zdravými kontrolami, pouze několik studií se pokusilo rozlišit mezi podtypy MCI (Zhang et al., 2011; Serra et al., 2013).
Ačkoli aMCI a naMCI jsou teoreticky odlišné entity, pouze několik šetření zkoumalo strukturální rozdíly mozku mezi těmito podtypy MCI (Serra et al., 2013). Cílem této studie bylo zjistit strukturální rozdíly mezi aMCI a naMCI a zopakovat předchozí zjištění týkající se rozlišení mezi aMCI a zdravými kontrolami. Na základě předchozích studií o MCI a konverzi do demence jsme se zaměřili na struktury temporálního laloku a sousedních oblastí (Chiang et al., 2011): entorhinální kůra, hipokampus, parahipokampální kůra, amygdala, fusiformní gyrus, precuneus, zadní cingulární kůra a istmus cingulárního gyru.
Metody
Tato studie je pokračováním naší dříve publikované práce (Sirály et al., 2015). Vzhledem k tomu, že v této studii byla použita podobná baterie neuropsychologických testů a stejný postup získávání a zpracování MRI, byly metody a postupy v obou pracích popsány podobně.
Etické prohlášení
Experimenty byly provedeny v plném souladu s Helsinskou deklarací a všemi příslušnými národními a mezinárodními etickými pokyny. Výzkum byl schválen Národní etickou komisí, Budapešť, Maďarsko. Všechny postupy byly prováděny pouze po získání písemného informovaného souhlasu účastníků. Všichni potenciální účastníci, kteří účast odmítli nebo se jinak nezúčastnili, nebyli neúčastí ve studii nijak znevýhodněni.
Účastníci
Studie byla provedena na katedře psychiatrie a psychoterapie Semmelweisovy univerzity v Budapešti. Celkem bylo do studie zařazeno 62 subjektů. Všechny subjekty požádaly o účast v kognitivním tréninkovém programu vyhlášeném mezi praktickými lékaři a v Domově důchodců (Studie je registrována na ClinicalTrials.gov, identifikátor je „NCT02310620“). Všechny subjekty byly schopny vést samostatný život. Základní demografické a neuropsychologické údaje jsou shrnuty v tabulce 1.

Tabulka 1. Demografické údaje a výsledek základních neuropsychologických testů.
Subjekty s aMCI a naMCI a zdravé kontroly byly do studie zařazeny na základě Petersenových kritérií (Petersen, 2004). Petersenova kritéria zahrnují subjektivní stížnosti na paměť potvrzené informátorem spolu se zachovanými každodenními aktivitami, poruchu paměti na základě standardního neuropsychologického testu, zachované globální kognitivní funkce a konečně vyloučení demence. V něm není specifikován neuropsychologický test pro hodnocení poruch paměti, proto jsme použili Reyův test sluchového verbálního učení (RAVLT), který je na základě literatury nejčastěji používaným testem (Gomar et al., 2011). Pro rozlišení mezi aMCI a zdravými kontrolami jsme použili hraniční skóre 1 SD pod populačním průměrem standardizovaným podle věku a pohlaví. Účastníci, kteří dosáhli skóre pod hraniční hodnotou buď v dílčím skóre zpožděného vzpomínání, nebo v celkovém skóre, byli zařazeni do skupiny aMCI. Použitá kritéria vycházejí z doporučení pracovních skupin National Institute on Aging-Alzheimer’s Association pro diagnostické pokyny pro Alzheimerovu chorobu (Albert et al., 2011). Přesné hraniční skóre pro RAVLT pro různé věkové skupiny jsou uvedeny v tabulce 2A. Subjekty, které nebyly ve skupině aMCI, ale dosáhly 1 SD pod populačním průměrem standardizovaným podle věku a pohlaví/vzdělání buď v testu Trail making Test B, nebo v Addenbrooke’s Cognitive Examination (ACE), byly zařazeny do skupiny naMCI. Dalším kritériem pro skupinu naMCI byl nižší poměr VLOM (verbální plynulost + jazykové skóre/orientace + paměťové skóre) v ACE než 3,2, aby se ze skupiny naMCI vyloučily případné osoby s aMCI (tyto osoby byly ze studie vyloučeny).

Tabulka 2. (A). Reyův sluchový test verbálního učení (RAVLT): normativní údaje a hraniční skóre pro mírnou kognitivní poruchu (MCI) upravené podle věku; (B) Mini Mental Examination Test (MMSE): hraniční skóre pro demenci upravené podle věku a vzdělání.
Subjekty s demencí byly ze studie vyloučeny podle skóre Mini Mental State Examination (MMSE) standardizovaného podle věku a vzdělání (Strauss et al., 2006b). Přesné hraniční skóre pro MMSE v různých skupinách podle věku a vzdělání jsou uvedeny v tabulce 2B. Ze studie byly rovněž vyloučeny osoby s anamnézou úrazu hlavy, epilepsie nebo cévní mozkové příhody nebo s diagnózou akutní psychiatrické poruchy, schizofrenie nebo mánie, závislosti na alkoholu.
Pořízení a zpracování MR snímků
Všechny subjekty byly vyšetřeny pomocí magnetické rezonance mozku s vytvořením strukturálních snímků s vysokým rozlišením, které byly použity pro další zpracování a analýzu. Akvizice snímků byla provedena ve Výzkumném centru MR Semmelweisovy univerzity v Budapešti na klinickém skeneru MRI Philips Achieva 3 Tesla vybaveném osmikanálovou hlavovou cívkou SENSE. Anatomické snímky celého mozku s vysokým rozlišením byly získány pomocí sekvence T1 váženého trojrozměrného zkaženého gradientního echa (T1W 3D TFE). U každého subjektu bylo získáno 180 přilehlých řezů s následujícími parametry zobrazení:
Kortikální rekonstrukce a volumetrická segmentace byly provedeny pomocí sady pro analýzu obrazu Freesurfer 5.3, která je zdokumentována a volně dostupná ke stažení online (http://surfer.nmr.mgh.harvard.edu/). Technické podrobnosti těchto postupů jsou popsány v předchozích publikacích, v této pipeline jsme neprovedli žádné změny. Stručně řečeno, zpracování obrazu zahrnuje korekci pohybu (Reuter et al., 2010), odstranění nemozkové tkáně pomocí hybridního postupu watershed/deformace povrchu (Segonne et al., 2004), automatickou Talairachovu transformaci, segmentaci subkortikální bílé hmoty a objemových struktur hluboké šedé hmoty (včetně hipokampu, amygdaly, kaudátu, putamen, komor) (Fischl et al..), 2004) normalizace intenzity, tesselace hranice šedé hmoty s bílou hmotou, automatická korekce topologie a deformace povrchu podle gradientů intenzity s cílem optimálně umístit hranice šedá/bílá a šedá/cerebrospinální tekutina na místo, kde největší posun intenzity definuje přechod do druhé třídy tkání (Dale a kol., 1999; Fischl a Dale, 2000). Po dokončení kortikálních modelů provedl Freesurfer řadu deformovatelných postupů pro další zpracování a analýzu dat. Kroky zahrnovaly inflaci povrchu (Fischl a kol., 1999a), registraci do sférického atlasu, který využíval jednotlivé vzory korových záhybů k porovnání geometrie kůry u různých subjektů (Fischl a kol., 1999b), parcelaci mozkové kůry do jednotek na základě gyrální a sulkové struktury (Fischl a kol., 2004) a vytvoření řady údajů založených na povrchu včetně map zakřivení a hloubky sulku. Nakonec byly kortikální modely a výsledky segmentace u každého subjektu zkontrolovány z hlediska kvality a manuálně korigovány, korekce však neprokázala žádné významné změny výsledků.
Postupy
Neuropsychologická vyšetření byla prováděna ve všední dny mezi 8:00 a 16:00. Vyšetření se skládala z počítačových (tj. PAL test) a papírových neuropsychologických testů. Testy probíhaly v oddělené dobře osvětlené místnosti, kde byl přítomen pouze pacient a vyšetřující. Referenční testy byly rovněž vyplněny a vyhodnoceny podle doporučení Neuropsychologického kompendia (Strauss et al., 2006a), zatímco počítačové testy byly vyhodnoceny pomocí softwaru.
Neuropsychologické testy prováděli dva předem vyškolení studenti medicíny pod dohledem psychologa a psychiatra. Při vyhodnocování testů byly dodržovány pokyny Neuropsychologického kompendia (Strauss et al., 2006a). Papírové testy byly hodnoceny stejným psychologem a psychiatrem podle kompendia. Paired Associates Learning Test (PAL test) byly vyhodnoceny automaticky pomocí softwaru. Data z magnetické rezonance byla rovněž analyzována a vyhodnocena automaticky pomocí softwaru Freesurfer a SAS; při analýze neurozobrazovacích dat tedy nedocházelo k subjektivnímu posuzování. Vzhledem k tomu, že posouzení a vyhodnocení testu PAL a neurozobrazovacích dat bylo zcela automatické, zkreslení lidskými úsudky bylo nízké (omezené pouze na vyhodnocení testů na papíře).
Ze studie byly vyloučeny subjekty s demencí na základě Mini Mental State Examination (MMSE). MMSE je standardní test; jeho účinnost byla prokázána několika studiemi jako užitečná metoda při rozlišování mezi subjekty s demencí a zdravými kontrolami (Petersen et al., 1999; Gomar et al., 2011). Většina předchozích studií používala hraniční skóre 26 nebo skóre přizpůsobené věku pro demenci. Dílčí úlohy testu hodnotí orientaci, centrální exekutivní funkce, rychlou tvorbu asociací, schopnost slovní identifikace a schopnost analýzy a syntézy.
K hodnocení globální kognitivní výkonnosti, zahrnující orientaci, pozornost, paměť, verbální plynulost, verbální a vizuoprostorové dovednosti, byl použit Addenbrookův kognitivní test (Mathuranath et al., 2000; Alexopoulos et al., 2010).
Pro podrobné posouzení paměťových funkcí na základě Petersenových kritérií byl použit Reyův sluchový test verbálního učení. Reyův test hodnotí verbální učení a paměť (Rey, 1958). Seznam 15 slov (seznam A) měl subjekt zopakovat okamžitě. Tento test se opakuje pětkrát. Poté je jednou předložen další seznam 15 slov (seznam B nebo interferenční seznam), který by si měl testovaný vybavit. Poté by měl být seznam A vyvolán bez opakování a tento úkol se opakuje po 30 min.
Test Trail Making, část A a část B (spojení čísel; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) se používá k hodnocení selektivní pozornosti, exekutivních funkcí a kognitivní flexibility. V části A je třeba spojit náhodně rozmístěná čísla v číselném pořadí, zatímco v části B se zobrazují náhodně rozmístěná čísla a písmena. Subjekt je instruován, aby spojil čísla a písmena v předem definovaném pořadí. Závisle proměnnou je čas potřebný k dokončení testu. Část A TMT měří exekutivní funkce a pozornost, zatímco ve výkonu v části B se odráží také kognitivní flexibilita.
Výsledky neuropsychologických testů jsou shrnuty v tabulce 1.
Všichni účastníci vyplnili formulář, ve kterém hodnotili vlastní zdravotní stav a paměťové funkce; dále museli uvést údaje o používání počítače a internetu, volnočasových aktivitách, konzumaci alkoholu, stravovacích návycích a kouření (Yesavage, 1988). K hodnocení depresivních příznaků byla použita škála Geriatric Depression Scale (GDS), zatímco příznaky úzkosti byly měřeny pomocí dotazníku Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
Vizuoprostorová paměť byla měřena implementací testu PAL, který se používá v několika neuropsychologických testových bateriích (Siraly et al., 2013). „V testu PAL se na obrazovce po dobu 3 s otevírají okna v náhodných pozicích za sebou, přičemž v jednom nebo více oknech jsou zobrazeny abstraktní tvary. Ostatní okna zůstávají prázdná v závislosti na úrovni obtížnosti. Po zobrazení všech čtverců se uprostřed obrazovky objeví dříve zobrazené tvary a účastníci se musí rozhodnout, ve kterém okně daný tvar viděli dříve. Test se skládá z pěti různých úrovní v celkem osmi fázích, přičemž počet tvarů se v jednotlivých fázích zvyšuje od 1 do 8. Účastníci měli na dokončení dané etapy 10 pokusů, jinak test skončil. Uspořádání oken bylo v testu asymetrické a měnilo se od etapy k etapě.“ (Siraly et al., 2013) Během počítačového testu subjekty pohodlně seděly ve vzdálenosti půl metru od obrazovky počítače a po předchozích informacích řešily úkoly pomocí myši.
Statistická analýza
Rozdíly mezi studijními skupinami v objemu mozku, tloušťce kůry a kognitivním výkonu byly analyzovány pomocí analýzy obecného lineárního modelu (GLM v SAS 9.2) s věkem a pohlavím jako kovariátami. Objemy byly standardizovány na celkový intrakraniální objem (TIV) a jsou uvedeny v procentech. K analýze rozdílů mezi skupinami byla použita post hoc t srovnání, kde p-hodnoty byly upraveny na 0,05/3 = 0,016, kde tři znamená počet porovnání mezi skupinami.
Vztah mezi výsledky neuropsychologických testů a velikostí struktur CNS byl analyzován pomocí Pearsonových korelací. Korelace s počtem dokončených fází testu PAL byly analyzovány pomocí Spearmanovy korelace, protože rozložení této proměnné se značně odchylovalo od normálního rozložení.
Výsledky
Rozdíly v korových objemech, tloušťce kůry a kognitivním výkonu mezi subjekty s amci, namci a kontrolami
V objemu hipokampu a v objemu entorhinální kůry byl zjištěn významný rozdíl mezi studovanými skupinami . Post hoc testy ukázaly, že objemy jsou významně zmenšené ve skupině s aMCI vzhledem ke kontrolám a ke skupině s naMCI, zatímco ostatní dvě skupiny se významně nelišily (tabulka 3 a obrázek 1) Mezi kovariátami mělo významný vliv na objem hipokampu pohlaví, muži měli významně zmenšenou velikost hipokampu vzhledem k ženám .
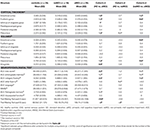
Tabulka 3 . Rozdíly struktur CNS a výsledků neuropsychologických testů mezi studijními skupinami.
Obrázek 1: Rozdíly mezi studijními skupinami. Rozdíly mezi skupinami ve strukturách CNS a neuropsychologických testech. Svislé sloupce představují průměry skupin, zatímco chybové sloupce představují směrodatné odchylky. Vodorovné čáry nad svislými sloupci označují významné rozdíly mezi skupinami po korekci na vícenásobné srovnání (p < 0,016). HC, zdravé kontroly; aMCI, amnestická mírná kognitivní porucha; naMCI, neamnestická mírná kognitivní porucha; CNS, centrální nervový systém.
Průměrná tloušťka entorhinální kůry , fusiformního gyru , istmu cingulovaného gyru a precuneu se ve studovaných skupinách rovněž významně liší. Podle post-hoc testů byly zjištěny snížené tloušťky kůry u aMCI oproti kontrolám ve všech čtyřech strukturách, přičemž tloušťka entorhinální kůry a fusiformního gyru byla rovněž významně snížena u skupiny aMCI oproti skupině naMCI. Průměry skupin, výsledky post-hoc testů a rozdíly mezi skupinami ve smyslu Cohenova d jsou shrnuty v tabulce 3.
Ve studijních skupinách byl významný rozdíl v anterográdní paměti , retrográdní paměti , kategoriální fluenci . V anterográdní paměti a kategoriální plynulosti překonala kontrolní skupina i skupina naMCI skupinu aMCI, zatímco první skupiny se významně nelišily (tab. 3). V retrográdní paměti kontrolní skupina překonala skupinu aMCI, nikoli však skupinu naMCI. V plynulosti psaní písmen kontroly předčily skupinu naMCI, ale ne skupinu aMCI, zatímco obě skupiny MCI se od sebe nelišily (p > 0,05). Navíc v kategoriální plynulosti si ženy vedly lépe než muži , zatímco věk neměl na výkon žádný významný vliv.
Korelační analýzy
V celém vzorku byly zjištěny silné korelace mezi výsledky neuropsychologických testů a objemem a tloušťkou spánkových mozkových struktur (tabulka 4).

Tabulka 4. Výsledky neuropsychologických testů. Korelace mezi strukturami CNS a výsledky neuropsychologických testů v celém vzorku.
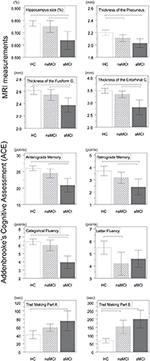
Ve skupině aMCI vykazoval výsledek Reyova testu verbálního učení významnou pozitivní korelaci s velikostí amygdaly (r = 0,47, n = 20, p = 0,03) a tloušťkou entorhinální kůry (r = 0,46, n = 20, p = 0,04; obrázek 2). Osoby se sníženým objemem amygdaly a sníženou tloušťkou entorhinální kůry vykazovaly horší výsledky v paměťovém testu.

Obrázek 2. Korelace mezi výkonem v krátkodobé paměti indexovaným Reyovým testem verbálního učení a objemem amygdaly a tloušťkou entorhinální kůry u sledovaných skupin. Pearsonovy korelace byly signifikantní (p < 0,05) u amnestické skupiny MCI a u celého vzorku, zatímco u kontrolní skupiny a skupiny bez amnestie MCI byly nesignifikantní. Celkové skóre Reyova verbálního testu na svislých osách se rovná součtu slov v prvních pěti pokusech. červená čára, regresní přímka ve skupině aMCI; čárkovaná čára, regresní přímka v celém vzorku; MCI, mírná kognitivní porucha; r a p, Pearsonův korelační koeficient upravený podle věku a odpovídající hladiny významnosti ve skupině aMCI.
Dále subjekty se sníženým entorhinálním objemem (r = 0,49, n = 19, p = 0,03) a sníženým objemem fusiformního gyru (r = 0,48, n = 19, p = 0,04) a tloušťkou fusiformní kůry (r = 0,04).53, n = 19, p = 0,02) podávaly slabší výkon v subtestu retrográdní paměti ACE.
Diskuse
Amnestická a neamnestická MCI byly přiřazeny jako potenciální prodromy k různým typům NCD. Předpokládá se, že osoby s amnestickou mírnou kognitivní poruchou mají vyšší riziko konverze do Alzheimerovy demence, zatímco osoby s neamnestickou mírnou kognitivní poruchou mají údajně vyšší riziko konverze do nealzheimerovské demence (Petersen et al., 1999; Killiany et al., 2000; Petersen a Negash, 2008).
Strukturální rozdíly mozku byly zkoumány pomocí MRI u podskupin s MCI a zdravé kontrolní skupiny, zatímco rozdíly v kognitivním výkonu byly zkoumány pomocí neuropsychologických testů. Podle výsledků MRI byla tloušťka entorhinální kůry, fusiformního gyru, istmu cingulárního gyru a precuneu a objem amygdaly a hipokampu u aMCI oproti zdravým kontrolám snížena. Tato zjištění jsou v souladu s předchozími studiemi, které uváděly, že zdravé osoby, pacienty s MCI nebo Alzheimerovou chorobou lze od sebe odlišit na základě objemů struktur spánkového laloku, jako je amygdala nebo hipokampus (Desikan et al., 2009; McEvoy et al., 2009).
Objem hipokampu a entorhinální kůry a tloušťka entorhinální kůry a fusiformního gyru jsou u skupiny aMCI oproti skupině naMCI významně snížené. Největší rozdíl mezi skupinami byl zjištěn v objemu a tloušťce entorhinální kůry (0,9 a 1,2 SD), což je v souladu s tím, že atrofie u AD začíná v této oblasti. Tyto výsledky ukazují, že mezi podtypy MCI existují časné strukturální rozdíly. Navíc vzorec těchto strukturálních nálezů odpovídá patologii Alzheimerovy choroby (Braak a Braak, 1991), což podtrhuje ty předchozí výsledky, podle nichž aMCI přechází v Alzheimerovu chorobu s vyšší frekvencí ve srovnání s naMCI (Killiany et al., 2000; Petersen a Negash, 2008).
Při porovnání kontrolní skupiny a skupiny naMCI byl zjištěn významný rozdíl pouze v tloušťce precuneus, která byla snížena ve skupině naMCI. Zajímavé je, že nedávná studie zjistila u pacientů s naMCI léze bílé hmoty také v precuneu (O’Dwyer et al., 2011), který je důležitým uzlem udržujícím přenos informací mezi parahipokampálním gyrem a prefrontální kůrou (Vincent et al., 2006) a hraje důležitou roli v paměťovém procesu a vizuálních představách.
Mezi neuropsychologickými testy se MMSE v jednotlivých studijních skupinách nelišil, což je pravděpodobně důsledek vyloučení pacientů s demencí. V subtestech ACE celkový, ACE anterográdní paměť a ACE plynulost kategorií dosáhla skupina aMCI horších výsledků ve srovnání se skupinou naMCI a kontrolní skupinou zdravých. V testu retrográdní paměti ACE a v testech Trail Making A a B měla skupina aMCI pouze horší výsledky než zdravé kontrolní skupiny, zatímco mezi oběma podskupinami s MCI nebyl zjištěn žádný rozdíl. Snížený výkon v paměťových úlohách (RAVLT a úloha retrográdní paměti ACE) u skupiny aMCI koreloval se zvýšeným zapojením struktur temporálního laloku, jako je entorhinální kůra, a amygdala (obr. 2), což dále potvrzuje naše výsledky o rozdílech mezi skupinami.
V úloze plynulosti písmen skupina naMCI podala horší výkon než skupina zdravých, zatímco aMCI se od ostatních skupin nelišila. Test Trail making B je ukazatelem zrakové pozornosti a přepínání úkolů. Snížený výkon obou skupin MCI ve srovnání s kontrolami (tabulka 3) je pravděpodobně důsledkem postižení frontální oblasti. Úlohy zaměřené na kategorie i plynulost písmen jsou silně závislé na fungování frontálního laloku, včetně exekutivních procesů, které vyžadují, aby subjekty organizovaly vyhledávání, monitorovaly dříve zapamatované odpovědi, iniciovaly slovní odpovědi a inhibovaly odpovědi, které se nehodí do kritérií (Henry et al., 2004). „Obě měření také přistupují k sémantickým paměťovým zásobám, což je funkce temporálního laloku; ačkoli se zdá, že plynulost písmen využívá tuto schopnost spojenou s temporálním lalokem v menší míře než plynulost kategorií“ (Lezak et al., 2004). Studie lézí a funkčního zobrazování mozku rovněž podporují zapojení spánkového a čelního laloku do schopnosti plynulosti. Předchozí studie fMRI ukázaly, že plynulost psaní písmen je spojena se zvýšenou aktivací v čelních lalocích, zatímco čelní i spánkové laloky jsou aktivní při plynulosti kategorií (Birn et al., 2010). To dobře koresponduje s našimi zjištěními, že aMCI se významně liší podle plynulosti kategorií ve srovnání se zdravou skupinou a skupinou naMCI, zatímco ve výsledku plynulosti písmen není mezi oběma podskupinami významný rozdíl.
Silné korelace byly zjištěny mezi funkcemi verbální a vizuální paměti indexovanými pomocí testů RAVLT a PAL a objemy a tloušťkou kortikálních struktur v temporální oblasti, jako je entorrální kůra (tabulka 4) v celém vzorku a také ve skupině aMCI (obrázek 2). Tato zjištění křížově potvrzují užitečnost těchto neuropsychologických a MRI markerů při včasné diagnostice patologického poklesu kognitivních funkcí a při sledování progrese onemocnění.
Omezení
Omezením studie je, že většina subjektů ve skupině aMCI byla vícedoménového typu, protože jejich výkon v exekutivních funkcích hodnocený testem tvorby stop B a ACE byl pod normou. Toto omezení spolu se skutečností, že naMCI je heterogennější entita ve srovnání s aMCI, může vysvětlovat, proč se v současné studii nepodařilo najít struktury CNS se sníženou velikostí ve skupině naMCI ve srovnání se skupinou aMCI.
Závěry
Pojmenování aMCI a naMCI není pouze teoretické, ale tyto podtypy jsou odlišné entity jak z neuropsychologického, tak ze strukturálního hlediska mozku. Vypracování specifických MRI a neuropsychologických kritérií pro různé podtypy mírné kognitivní poruchy pak umožní posoudit determinanty a prevalenci podtypů MCI.
Přiřazení podtypů MCI bude užitečné pro zlepšení predikce typu demence a rizika konverze do demence. Kromě toho může přiřazení podtypů MCI poskytnout lepší přístup k testování účinnosti terapeutických možností při prevenci konverze do neurokognitivních poruch. Na základě našich výsledků může být MRI užitečným nástrojem k přesnějšímu rozdělení podtypů MCI.
Příspěvky autorů
GC navrhl studii, napsal protokol, ujal se statistické analýzy, vytvořil obrázky a napsal první návrh rukopisu ES se podílel na provedení měření, řídil vyhledávání literatury a analýzy a napsal první návrh úvodu a závěru. ÁS se podílel na finalizaci všech částí rukopisu. ZF, AH se podíleli na provádění měření a přispěli k napsání části o metodách. ÉC, PS, ZH, GR prováděli dohled nad experimenty v průběhu studie včetně psaní rukopisu. Všichni autoři se podíleli na konečném znění rukopisu a schválili jej.
Financování
Studie byla podpořena grantem „Ambient Assisted Living Joint Programme (AAL)-Call 2“ (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). Diagnostika mírné kognitivní poruchy způsobené Alzheimerovou chorobou: doporučení pracovních skupin National Institute on Aging-Alzheimer’s Association on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validace německého revidovaného Addenbrookova kognitivního vyšetření pro detekci mírné kognitivní poruchy, mírné demence u alzheimerovy choroby a frontotemporální lobární degenerace. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neuronální systémy podporující lexikální vyhledávání řízené náznaky písmen a sémantických kategorií: fMRI studie slovní plynulosti se samočinnou zjevnou odpovědí. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Mírná kognitivní porucha – přehled prevalence, incidence a výsledků podle současných přístupů. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Neuropatologické stadium změn souvisejících s Alzheimerovou chorobou. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identifikace kognitivně zdravých starších osob s následným zhoršením paměti pomocí automatizovaných temporoparietálních objemů MR. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Kortikální povrchová analýza. I. Segmentace a rekonstrukce povrchu. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W. a další (2009). Automatizovaná měření MRI identifikují osoby s mírnou kognitivní poruchou a Alzheimerovou chorobou. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Měření tloušťky lidské mozkové kůry ze snímků magnetické rezonance. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Segmentace snímků magnetické rezonance nezávislá na sekvenci. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Kortikální povrchová analýza. II: Inflace, zploštění a souřadnicový systém založený na povrchu. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). Intersubjektové průměrování s vysokým rozlišením a souřadnicový systém pro kortikální povrch. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C. a DeKosky, S. T. (2004). Mírná kognitivní porucha, amnestický typ: epidemiologická studie. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). Využitelnost kombinací biomarkerů, kognitivních markerů a rizikových faktorů k předpovědi přechodu z mírné kognitivní poruchy na Alzheimerovu chorobu u pacientů v rámci iniciativy neurozobrazování Alzheimerovy choroby. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld cognitive impairment can be distinguished from alzheimer disease and normal aging for clinical trials (Starší kognitivní poruchy lze pro účely klinických studií odlišit od alzheimerovy choroby a normálního stárnutí). Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Prediktivní platnost a diagnostická stabilita podtypů mírné kognitivní poruchy. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Asociace mezi CSF biomarkery a počínající Alzheimerovou chorobou u pacientů s mírnou kognitivní poruchou: následná studie. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). Verbal fluency performance in dementia of the Alzheimer’s type: a meta-analysis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Predikce AD pomocí objemu hipokampu na základě MRI u mírné kognitivní poruchy. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Využití strukturální magnetické rezonance k předpovědi, kdo onemocní Alzheimerovou chorobou. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidence a výsledky mírné kognitivní poruchy v populační prospektivní kohortě. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). Krátká baterie kognitivních testů k rozlišení Alzheimerovy choroby a frontotemporální demence. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkery a počínající Alzheimerova choroba u pacientů s mírnou kognitivní poruchou. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr, Holland, D., et al. (2009). Alzheimerova choroba: kvantitativní strukturální neurozobrazení pro detekci a predikci klinických a strukturálních změn u mírné kognitivní poruchy. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversion to dementia and the APOE genotype: a prediction study with FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Vícenásobné indexy difuze identifikují poškození bílé hmoty u mírné kognitivní poruchy a Alzheimerovy choroby. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Mírná kognitivní porucha jako diagnostická jednotka. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Mírná kognitivní porucha: přehled. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Mírná kognitivní porucha: klinická charakteristika a výsledky. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., and DeKosky, S. T. (2001). Praktický parametr: včasná detekce demence: mírná kognitivní porucha (přehled založený na důkazech). Zpráva podvýboru pro standardy kvality Americké akademie neurologie. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). The relation of the trail making test to organic brain damage [Vztah testu vytváření stop k organickému poškození mozku]. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Vysoce přesná inverzní konzistentní registrace: robustní přístup. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A hybrid approach to the skull stripping problem in MRI (Hybridní přístup k problému proužkování lebky v magnetické rezonanci). Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Mírná kognitivní porucha: stejná identita pro různé entity. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Sledování časných příznaků poklesu kognitivních funkcí u starších osob pomocí počítačových her: studie MRI. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovács, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). Manuál k dotazníku State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). „Mini Mental State Examination (MMSE),“ in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A a B: normativní data stratifikovaná podle věku a vzdělání. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Koherentní spontánní aktivita identifikuje hipokampálně-parietální paměťovou síť. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatrická škála deprese. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Atrofie šedé hmoty bazálního předního mozku a hipokampu u mírné kognitivní poruchy. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar
.