- Introduction
- Módszerek
- Etikai nyilatkozat
- A résztvevők
- MR-képek felvétele és feldolgozása
- Eljárások
- Statisztikai elemzés
- Eredmények
- A kérgi térfogatok, a kérgi vastagság és a kognitív teljesítmény különbségei az amci, namci és kontrollszemélyek között
- Korrelációs elemzések
- Diszkusszió
- Korlátozások
- Következtetések
- A szerzők hozzájárulása
- Finanszírozás
- Érdekütközéssel kapcsolatos nyilatkozat
Introduction
Major neurokognitív zavarok (NCD) vagy demencia, beleértve az Alzheimer-kórt (AD), az öregedő társadalom pusztító problémája, amely óriási társadalmi, gazdasági és orvosi terhet jelent. Mivel jelenleg nem áll rendelkezésünkre hatékony kezelés az NCD kezelésére, a legújabb kutatások a korai tünetek felismerésére összpontosítottak. Számos közelmúltbeli tanulmányból származó, egybehangzó bizonyítékok mutatták ki, hogy az Alzheimer-kór kóros folyamata évtizedekkel a kognitív hanyatlás első tünetei előtt kezdődik (Mattsson és mtsai., 2009). A fiziológiás öregedés során várható kognitív hanyatlás és a demencia súlyos hanyatlása közötti köztes szakasz, az úgynevezett “enyhe kognitív károsodás” (MCI) nagy érdeklődésre tart számot. “Az MCI-ben a kognitív képességek enyhe károsodása neuropszichológiai tesztekkel kimutatható, miközben a globális kognitív funkciók és a mindennapi tevékenységek megmaradnak” (Petersen, 2004). Az MCI-ben az NCD-vé válás magasabb aránya adja ennek a betegséget megelőző állapotnak a klinikai jelentőségét. Az MCI-ben az NCD-be való átváltás aránya évente 10-15%, szemben az átlagos idős népesség 1-4%-os éves arányával (Petersen és mtsai., 2001; Bischkopf és mtsai., 2002). E betegek többségénél klinikai Alzheimer-kór alakul ki. Meg kell jegyezni, hogy az MCI lehet stabil vagy fordított állapot is, amely nem fejlődik demenciává. Longitudinális epidemiológiai vizsgálatok változatos átváltási arányról és a normális kognícióhoz való viszonylag gyakori visszafordulásról számoltak be (Larrieu és mtsi., 2002; Ganguli és mtsi., 2004). A különböző eredmények a diagnosztikai pontosság instabilitására és az MCI-betegek közötti specifikusabb azonosítás szükségességére utalnak (Han és mtsai., 2012). A fentiek fényében érthető, hogy számos vizsgálat azokat a tüneteket és az átlagpopulációtól való eltéréseket célozza meg, amelyek szorosan összefüggnek a demencia kialakulásával, és így segíthetik a korai diagnózist.
Az MCI-betegek tovább kategorizálhatók amnesztikus (aMCI) és nem amnesztikus MCI-re (naMCI). Az aMCI-ben a memóriavesztés dominál, és magas kockázattal jár a további AD-vé való átalakulás szempontjából (Grundman, 2004). A naMCI-ben szenvedő egyének a memórián kívül más területeken is károsodnak, és nagyobb a kockázata annak, hogy más demenciaformákba, például diffúz Lewy-testes demenciába alakulnak át. Mindkét típus tovább kategorizálható egytartományú és többtartományú altípusokra, azonban jelen vizsgálatban a korlátozott mintanagyság miatt további kategorizálásra nem került sor. Az MCI biomarkereinek jelentős típusait vizsgálták azzal a céllal, hogy azonosítsák az Alzheimer-kórba átváltozó betegek sajátos jellemzőit. Míg az agy-gerincvelői folyadék biomarkerek (Hansson és mtsai., 2006) és a pozitronemissziós tomográfiás vizsgálatok (Mosconi és mtsai., 2004) eredményei nagymértékben eltérő specificitásra és érzékenységre mutattak rá, a strukturális mágneses rezonancia képalkotó vizsgálatok lenyűgöző eredményeket mutattak (Jack és mtsai., 1999; deToledo-Morrell és mtsai., 2004). Érdekes módon számos korábbi tanulmány vizsgálta az MCI-ben szenvedő és az egészséges kontrollszemélyek közötti különbségeket, csak néhány tanulmány próbált különbséget tenni az MCI altípusai között (Zhang et al., 2011; Serra et al., 2013).
Míg az aMCI és a naMCI elméletileg különböző entitások, csak néhány vizsgálat vizsgálta az MCI ezen altípusai közötti strukturális agyi különbségeket (Serra et al., 2013). A vizsgálat célja az aMCI és a naMCI közötti strukturális különbségek feltárása, valamint az aMCI és az egészséges kontrollok közötti különbségtételre vonatkozó korábbi eredmények megismétlése volt. Az MCI-vel és a demenciává való átalakulással kapcsolatos korábbi tanulmányok alapján a halántéklebeny és a szomszédos régiók struktúráira összpontosítottunk (Chiang et al., 2011): az entorhinális kéreg, a hippokampusz, a parahippokampális kéreg, az amygdala, a fusiformis gyrus, a precuneus, a hátsó cinguláris kéreg és a cinguláris gyrus isthmusa.
Módszerek
Ez a vizsgálat a korábban publikált munkánk folytatása (Sirály et al., 2015). Mivel a jelen vizsgálatban hasonló neuropszichológiai tesztbattériát, valamint ugyanazt az MRI-felvételi és feldolgozási csővezetéket használtuk, a módszerek és eljárások leírása mindkét közleményben hasonlóan történt.
Etikai nyilatkozat
A kísérleteket a Helsinki Nyilatkozat és az összes vonatkozó nemzeti és nemzetközi etikai irányelv teljes betartásával végeztük. A kutatást a budapesti Nemzeti Etikai Bizottság hagyta jóvá. Minden eljárást csak a résztvevők írásbeli, tájékozott beleegyezését követően végeztünk el. Minden potenciális résztvevő, aki elutasította a részvételt, vagy más módon nem vett részt a vizsgálatban, semmilyen hátrányt nem szenvedett amiatt, hogy nem vett részt a vizsgálatban.
A résztvevők
A vizsgálatot a Semmelweis Egyetem Pszichiátriai és Pszichoterápiás Tanszékén, Budapesten végeztük. Összesen 62 alany vett részt a vizsgálatban. Valamennyi alany jelentkezett egy kognitív tréningprogramban való részvételre, amelyet háziorvosok körében és egy idősek otthonában hirdettek meg (A vizsgálatot a ClinicalTrials.gov-on regisztrálták, azonosítója “NCT02310620”). Minden alany képes volt önálló életet élni. A demográfiai és neuropszichológiai alapadatokat az 1. táblázat foglalja össze.

Táblázat1. Demográfiai adatok és az alapvető neuropszichológiai tesztek eredménye.
A vizsgálatba az aMCI-ben és naMCI-ben szenvedő alanyokat és az egészséges kontrollokat a Petersen-kritériumok alapján vontuk be (Petersen, 2004). A Petersen-kritériumok közé tartozik az informátor által megerősített szubjektív emlékezeti panasz a mindennapi tevékenységek megőrzésével együtt, a memóriazavar egy standard neuropszichológiai teszt alapján, a megőrzött globális kognitív funkciók, és végül a demencia kizárása. Nem határoz meg neuropszichológiai tesztet a memóriazavarok felmérésére, ezért a Rey Auditory Verbal Learning Testet (RAVLT) alkalmaztuk, amely a szakirodalom alapján a leggyakrabban használt teszt (Gomar et al., 2011). Az aMCI és az egészséges kontrollok közötti különbségtételhez az életkorra és nemre standardizált populációs átlag alatt 1 SD-vel alacsonyabb határértéket alkalmaztunk. Azok a résztvevők, akik akár a késleltetett emlékezés részpontszámában, akár a teljes pontszámban a határérték alatt teljesítettek, az aMCI csoportba kerültek. Az alkalmazott kritériumok az Alzheimer-kór diagnosztikai irányelveivel foglalkozó National Institute on Aging-Alzheimer’s Association munkacsoport ajánlásain alapulnak (Albert et al., 2011). A RAVLT pontos határértékeit a különböző korcsoportokra vonatkozóan a 2A. táblázat tartalmazza. Azokat az alanyokat, akik nem tartoztak az aMCI csoportba, de 1 SD-vel az életkorra és nemre/képzettségre standardizált populációs átlag alatt teljesítettek a Trail making Test B vagy az Addenbrooke’s Cognitive Examination (ACE) tesztben, a naMCI csoportba sorolták. A naMCI csoportra vonatkozó további kritérium volt a 3,2-nél alacsonyabb VLOM (verbális folyékonyság + nyelvi pontszám/orientáció + memória pontszám) arány az ACE-ben, hogy kizárják az esetleges aMCI alanyokat a naMCI csoportból (ezeket az alanyokat kizárták a vizsgálatból).

A 2. táblázat. (A). Rey Auditory Verbal Learning Test (RAVLT): normatív adatok és az enyhe kognitív károsodásra (MCI) vonatkozó, életkorhoz igazított határértékek; (B) Mini Mental Examination Test (MMSE): demenciára vonatkozó, életkorhoz és iskolázottsághoz igazított határértékek.
A demenciában szenvedő alanyokat a korhoz és iskolázottsághoz igazított Mini Mental State Examination (MMSE) értékek szerint zártuk ki a vizsgálatból (Strauss et al., 2006b). Az MMSE pontos határértékeit a különböző életkori és iskolai végzettségi csoportokban a 2B. táblázat tartalmazza. A vizsgálatból kizárták azokat az alanyokat is, akiknek a kórtörténetében fejsérülés, epilepszia vagy stroke, illetve akut pszichiátriai zavar, skizofrénia vagy mánia, alkoholfüggőség diagnózisa szerepelt.
MR-képek felvétele és feldolgozása
Minden vizsgálati személyt agyi MRI-vel vizsgáltak, amely nagy felbontású strukturális képeket készített, amelyeket további feldolgozásra és elemzésre használtak. A képfelvételeket a budapesti Semmelweis Egyetem MR Kutatóközpontjában végeztük egy nyolccsatornás SENSE fejtekerccsel felszerelt 3 Tesla Philips Achieva klinikai MRI szkenneren. A nagy felbontású, teljes agyi anatómiai képeket T1 súlyozott 3 dimenziós spoiled gradiens echo (T1W 3D TFE) szekvenciával nyertük. Minden alanyról 180 összefüggő szeletet szereztünk be a következő képalkotási paraméterekkel: TR = 9,7 ms; TE = 4,6 ms; flipszög = 8°; FOV 240 × 240 mm; voxelméret 1,0 × 1,0 × 1,0 mm.
A kérgi rekonstrukciót és a térfogati szegmentálást a Freesurfer 5.3 képelemző csomaggal végeztük, amely dokumentált és szabadon letölthető online (http://surfer.nmr.mgh.harvard.edu/). Ezen eljárások technikai részleteit korábbi publikációkban ismertetjük, ezen a csővezetéken nem végeztünk változtatásokat. Röviden, a képfeldolgozás magában foglalja a mozgáskorrekciót (Reuter et al., 2010), a nem agyi szövetek eltávolítását hibrid vízválasztó/felületdeformációs eljárással (Segonne et al., 2004), automatikus Talairach-transzformációt, a szubkortikális fehérállomány és a mély szürkeállomány térfogati struktúráinak (beleértve a hippokampuszt, amygdala, caudatum, putamen, kamrák) szegmentálását (Fischl et al., 2004) intenzitás normalizálás, a szürkeállomány-fehérállomány határának tesszellálása, automatikus topológiakorrekció és intenzitásgradienseket követő felületi deformáció, hogy a szürke/fehér és szürke/gerincvelői folyadék határokat optimálisan arra a helyre helyezzék, ahol a legnagyobb intenzitáseltolódás határozza meg az átmenetet a másik szövetosztályba (Dale et al., 1999; Fischl és Dale, 2000). Miután a kérgi modellek elkészültek, a Freesurfer számos deformálható eljárást hajtott végre a további adatfeldolgozáshoz és elemzéshez. A lépések közé tartozott a felszín felfújása (Fischl et al., 1999a), a gömbi atlaszra történő regisztrálás, amely az egyes agykérgi hajtásmintákat használta az agykérgi geometria alanyok közötti egyezéséhez (Fischl et al., 1999b), az agykéreg gyralis és szulcális szerkezeten alapuló egységekre történő parcellázása (Fischl et al., 2004), és különböző felszíni alapú adatok létrehozása, beleértve a görbület és a szulcális mélység térképeit. Végül az agykérgi modelleket és a szegmentálás eredményeit minden egyes alanyon minőségi ellenőrzésnek vetették alá és manuálisan korrigálták, a korrekció azonban nem mutatott jelentős változásokat az eredményekben.
Eljárások
A neuropszichológiai vizsgálatokat hétköznapokon 8 és 16 óra között végezték, a vizsgálatok számítógépes (pl. PAL-teszt) és papír alapú neuropszichológiai tesztekből álltak. A vizsgálatokra egy külön, jól megvilágított helyiségben került sor, ahol csak a beteg és egy vizsgáló volt jelen. A referencia teszteket is a Neuropszichológiai kompendium (Strauss et al., 2006a) ajánlásai szerint töltötték ki és értékelték, míg a számítógépes teszteket a szoftverrel értékelték.
A neuropszichológiai teszteket két, korábban kiképzett orvostanhallgató végezte egy pszichológus és egy pszichiáter felügyelete mellett. A tesztek értékelése során a Neuropszichológiai kompendium (Strauss et al., 2006a) irányelveit követték. A papír alapú teszteket ugyanez a pszichológus és egy pszichiáter értékelte a kompendium szerint. A páros társas tanulási teszteket (PAL-teszt) egy szoftver segítségével automatikusan értékelték. Az MR-adatokat szintén automatikusan elemezték és értékelték a Freesurfer és a SAS szoftverrel; ezért a neuroképalkotó adatok elemzésében nem vettek részt szubjektív ítéletek. Mivel a PAL-teszt és a neuroimaging-adatok értékelése és kiértékelése teljesen automatikus volt, az emberi ítéletekből származó torzítás alacsony volt (csak a papír alapú tesztek értékelésére korlátozódott).
A demenciában szenvedő alanyokat a Mini Mental State Examination (MMSE) alapján kizártuk a vizsgálatból. Az MMSE egy standard teszt; hatékonyságát több tanulmány is bizonyította, mint hasznos módszert a demenciában szenvedő alanyok és az egészséges kontrollok megkülönböztetésére (Petersen et al., 1999; Gomar et al., 2011). A korábbi tanulmányok többsége a 26-os cut off pontszámot vagy a demencia életkorhoz igazított pontszámát használta. A teszt részfeladatai a tájékozódást, a központi végrehajtó funkciókat, a gyors asszociációképzést, a verbális azonosítási képességet, valamint az elemző és szintetizáló képességet értékelik.
A globális kognitív teljesítmény értékelésére az Addenbrooke’s Cognitive Examinationt használták, beleértve a tájékozódási, figyelem, memória, verbális folyékonyság, verbális és vizuospatialis képességeket (Mathuranath et al, 2000; Alexopoulos et al., 2010).
A Rey auditív verbális tanulási tesztet a Petersen-kritériumok alapján a memóriafunkciók részletes értékelésére használták. A Rey-teszt a verbális tanulást és a memóriát értékeli (Rey, 1958). Egy 15 szóból álló listát (A lista) kell a kísérleti személynek azonnal megismételnie. Ezt a tesztet 5 alkalommal kell megismételni. Ezután egy másik 15 szavas listát (B-lista vagy interferencia-lista) mutatnak be egyszer, amelyet fel kell idézni. Ezután az A listát ismétlés nélkül kell felidézni, majd ezt a feladatot 30 perc múlva megismételjük.
A Trail Making teszt, A és B rész (számkapcsolat; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) a szelektív figyelem, a végrehajtó funkciók és a kognitív rugalmasság értékelésére szolgál. Az A részben véletlenszerűen elosztott számokat kell számsorrendben összekapcsolni, míg a B részben véletlenszerűen elosztott számokat és betűket kell megjeleníteni. A kísérleti személyt arra utasítják, hogy a számokat és a betűket egy előre meghatározott sorrendben kapcsolja össze. A függő változó a teszt elvégzéséhez szükséges idő. A TMT A része a végrehajtó funkciókat és a figyelmet méri, míg a B részben nyújtott teljesítményben a kognitív rugalmasság is tükröződik.
A neuropszichológiai tesztek eredményeit az 1. táblázat foglalja össze.
Minden résztvevő kitöltött egy űrlapot, amelyben saját egészségi állapotát és memóriafunkcióit értékelte, továbbá be kellett számolnia számítógép- és internethasználatáról, szabadidős tevékenységeiről, alkoholfogyasztásáról, táplálkozási szokásairól és dohányzásáról (Yesavage, 1988). A depressziós tünetek felmérésére a Geriátriai Depressziós Skálát (GDS) használták, míg a szorongásos tüneteket a Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970) segítségével mérték.
A térbeli emlékezetet a több neuropszichológiai tesztcsomagban használt PAL teszt implementációjával mérték (Siraly et al., 2013). “A PAL-tesztben a képernyőn véletlenszerű pozíciókban egymás után 3 s-ra ablakok nyílnak meg, amelyekben egy vagy több ablakban absztrakt alakzatok jelennek meg. A többi ablak a nehézségi szinttől függően üresen marad. Amikor az összes négyzetet megmutatták, a korábban bemutatott alakzatok megjelennek a képernyő közepén, és a résztvevőknek el kell dönteniük, hogy melyik ablakban látták korábban az adott alakzatot. A teszt öt különböző szintből áll, összesen nyolc szakaszban, az alakzatok száma 1-től 8-ig növekszik a különböző szakaszokon. Az alanyoknak 10 próbálkozásuk volt egy adott szakasz teljesítésére, különben a teszt véget ért. Az ablakok elrendezése aszimmetrikus volt a tesztben, és szakaszról szakaszra változott.” (Siraly et al., 2013) A számítógépes teszt során a vizsgálati személyek kényelmesen, a számítógép képernyőjétől fél méteres távolságban ültek, és az előzetes tájékoztatást követően egér segítségével oldották meg a feladatokat.
Statisztikai elemzés
A vizsgálati csoportok közötti különbségeket az agytérfogat, a kérgi vastagság és a kognitív teljesítmény tekintetében általános lineáris modellelemzéssel (GLM in SAS 9.2) elemeztük, kovariátorként az életkor és a nem szerepelt. A térfogatokat a teljes intrakraniális térfogatra (TIV) standardizáltuk, és százalékban adjuk meg. A csoportok közötti különbségek elemzésére post hoc t összehasonlításokat alkalmaztunk, ahol a p-értékeket 0,05/3 = 0,016-ra igazítottuk, ahol a három a csoportok közötti összehasonlítások számát jelenti.
A neuropszichológiai tesztek eredményei és a CNS struktúrák mérete közötti kapcsolatot Pearson korrelációkkal elemeztük. A PAL tesztben elvégzett szakaszok számával való korrelációkat Spearman korrelációval elemeztük, mivel ennek a változónak az eloszlása nagymértékben eltért a normális eloszlástól.
Eredmények
A hippokampusz és az entorhinális kéreg térfogatában szignifikáns különbséget találtunk a vizsgálati csoportok között . A post hoc tesztek azt mutatták, hogy a térfogatok szignifikánsan csökkentek az aMCI csoportban a kontrollokhoz és a naMCI csoporthoz képest, míg a másik két csoport nem különbözött szignifikánsan (3. táblázat és 1. ábra) A kovariánsok közül a nemnek szignifikáns hatása volt a hippokampusz térfogatára, a férfi vizsgálati személyeknél szignifikánsan csökkent a hippokampusz mérete a nőkhöz képest .
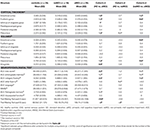
3. táblázat. A CNS struktúrák és a neuropszichológiai teszteredmények különbségei a vizsgálati csoportok között.
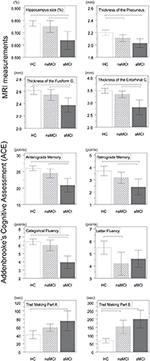
1. ábra. Csoportok közötti különbségek a CNS struktúrákban és a neuropszichológiai tesztekben. A függőleges sávok a csoportátlagokat, míg a hibasávok a standard eltéréseket jelölik. A függőleges sávok fölötti vízszintes vonalak a csoportok közötti szignifikáns különbségeket jelzik a többszörös összehasonlításokra történő korrekció után (p < 0,016). HC, egészséges kontroll; aMCI, amnesztikus enyhe kognitív károsodás; naMCI, nem amnesztikus enyhe kognitív károsodás; CNS, központi idegrendszer.
Az entorhinális kéreg , a fusiform gyrus , a cinguláris gyrus isthmusa és a precuneus átlagos vastagsága is jelentősen különbözik a vizsgálati csoportok között. A post-hoc tesztek szerint az aMCI csoportban mind a négy struktúrában csökkent kérgi vastagságot találtak a kontrollcsoporthoz képest, míg az entorhinális kéreg és a fusiform gyrus vastagsága szintén szignifikánsan csökkent az aMCI csoportban a naMCI csoporthoz képest. A csoportátlagokat, a post-hoc tesztek eredményeit és a csoportok közötti különbségeket a Cohen’s d értékek alapján a 3. táblázat foglalja össze.
A vizsgálati csoportok között szignifikáns különbség volt az anterográd memória , a retrográd memória , a kategorikus folyékonyság tekintetében. Az anterográd memóriában és a kategorikus folyékonyságban mind a kontrollcsoport, mind a naMCI csoport felülmúlta az aMCI csoportot, míg az előbbi csoportok nem különböztek szignifikánsan (3. táblázat). A retrográd emlékezetben a kontrollok felülmúlták az aMCI csoportot, de a naMCI csoportot nem. A betűk folyékonyságában a kontrollok felülmúlták a naMCI csoportot, de az aMCI csoportot nem, míg a két MCI csoport nem különbözött egymástól (p > 0,05). Továbbá a kategorikus folyékonyságban a női alanyok jobban teljesítettek, mint a férfiak , míg az életkornak nem volt szignifikáns hatása a teljesítményre.
Korrelációs elemzések
A teljes mintában erős korrelációt találtak a neuropszichológiai tesztek eredményei és a temporális agyi struktúrák térfogata és vastagsága között (4. táblázat).

4. táblázat. A CNS struktúrák és a neuropszichológiai teszteredmények közötti korrelációk a teljes mintában.
Az aMCI csoportban a Rey Verbális Tanulási Teszt eredménye szignifikáns pozitív korrelációt mutatott az amygdala méretével (r = 0,47, n = 20, p = 0,03) és az entorhinális kéreg vastagságával (r = 0,46, n = 20, p = 0,04; 2. ábra). A csökkent amigdala térfogattal és csökkent entorhinális vastagsággal rendelkező alanyok rosszabb teljesítményt mutattak a memóriateszten.

2. ábra. A Rey-féle verbális tanulási teszt által indexált rövid távú memóriateljesítmény és az amygdala térfogata, valamint az entorhinális kéreg vastagsága közötti korreláció a vizsgált csoportokban. A Pearson-féle korrelációk szignifikánsak (p < 0,05) voltak az amnesztikus MCI csoportban és a teljes mintában, míg a kontroll és a nem amnesztikus MCI csoportokban nem voltak szignifikánsak. A függőleges tengelyeken a Rey verbális teszt összpontszáma megegyezik az első öt próbában szereplő szavak összegével. piros vonal, regressziós vonal az aMCI csoportban; szaggatott vonal, regressziós vonal a teljes mintában; MCI, enyhe kognitív károsodás; r és p, Pearson korrelációs együttható az életkorral és a megfelelő szignifikanciaszinttel korrigálva az aMCI csoportban.
Továbbá a csökkent entorhinális térfogattal (r = 0,49, n = 19, p = 0,03), valamint csökkent fusiform gyrus térfogattal (r = 0,48, n = 19, p = 0,04) és fusiform kortikális vastagsággal (r = 0.53, n = 19, p = 0,02) gyengébben teljesítettek az ACE retrográd memória szubtesztjében.
Diszkusszió
Amnesztikus és nem amnesztikus MCI-t a különböző típusú NCD-k potenciális prodromáiként rendelték hozzá. Az amnesztikus enyhe kognitív károsodásban szenvedő alanyokról feltételezik, hogy nagyobb a kockázata annak, hogy Alzheimer-demenciává alakulnak át, míg a nem amnesztikus enyhe kognitív károsodásban szenvedő alanyokról azt mondják, hogy nagyobb a kockázata annak, hogy nem Alzheimer-demenciává alakulnak át (Petersen et al., 1999; Killiany et al., 2000; Petersen és Negash, 2008).
Az agy strukturális különbségeit MRI-vel vizsgálták az MCI alcsoportokban és az egészséges kontrollcsoportban, míg a kognitív teljesítménybeli különbségeket neuropszichológiai tesztekkel vizsgálták. Az MRI-eredmények szerint az entorhinális kéreg, a fusiform gyrus, a gyrus cingularis isthmus és a precuneus vastagsága, valamint az amygdala és a hippocampus térfogata csökkent az AMCI-ben az egészséges kontrollcsoporthoz képest. Ezek az eredmények összhangban vannak korábbi tanulmányokkal, amelyek arról számoltak be, hogy az egészséges alanyok, az MCI-ben vagy Alzheimer-kórban szenvedő betegek megkülönböztethetők egymástól a halántéklebeny struktúráinak, például az amygdala vagy a hippokampusz térfogata alapján (Desikan et al., 2009; McEvoy et al., 2009).
A hippokampusz és az entorhinális kéreg térfogata, valamint az entorhinális kéreg és a fusiform gyrus vastagsága jelentősen csökkent az aMCI csoportban a naMCI csoporthoz képest. A legnagyobb csoportközi különbséget az entorhinális kéreg térfogatában és vastagságában észlelték (0,9, illetve 1,2 SD), ami összhangban van azzal, hogy az Alzheimer-kórban az atrófia ebben a régióban kezdődik. Ezek az eredmények azt mutatják, hogy az MCI altípusai között korai strukturális különbségek vannak. Továbbá e strukturális leletek mintázata illeszkedik az Alzheimer-kór patológiájához (Braak és Braak, 1991), ami alátámasztja azokat a korábbi eredményeket, amelyek szerint az aMCI nagyobb gyakorisággal fejlődik Alzheimer-kórrá a naMCI-hez képest (Killiany és mtsi., 2000; Petersen és Negash, 2008).
A kontroll és a naMCI csoportot összehasonlítva csak a precuneus vastagságában találtunk szignifikáns különbséget, ami a naMCI csoportban csökkent. Érdekes módon egy nemrégiben végzett vizsgálat a naMCI-s betegek fehérállományának elváltozását találta a precuneusban is (O’Dwyer et al., 2011), amely a parahippocampalis gyrus és a prefrontális kéreg közötti információátvitelt fenntartó fontos csomópont (Vincent et al., 2006), és fontos szerepet játszik az emlékezeti folyamatban és a vizuális képzeletben.
A neuropszichológiai tesztek közül az MMSE nem különbözött a vizsgálati csoportokban, ami valószínűleg a demenciában szenvedő betegek kizárásának következménye. Az ACE összes, az ACE anterográd memória és az ACE kategóriafolyamatosság szubtesztekben az aMCI csoport rosszabbul teljesített a naMCI csoporthoz és az egészséges kontrollcsoporthoz képest. Az ACE retrográd memória tesztjében és a Trail Making A és B tesztekben az aMCI csoport csak az egészséges kontrollcsoportnál teljesített rosszabbul, míg a két MCI alcsoport között nem mutatkozott különbség. A memóriafeladatokban (RAVLT és ACE retrográd memóriafeladat) az aMCI csoport csökkent teljesítménye korrelált a temporális lebeny struktúráinak, például az entorhinalis kéregnek és az amygdala fokozott érintettségével (2. ábra), ami tovább erősíti a csoportok közötti különbségekre vonatkozó eredményeinket.
A betűfolyamatossági feladatban a naMCI csoport rosszabbul teljesített, mint az egészséges csoport, míg az aMCI nem különbözött a többi csoporttól. A Trail making B teszt a vizuális figyelem és a feladatváltás mutatója. Mindkét MCI-csoport kontrollokhoz viszonyított csökkent teljesítménye (3. táblázat) valószínűleg a frontális érintettség eredménye. Mind a kategória-, mind a betűfolyamatossági feladatok erősen támaszkodnak a homloklebeny működésére, beleértve a végrehajtó folyamatokat, amelyek megkövetelik az alanyoktól az előhívás megszervezését, a korábban felidézett válaszok ellenőrzését, a verbális válaszok kezdeményezését és a kritériumoknak nem megfelelő válaszok gátlását (Henry et al., 2004). “Mindkét mérés hozzáfér a szemantikus memóriaraktárakhoz is, ami a halántéklebeny funkciója; bár úgy tűnik, hogy a betűfolyamatosság kisebb mértékben csapolja meg ezt a halántéklebenyhez kapcsolódó képességet, mint a kategóriafolyamatosság” (Lezak et al., 2004). Léziós és funkcionális agyi képalkotó vizsgálatok is alátámasztják a temporális és frontális lebenyek érintettségét a fluencia képességben. Korábbi fMRI-vizsgálatok kimutatták, hogy a levélfolyamatosság a frontális lebenyek fokozott aktivációjával jár együtt, míg a kategóriafolyamatosság során mind a frontális, mind a temporális lebeny aktív (Birn és mtsai., 2010). Ez jól egybevág a mi eredményeinkkel, miszerint az aMCI szignifikánsan különbözik a kategóriafolyamatosság szerint az egészséges és a naMCI csoporthoz képest, míg a betűfolyamatosság eredményében nincs szignifikáns különbség a két alcsoport között.
A RAVLT és a PAL tesztek által indexelt verbális és vizuális memóriafunkciók, valamint a temporális struktúrák, például az entorrhinalis kéreg térfogata és kérgi vastagsága között erős korrelációt találtunk (4. táblázat) a teljes mintában és az aMCI csoportban is (2. ábra). Ezek az eredmények kereszthitelesítik e neuropszichológiai és MRI-markerek hasznosságát a kóros kognitív hanyatlás korai diagnózisában és a betegség progressziójának nyomon követésében.
Korlátozások
A vizsgálat korlátja, hogy az aMCI-csoportban a vizsgálati személyek többsége multi-domain típusú volt, mivel a nyomkeresési teszt B és az ACE által értékelt végrehajtó funkciókban nyújtott teljesítményük a normál tartomány alatt volt. Ez a korlátozás azzal a ténnyel együtt, hogy a naMCI heterogénebb entitás az aMCI-hez képest, magyarázhatja, hogy a jelenlegi vizsgálat miért nem talált csökkent méretű CNS-struktúrákat a naMCI-csoportban az aMCI-csoporthoz képest.
Következtetések
Az aMCI és a naMCI elnevezése nem csak elméleti kérdés, hanem ezek az altípusok mind neuropszichológiai, mind agyszerkezeti szempontból különböző entitások. Az enyhe kognitív zavar különböző altípusaira vonatkozó specifikus MRI- és neuropszichológiai kritériumok kidolgozása lehetővé teszi majd az MCI altípusok meghatározó tényezőinek és prevalenciájának felmérését.
Az MCI altípusok hozzárendelése hasznos lesz a demencia típusának és a demenciává válás kockázatának jobb előrejelzéséhez. Továbbá az MCI altípusok hozzárendelése jobb megközelítést nyújthat a terápiás lehetőségek hatékonyságának vizsgálatához a neurokognitív zavarokba való átmenet megelőzésében. Eredményeink alapján az MRI hasznos eszköz lehet az MCI altípusok pontosabb elkülönítéséhez.
A szerzők hozzájárulása
GC tervezte a vizsgálatot, írta a protokollt, vállalta a statisztikai elemzést, készítette az ábrákat és írta a kézirat első tervezetét ES részt vett a mérések végrehajtásában, irányította az irodalmi keresést és elemzéseket, valamint írta a bevezetés és a következtetés első tervezetét. ÁS közreműködött a kézirat valamennyi szakaszának véglegesítésében. ZF, AH részt vett a mérések végrehajtásában, és hozzájárult a módszertani rész megírásához. ÉC, PS, ZH, GR a vizsgálat során a kísérletek felügyeletét adta, beleértve a kézirat megírását is. Minden szerző hozzájárult és jóváhagyta a végleges kéziratot.
Finanszírozás
A tanulmányt az “Ambient Assisted Living Joint Programme (AAL)-Call 2” pályázat (projekt azonosító: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu) támogatta.
Érdekütközéssel kapcsolatos nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). Az Alzheimer-kór okozta enyhe kognitív károsodás diagnózisa: az Alzheimer-kór diagnosztikai irányelveivel foglalkozó National Institute on Aging-Alzheimer’s Association munkacsoportok ajánlásai. Alzheimer Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). A német felülvizsgált Addenbrooke-féle kognitív vizsgálat validálása az enyhe kognitív károsodás, az enyhe demencia az Alzheimer-kórban és a frontotemporális lebeny degeneráció kimutatására. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Betű- és szemantikai kategóriajelzések által vezérelt lexikális keresést támogató neurális rendszerek: a szóbeli beszédkészség önálló tempójú, nyílt válasz fMRI-vizsgálata. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Enyhe kognitív károsodás – a prevalencia, az incidencia és a kimenetel áttekintése a jelenlegi megközelítések szerint. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Az Alzheimerrel kapcsolatos elváltozások neuropatológiai szakaszolása. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF0030308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). A kognitívan egészséges idős egyének azonosítása a későbbi memóriacsökkenéssel az automatizált MR temporoparietális térfogatok segítségével. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Kortikális felület alapú elemzés. I. Szegmentálás és felszínrekonstrukció. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automatizált MRI-mérések azonosítják az enyhe kognitív károsodásban és Alzheimer-kórban szenvedő egyéneket. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). Az MRI-eredetű entorhinális térfogat jó előrejelzője az MCI-ből AD-be való átmenetnek. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Az emberi agykéreg vastagságának mérése mágneses rezonanciás képekből. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Mágneses rezonanciás képek szekvenciafüggetlen szegmentálása. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Kortikális felület alapú elemzés. II: Infláció, laposodás és felületalapú koordinátarendszer. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). Nagy felbontású interszubjektumos átlagolás és a kérgi felszín koordinátarendszere. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C. és DeKosky, S. T. (2004). Enyhe kognitív zavar, amnesztikus típus: epidemiológiai vizsgálat. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). A biomarkerek, kognitív markerek és kockázati tényezők kombinációinak hasznossága az enyhe kognitív károsodásból Alzheimer-kórba való átmenet előrejelzésére az Alzheimer-kór neuroimaging kezdeményezésben részt vevő betegeknél. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). A MIld kognitív károsodás megkülönböztethető az alzheimer-kórtól és a normál öregedéstől a klinikai vizsgálatok szempontjából. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Az enyhe kognitív zavar altípusainak prediktív érvényessége és diagnosztikai stabilitása. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). A CSF biomarkerek és a kezdődő Alzheimer-kór közötti összefüggés enyhe kognitív károsodásban szenvedő betegeknél: követéses vizsgálat. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). Verbális folyékonysági teljesítmény Alzheimer-típusú demenciában: metaanalízis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Az Alzheimer-kór előrejelzése MRI-alapú hippokampusz térfogattal enyhe kognitív károsodásban. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). A strukturális mágneses rezonancia képalkotás alkalmazása annak előrejelzésére, hogy ki fog Alzheimer-kórban megbetegedni. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Az enyhe kognitív károsodás előfordulása és kimenetele egy lakossági prospektív kohorszban. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropszichológiai értékelés, 4. kiadás. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). Rövid kognitív tesztsorozat az Alzheimer-kór és a frontotemporális demencia megkülönböztetésére. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkerek és kezdődő Alzheimer-kór enyhe kognitív károsodásban szenvedő betegeknél. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer-kór: kvantitatív strukturális neuroimaging az enyhe kognitív károsodás klinikai és strukturális változásainak kimutatására és előrejelzésére. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). Az MCI demenciává alakulása és az APOE genotípus: előrejelző vizsgálat FDG-PET segítségével. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). A diffúzió többféle indexe azonosítja a fehérállomány károsodását enyhe kognitív károsodásban és Alzheimer-kórban. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Az enyhe kognitív zavar mint diagnosztikai entitás. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Enyhe kognitív károsodás: áttekintés. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Enyhe kognitív károsodás: klinikai jellemzés és kimenetel. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., and DeKosky, S. T. (2001). Gyakorlati paraméter: A demencia korai felismerése: enyhe kognitív károsodás (bizonyítékokon alapuló áttekintés). Az Amerikai Neurológiai Akadémia Minőségi standardok albizottságának jelentése. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). A nyomkeresési teszt és az organikus agykárosodás kapcsolata. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Nagy pontosságú inverz konzisztens regisztráció: robusztus megközelítés. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A koponyacsíkozási probléma hibrid megközelítése MRI-ben. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Enyhe kognitív károsodás: ugyanaz az identitás különböző entitásokhoz. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). A kognitív hanyatlás korai jeleinek nyomon követése időseknél számítógépes játékokkal: egy MRI-vizsgálat. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovács, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013) . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3. kiadás. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). “Mini Mental State Examination (MMSE)”, in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A és B: normatív adatok kor és iskolai végzettség szerint rétegezve. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). A koherens spontán aktivitás azonosítja a hippokampusz-parietális memóriahálózatot. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriátriai depressziós skála. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). A bazális előagy és a hippokampusz szürkeállományának atrófiája enyhe kognitív károsodásban. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar