- Introduktion
- Metoder
- Etiskt uttalande
- Deltagare
- MR Bildförvärv och bearbetning
- Förfaranden
- Statistisk analys
- Resultat
- Skillnader i kortikala volymer, kortikaltjocklek och kognitiva prestationer mellan försökspersoner med amci, namci och kontroller
- Korrelationsanalyser
- Diskussion
- Begränsningar
- Slutsatser
- Författarens bidrag
- Finansiering
- Intressekonfliktförklaring
Introduktion
Större neurokognitiva störningar eller demens, inklusive Alzheimers sjukdom, är ett förödande problem i vårt åldrande samhälle, med enorma sociala, ekonomiska och medicinska bördor. Eftersom vi för närvarande inte har någon effektiv behandling för NCD har den senaste forskningen inriktats på att upptäcka tidiga symtom. Sammanfallande bevis från många nyligen genomförda studier visar att den patologiska processen för Alzheimers sjukdom börjar flera decennier innan de första symptomen på kognitiv försämring uppträder (Mattsson et al., 2009). Det mellanliggande stadiet mellan den förväntade kognitiva nedgången vid fysiologiskt åldrande och den allvarliga nedgången vid demenssjukdom som kallas ”mild kognitiv nedsättning” (MCI) har rönt stort intresse. ”Vid MCI kan mild försämring av kognitiva färdigheter avslöjas genom neuropsykologiska tester, medan globala kognitiva funktioner och vardagsaktiviteter bevaras” (Petersen, 2004). Den högre omvandlingsfrekvensen till NCD vid MCI ger den kliniska betydelsen av detta tillstånd före sjukdomen. Omvandlingen till NCD är 10-15 % per år vid MCI jämfört med 1-4 % per år i den genomsnittliga äldre befolkningen (Petersen et al., 2001; Bischkopf et al., 2002). Majoriteten av dessa patienter utvecklar klinisk AD. Det bör noteras att MCI också kan vara ett stabilt eller omvänt tillstånd som inte utvecklas till demens. Longitudinella epidemiologiska studier rapporterade en varierande omvandlingsfrekvens och en relativt frekvent återgång till normal kognition (Larrieu et al., 2002; Ganguli et al., 2004). Olika resultat tyder på instabilitet i den diagnostiska noggrannheten och ett behov av mer specifik identifiering mellan MCI-patienterna (Han et al., 2012). Mot bakgrund av ovanstående är det förståeligt att flera studier är inriktade på de symtom och skillnader från genomsnittspopulationen som är nära kopplade till utvecklingen av demens och som därför kan användas för att hjälpa till med den tidiga diagnosen.
Patienter med MCI kan kategoriseras vidare som amnestisk (aMCI) och icke-amnestisk MCI (naMCI). Vid aMCI är minnesförlusten dominerande och är förknippad med hög risk för ytterligare omvandling till AD (Grundman, 2004). Individer med naMCI har försämringar inom andra områden än minnet och har en högre risk att konvertera till andra demensformer, t.ex. diffus Lewykroppsdemens. Båda typerna kan kategoriseras vidare till subtyper med en domän och flera domäner, men i den aktuella undersökningen gjordes ingen ytterligare kategorisering på grund av den begränsade urvalsstorleken. Betydande typer av biomarkörer för MCI har testats i syfte att identifiera de särskilda egenskaperna hos patienter som övergår till Alzheimers sjukdom. Medan resultaten från studier av biomarkörer i cerebrospinalvätska (Hansson et al., 2006) och positronemissionstomografi (Mosconi et al., 2004) pekade på mycket varierande specificitet och sensitivitet, visade studier av strukturell magnetisk resonanstomografi imponerande resultat (Jack et al., 1999; deToledo-Morrell et al., 2004). Intressant nog har flera tidigare studier undersökt skillnaderna mellan personer med MCI och friska kontroller, men endast ett fåtal studier har försökt skilja mellan MCI-subtyperna (Zhang et al., 2011; Serra et al., 2013).
Men även om aMCI och naMCI teoretiskt sett är olika entiteter, har endast ett fåtal undersökningar studerat de strukturella skillnaderna i hjärnan mellan dessa subtyper av MCI (Serra et al., 2013). Syftet med studien var att hitta de strukturella skillnaderna mellan aMCI och naMCI och att replikera tidigare resultat om differentiering mellan aMCI och friska kontroller. Baserat på tidigare studier om MCI och konvertering till demens fokuserade vi på strukturer i temporalloben och angränsande regioner (Chiang et al, 2011): den entorhinala cortexen, hippocampus, den parahippocampala cortexen, amygdala, den fusiforma gyrus, precuneus, den bakre cingulära cortexen och isthmus av cingulära gyrus.
Metoder
Denna studie är en fortsättning på vårt tidigare publicerade arbete (Sirály et al., 2015). Eftersom ett liknande neuropsykologiskt testbatteri och samma MRI-förvärv och bearbetningspipeline har använts i den aktuella studien har metoder och förfaranden beskrivits på liknande sätt i båda artiklarna.
Etiskt uttalande
Experimenten genomfördes i full överensstämmelse med Helsingforsdeklarationen och alla relevanta nationella och internationella etiska riktlinjer. Forskningen godkändes av den nationella etikkommittén i Budapest, Ungern. Alla förfaranden utfördes först efter att skriftligt informerat samtycke erhållits från deltagarna. Alla potentiella deltagare som avböjde att delta eller på annat sätt inte deltog missgynnades inte på något sätt genom att inte delta i studien.
Deltagare
Studien genomfördes vid institutionen för psykiatri och psykoterapi, Semmelweisuniversitetet, Budapest. Sammanlagt 62 personer deltog i studien. Alla försökspersoner ansökte om att delta i ett kognitivt träningsprogram som tillkännagavs bland allmänläkare och på ett äldreboende (Studien är registrerad på ClinicalTrials.gov, identifierare är ”NCT02310620”). Alla försökspersoner kunde leva ett självständigt liv. Grundläggande demografiska och neuropsykologiska data sammanfattas i tabell 1.

Tabell 1. Demografiska data och resultat av grundläggande neuropsykologiska tester.
Personer med aMCI och naMCI samt friska kontroller inkluderades i studien baserat på Petersens kriterier (Petersen, 2004). Petersens kriterier innefattar subjektiva minnesbesvär bekräftade av en informant tillsammans med bevarade vardagliga aktiviteter, en minnesnedsättning baserad på ett neuropsykologiskt standardtest, bevarade globala kognitiva funktioner och slutligen uteslutning av demens. Det anges inget neuropsykologiskt test för bedömning av minnesstörningar, därför tillämpade vi Rey Auditory Verbal Learning Test (RAVLT), som är det mest använda testet baserat på litteraturen (Gomar et al., 2011). För att skilja mellan aMCI och friska kontroller tillämpade vi ett gränsvärde på 1 SD under befolkningens medelvärde standardiserat för ålder och kön. Deltagare som fick ett resultat under gränsvärdet antingen i delresultatet för fördröjd återkallelse eller i totalresultatet placerades i aMCI-gruppen. De tillämpade kriterierna är baserade på rekommendationerna från National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease (Albert et al., 2011). De exakta gränsvärdena för RAVLT för de olika åldersgrupperna anges i tabell 2A. Försökspersoner som inte ingick i aMCI-gruppen, men som fick 1 SD under befolkningsgenomsnittet standardiserat för ålder och kön/utbildning antingen i Trail making Test B eller i Addenbrooke’s Cognitive Examination (ACE), placerades i naMCI-gruppen. Ett ytterligare kriterium för naMCI-gruppen var en lägre än 3,2 VLOM-kvot (verbal fluency + language score/orientation + memory score) i ACE för att utesluta eventuella aMCI-personer från naMCI-gruppen (dessa personer uteslöts från studien).

Tabell 2. (A). Rey Auditory Verbal Learning Test (RAVLT): normativa data och gränsvärden för Mild Cognitive Impairment (MCI) justerade för ålder. (B) Mini Mental Examination Test (MMSE): gränsvärden för demenssjukdom justerade för ålder och utbildning.
Föremålen med demenssjukdom exkluderades från studien enligt Mini Mental State Examination (MMSE) standardiserade för ålder och utbildning (Strauss et al., 2006b). De exakta gränsvärdena för MMSE i de olika ålders- och utbildningsgrupperna finns i tabell 2B. Försökspersoner med anamnes på huvudtrauma, epilepsi eller stroke, eller diagnos av akut psykiatrisk störning, schizofreni eller mani, alkoholberoende uteslöts också från studien.
MR Bildförvärv och bearbetning
Alla försökspersoner undersöktes med hjärn-MRI som producerade högupplösta strukturella bilder, som användes för vidare bearbetning och analys. Bildförvärv gjordes vid MR Research Center, Semmelweis University, Budapest på en 3 Tesla Philips Achieva klinisk MR-skanner utrustad med en SENSE-huvudspole med åtta kanaler. De högupplösta anatomiska bilderna av hela hjärnan togs med hjälp av en T1-viktad tredimensionell spoiled gradient echo-sekvens (T1W 3D TFE). 180 sammanhängande skikt förvärvades från varje försöksperson med följande bildparametrar: TR = 9,7 ms; TE = 4,6 ms; flipvinkel = 8°; FOV 240 × 240 mm; voxelstorlek 1,0 × 1,0 × 1,0 mm.
Kortikal rekonstruktion och volymetrisk segmentering utfördes med Freesurfer 5.3 bildanalys-sviten, som är dokumenterad och fritt tillgänglig för nedladdning online (http://surfer.nmr.mgh.harvard.edu/). De tekniska detaljerna för dessa förfaranden beskrivs i tidigare publikationer, vi gjorde inga ändringar i denna pipeline. I korthet omfattar bildbehandlingen rörelsekorrigering (Reuter et al., 2010), avlägsnande av icke-hjärnvävnad med hjälp av en hybridprocedur för vattendelare/ytedeformation (Segonne et al., 2004), automatiserad Talairach-transformation, segmentering av den subkortikala vita substansen och volymetriska strukturer i den djupa grå substansen (inklusive hippocampus, amygdala, caudate, putamen, ventriklar) (Fischl et al, 2004), intensitetsnormalisering, tesselering av gränsen mellan grå substans och vit substans, automatiserad topologikorrigering och ytdeformation efter intensitetsgradienter för att på ett optimalt sätt placera gränsen mellan grå och vit substans och mellan grå och cerebrospinalvätska på den plats där den största intensitetsförskjutningen definierar övergången till den andra vävnadsklassen (Dale et al., 1999; Fischl och Dale, 2000). När kortikalmodellerna var färdiga utförde Freesurfer ett antal deformationsförfaranden för ytterligare databehandling och analys. Stegen omfattade ytinflation (Fischl et al., 1999a), registrering till en sfärisk atlas som använde individuella kortikala veckningsmönster för att matcha den kortikala geometrin mellan olika försökspersoner (Fischl et al., 1999b), parcellering av hjärnbarken i enheter baserade på gyral- och sulcalstruktur (Fischl et al., 2004) och skapande av en mängd olika ytbaserade data, inklusive kartor över krökning och sulcaldjup. Slutligen kvalitetsgranskades kortikalmodellerna och resultaten av segmenteringen och korrigerades manuellt på varje försöksperson, men korrigeringen visade inga signifikanta förändringar av resultaten.
Förfaranden
De neuropsykologiska undersökningarna genomfördes på vardagar mellan kl. 8.00 och 16.00. Undersökningarna bestod av datoriserade (dvs. PAL-testet) och pappersbaserade neuropsykologiska tester. Testerna ägde rum i ett separat väl upplyst rum där endast patienten och en examinator var närvarande. Referenstesterna fylldes också i och utvärderades enligt rekommendationerna i Neuropsychological Compendium (Strauss et al., 2006a), medan de datoriserade testerna utvärderades med hjälp av programvaran.
De neuropsykologiska testerna administrerades av två tidigare utbildade medicinstudenter under överinseende av en psykolog och en psykiatriker. Vid bedömningen av testerna följdes riktlinjerna i Neuropsychological Compendium (Strauss et al., 2006a). De pappersbaserade testerna bedömdes av samma psykolog och en psykiater enligt kompendiet. Paired Associates Learning Test (PAL-testet) utvärderades automatiskt av en programvara. MR-data analyserades och utvärderades också automatiskt av Freesurfer- och SAS-programvaran; därför ingick inga subjektiva bedömningar i analysen av neuroimageringsdata. Eftersom bedömningen och utvärderingen av PAL-testet och neuroavbildningsdata var helt automatiska var bias från mänskliga bedömningar låg (begränsad endast till utvärderingen av de pappersbaserade testerna).
Subjekt med demenssjukdom uteslöts från studien baserat på Mini Mental State Examination (MMSE). MMSE är ett standardtest; dess effektivitet har bevisats i flera studier, som en användbar metod för att skilja mellan personer med demens och friska kontroller (Petersen et al., 1999; Gomar et al., 2011). Majoriteten av de tidigare studierna använde cut off-poängen 26 eller den åldersjusterade poängen för demenssjukdom. Deluppgifterna i testet bedömer orientering, centrala exekutiva funktioner, snabb associationsbildning, verbal identifieringsförmåga samt förmågan att analysera och syntetisera.
Addenbrooke’s Cognitive Examination användes för att bedöma den globala kognitiva prestandan, inklusive orientering, uppmärksamhet, minne, verbalt flyt, verbala och visuospatiala färdigheter (Mathuranath et al, 2000; Alexopoulos et al., 2010).
The Rey Auditory Verbal Learning Test användes för en detaljerad bedömning av minnesfunktionerna utifrån Petersens kriterier. Rey-testet utvärderar verbal inlärning och minne (Rey, 1958). En lista med 15 ord (lista A) ska omedelbart upprepas av försökspersonen. Detta test upprepas 5 gånger. Därefter presenteras en annan lista med 15 ord (lista B eller interferenslista) en gång som ska återkallas. Därefter ska lista A återkallas utan att upprepas, och sedan upprepas denna uppgift efter 30 min.
The Trail Making test, Part A and Part B (number connection; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) används för att utvärdera selektiv uppmärksamhet, exekutiva funktioner och kognitiv flexibilitet. I del A ska slumpmässigt fördelade nummer kopplas samman i numerisk ordning, medan slumpmässigt fördelade nummer och bokstäver visas i del B. Försökspersonen instrueras att koppla ihop siffrorna och bokstäverna i en förutbestämd ordning. Den beroende variabeln är den tid som krävs för att genomföra testet. Del A av TMT mäter exekutiva funktioner och uppmärksamhet, medan i prestationen på del B återspeglas även kognitiv flexibilitet.
Resultaten av de neuropsykologiska testerna sammanfattas i tabell 1.
Alla deltagare fyllde i ett formulär där de utvärderade sitt eget hälsotillstånd och sin minnesfunktion; dessutom var de tvungna att rapportera om sin dator- och internetanvändning, fritidsaktiviteter, alkoholkonsumtion, kostvanor och rökning (Yesavage, 1988). Geriatric Depression Scale (GDS) användes för att bedöma depressiva symtom, medan ångestsymtom mättes med Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
Visuospatialt minne mättes med en implementering av PAL-testet som används i flera neuropsykologiska testbatterier (Siraly et al., 2013). ”I PAL-testet öppnas fönster i slumpmässiga positioner på skärmen efter varandra under 3 s med abstrakta former som visas i ett eller flera fönster. Andra fönster förblir tomma beroende på svårighetsgrad. När alla rutor har visats visas de tidigare visade formerna i mitten av skärmen och deltagarna måste avgöra i vilket fönster de såg formen tidigare. Testet består av fem olika nivåer i totalt åtta steg. Antalet figurer ökar från 1 till 8 i de olika stegen. Försökspersonerna hade 10 försök att slutföra ett visst steg, annars avslutades testet. Arrangemanget av fönster var asymmetriskt i testet och det ändrades från steg till steg.” (Siraly et al., 2013) Under det datoriserade testet satt försökspersonerna bekvämt på ett avstånd av en halv meter från datorskärmen och efter förhandsinformation löste de uppgifterna med hjälp av en mus.
Statistisk analys
Differenser mellan undersökningsgrupperna i hjärnvolymer, kortikaltjocklek och kognitiv prestation analyserades med hjälp av en analys med en allmän linjär modell (GLM i SAS 9.2) med ålder och kön som kovariater. Volymerna standardiserades för total intrakraniell volym (TIV) och anges i procent. För att analysera skillnader mellan grupperna tillämpades post hoc t-jämförelser, där p-värdena justerades till 0,05/3 = 0,016, där tre står för antalet jämförelser mellan grupperna.
Sambandet mellan resultaten av de neuropsykologiska testerna och storleken på CNS strukturerna analyserades med hjälp av Pearson korrelationer. Korrelationer med antalet genomförda steg i PAL-testet analyserades med Spearmankorrelation, eftersom fördelningen av denna variabel till stor del avvek från normalfördelningen.
Resultat
Skillnader i kortikala volymer, kortikaltjocklek och kognitiva prestationer mellan försökspersoner med amci, namci och kontroller
En signifikant skillnad hittades i volymen av hippocampus och i volymen av entorhinal cortex mellan undersökningsgrupperna . Post hoc-testerna visade att volymerna är signifikant minskade i aMCI-gruppen i förhållande till kontrollerna och naMCI-gruppen, medan de andra två grupperna inte skiljde sig signifikant åt (tabell 3 och figur 1) Bland kovariablerna hade kön en signifikant effekt på hippocampusvolymen, manliga försökspersoner hade en signifikant minskad hippocampusstorlek i förhållande till kvinnliga .
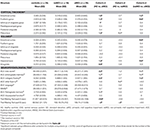
Tabell 3. Skillnader i CNS strukturer och resultat av neuropsykologiska tester mellan undersökningsgrupperna.
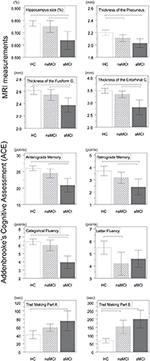
Figur 1. Skillnader mellan grupperna i CNS strukturer och neuropsykologiska tester. Vertikala staplar representerar gruppernas medelvärden, medan felstaplarna representerar standardavvikelser. De horisontella linjerna över de vertikala staplarna anger signifikanta skillnader mellan grupperna efter korrigering för multipla jämförelser (p < 0,016). HC, friska kontroller; aMCI, amnestic mild cognitive impairment; naMCI, non-amnestic mild cognitive impairment; CNS, centrala nervsystemet.
Den genomsnittliga tjockleken på entorhinal cortex , den fusiforma gyrus , isthmus av cingulated gyrus och precuneus skiljer sig också signifikant mellan undersökningsgrupperna. Enligt post-hoc-testerna hittades minskad kortikaltjocklek hos aMCI i förhållande till kontrollerna i alla fyra strukturerna, medan tjockleken på entorhinal cortex och fusiform gyrus också var signifikant minskad i aMCI-gruppen i förhållande till naMCI-gruppen. Gruppernas medelvärden, resultaten av post-hoc-testerna och skillnaderna mellan grupperna i form av Cohens d sammanfattas i tabell 3.
Det fanns en signifikant skillnad mellan undersökningsgrupperna i anterogradminne , retrogradminne , kategorisk flytbarhet . I anterogradminne och kategorisk flytbarhet överträffade både kontrollgruppen och naMCI-gruppen aMCI-gruppen, medan de förstnämnda grupperna inte skiljde sig signifikant åt (tabell 3). När det gäller retrograd minnesförmåga presterade kontrollerna bättre än aMCI-gruppen, men inte naMCI-gruppen. I bokstavsflytande presterade kontrollerna bättre än naMCI-gruppen, men inte aMCI-gruppen, medan de två MCI-grupperna inte skiljde sig från varandra (p > 0,05). Dessutom presterade kvinnliga försökspersoner bättre än manliga i kategorisk flytning, medan ålder inte hade någon signifikant effekt på prestationen.
Korrelationsanalyser
I hela urvalet hittades starka korrelationer mellan resultaten av de neuropsykologiska testerna och volymen och tjockleken på de temporala hjärnstrukturerna (tabell 4).

Tabell 4. Korrelationer mellan CNS strukturer och resultaten av de neuropsykologiska testerna i hela urvalet.
I aMCI-gruppen visade resultatet av Rey Verbal Learning Test en signifikant positiv korrelation med storleken på amygdala (r = 0,47, n = 20, p = 0,03) och tjockleken på entorhinal cortex (r = 0,46, n = 20, p = 0,04; figur 2). Försökspersoner med minskade amygdalavolymer och minskad entorhinal tjocklek uppvisade sämre resultat på minnestestet.

Figur 2. Korrelation mellan korttidsminnesprestanda som indexeras av det verbala inlärningstestet Rey och amygdalavolymen och den entorhinala cortexens tjocklek i undersökningsgrupperna. Pearsonkorrelationerna var signifikanta (p < 0,05) i gruppen med amnestisk MCI och i hela urvalet, medan de var icke-signifikanta i kontrollgruppen och i grupperna med icke-amnestisk MCI. Rey verbal test totalpoäng på de vertikala axlarna är lika med summan av orden i de fem första försöken. röd linje, regressionslinje i aMCI-gruppen; streckad linje, regressionslinje i hela urvalet; MCI, mild kognitiv nedsättning; r och p, Pearsonkorrelationskoefficient justerad för ålder och motsvarande signifikansnivå i aMCI-gruppen.
Förutom personer med minskade entorhinala volymer (r = 0,49, n = 19, p = 0,03) och minskade volymer av fusiform gyrus (r = 0,48, n = 19, p = 0,04) och fusiform kortikaltjocklek (r = 0,48, n = 19, p = 0,04) och fusiform kortikaltjocklek (r = 0.53, n = 19, p = 0,02) presterade svagare i delprovet retrograd minnesförmåga i ACE.
Diskussion
Amnestisk och icke-amnestisk MCI tilldelades som potentiella prodromer till olika typer av NCD. Personer med amnestisk mild kognitiv nedsättning antas ha en högre risk att övergå till Alzheimers demens, medan personer med icke-amnestisk mild kognitiv nedsättning sägs ha en högre risk att övergå till icke- Alzheimers demens (Petersen et al, 1999; Killiany et al., 2000; Petersen och Negash, 2008).
De strukturella skillnaderna i hjärnan undersöktes med MRT i MCI-undergrupperna och den friska kontrollgruppen, medan skillnaderna i kognitiv förmåga undersöktes med neuropsykologiska tester. Enligt MRT-resultaten var tjockleken på entorhinal cortex, den fusiforma gyrus, isthmus av gyrus cingularis och precuneus samt volymen av amygdala och hippocampus minskade hos aMCI i förhållande till friska kontroller. Dessa resultat är i linje med tidigare studier som rapporterar att friska personer, patienter med MCI eller Alzheimers sjukdom kan särskiljas från varandra baserat på volymerna av strukturer i tinningloben såsom amygdala eller hippocampus (Desikan m.fl, 2009; McEvoy et al., 2009).
Volymerna av hippocampus och entorhinal cortex och tjockleken av entorhinal cortex och fusiform gyrus är signifikant minskade i aMCI-gruppen jämfört med naMCI-gruppen. Den största skillnaden mellan grupperna upptäcktes i volymen och tjockleken hos den entorhinala cortexen (0,9 respektive 1,2 SD), vilket ligger i linje med att atrofi vid Alzheimers sjukdom börjar i denna region. Dessa resultat visar att det finns tidiga strukturella skillnader mellan subtyperna av MCI. Dessutom stämmer mönstret i dessa strukturella fynd överens med patologin vid Alzheimers sjukdom (Braak och Braak, 1991), vilket understryker de tidigare resultaten att aMCI utvecklas till Alzheimers sjukdom med högre frekvens i förhållande till naMCI (Killiany et al., 2000; Petersen och Negash, 2008).
Vid jämförelse mellan kontroll- och naMCI-gruppen hittades en signifikant skillnad endast i tjockleken på precuneus, som var minskad i naMCI-gruppen. Intressant nog fann man i en nyligen genomförd studie skador på den vita substansen hos patienter med naMCI även i precuneus (O’Dwyer et al., 2011), som är ett viktigt nav som upprätthåller informationsöverföringen mellan gyrus parahippocampus och prefrontal cortex (Vincent et al., 2006) och som spelar en viktig roll i minnesprocessen och den visuella föreställningen.
Av de neuropsykologiska testerna skiljde sig MMSE inte åt mellan undersökningsgrupperna, vilket troligen är en följd av uteslutningen av patienter med demenssjukdom. I delproven ACE totalt, ACE anterogradminne och ACE category fluency presterade aMCI-gruppen sämre i förhållande till naMCI-gruppen och den friska kontrollgruppen. I testet för retrograd minnesförmåga av ACE och i testet för spårbildning A och B presterade aMCI-gruppen endast sämre än de friska kontrollgrupperna, medan ingen skillnad upptäcktes mellan de två MCI-undergrupperna. Den försämrade prestationen på minnesuppgifterna (RAVLT och ACE retrograd minnesuppgift) i aMCI-gruppen korrelerade med den ökade involveringen av strukturer i temporalloben såsom entorhinal cortex och amygdala (figur 2), vilket ytterligare bekräftar våra resultat om skillnader mellan grupperna.
I uppgiften om bokstavsflytande presterade naMCI-gruppen sämre än den friska gruppen, medan aMCI-gruppen inte skilde sig från de andra grupperna. Trail making B-testet är ett index för visuell uppmärksamhet och uppgiftsväxling. De båda MCI-gruppernas försämrade prestationer i förhållande till kontrollerna (tabell 3) är sannolikt ett resultat av frontal involvering. Både kategori- och bokstavsflödesuppgifter är starkt beroende av frontallobens funktion, inklusive exekutiva processer som kräver att försökspersonerna organiserar hämtning, övervakar svar som tidigare återkallats, initierar verbala svar och hämmar svar som inte passar in i kriterierna (Henry et al., 2004). ”Båda måtten ger också tillgång till semantiska minneslager, en funktion av temporalloben; även om bokstavsflytande tycks utnyttja denna förmåga kopplad till temporalloben i mindre utsträckning än kategoriflytande” (Lezak et al., 2004). Studier av lesioner och funktionell hjärnavbildning stöder också att temporalloben och frontalloben är involverade i förmågan till flödesspridning. Tidigare fMRI-studier visade att brevflytande är förknippat med ökad aktivering i frontalloberna, medan både frontal- och temporalloberna är aktiva under kategoriflytande (Birn et al., 2010). Detta stämmer väl överens med våra resultat att aMCI skiljer sig signifikant beroende på kategoriflödighet i jämförelse med friska och naMCI-gruppen, medan det inte finns någon signifikant skillnad mellan de två undergrupperna i bokstavsflödighetsresultatet.
Stränga korrelationer hittades mellan verbala och visuella minnesfunktioner som indexeras av RAVLT- och PAL-testerna och volymerna och kortikaltjockleken hos de temporala strukturerna, t.ex. den entorneala cortexen (tabell 4), i hela urvalet och även i aMCI-gruppen (figur 2). Dessa resultat korsvaliderar användbarheten av dessa neuropsykologiska och MRI-markörer vid tidig diagnos av patologisk kognitiv nedgång och vid övervakning av sjukdomens utveckling.
Begränsningar
En begränsning av studien är att majoriteten av försökspersonerna i aMCI-gruppen var av flerdomänstyp, eftersom deras prestationer i exekutiva funktioner, bedömda med hjälp av trail making-testet B och ACE, var under det normala intervallet. Denna begränsning tillsammans med det faktum att naMCI är en mer heterogen enhet i förhållande till aMCI kan förklara varför den aktuella studien inte kunde hitta CNS strukturer med minskad storlek i naMCI gruppen i förhållande till aMCI gruppen.
Slutsatser
Namngivandet av aMCI och naMCI är inte bara teoretiskt, utan dessa undertyper är olika enheter både ur neuropsykologisk och hjärnstrukturell synvinkel. Utvecklingen av specifika MRT- och neuropsykologiska kriterier för de olika subtyperna av mild kognitiv nedsättning kommer sedan att göra det möjligt att bedöma bestämningsfaktorerna och prevalensen av MCI-subtyperna.
Den tilldelningen av MCI-subtyper kommer att vara användbar för att förbättra förutsägelsen av demenstypen och risken för konvertering till demens. Dessutom kan tilldelningen av MCI-subtyper ge ett bättre tillvägagångssätt för att testa effekten av terapeutiska alternativ för att förhindra omvandling till neurokognitiva störningar. Baserat på våra resultat kan MRI vara ett användbart verktyg för en mer exakt separation mellan MCI-subtyper.
Författarens bidrag
GC utformade studien, skrev protokollet, genomförde den statistiska analysen, skapade figurerna och skrev det första utkastet till manuskriptet ES deltog i utförandet av mätningar, skötte litteratursökningarna och -analyserna och skrev det första utkastet till inledningen och slutsatsen. ÁS bidrog till slutförandet av alla delar av manuskriptet. ZF, AH deltog i genomförandet av mätningar och bidrog till skrivandet av metodavsnittet. ÉC, PS, ZH, GR övervakade experimenten under studien, inklusive skrivandet av manuskriptet. Alla författare bidrog till och har godkänt det slutliga manuskriptet.
Finansiering
Studien stöddes av ”Ambient Assisted Living Joint Programme (AAL)-Call 2”-bidraget (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). Diagnosen mild kognitiv nedsättning på grund av Alzheimers sjukdom: rekommendationer från National Institute on Aging-Alzheimer’s Association arbetsgrupper om diagnostiska riktlinjer för Alzheimers sjukdom. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validering av den tyska reviderade Addenbrookes kognitiva undersökning för att upptäcka mild kognitiv nedsättning, mild demens vid Alzheimers sjukdom och frontotemporal lobär degeneration. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neurala system som stöder lexikalisk sökning styrd av bokstavs- och semantiska kategorier: En fMRI-studie av verbal förmåga att svara på självtempo med öppet svar. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A. och Angermeyer, M. C. (2002). Lindrig kognitiv funktionsnedsättning – en översyn av prevalens, incidens och resultat enligt nuvarande metoder. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Neuropatologisk stadieindelning av Alzheimerrelaterade förändringar. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identifiering av kognitivt friska äldre personer med efterföljande minnesförsämring med hjälp av automatiserade MR temporoparietala volymer. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B. och Sereno, M. I. (1999). Kortikal ytbaserad analys. I. Segmentering och rekonstruktion av ytor. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automatiserade MRI-mått identifierar individer med mild kognitiv nedsättning och Alzheimers sjukdom. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Mätning av tjockleken på den mänskliga hjärnbarken från magnetresonansbilder. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sekvensoberoende segmentering av magnetresonansbilder. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I. och Dale, A. M. (1999a). Kortikal ytbaserad analys. II: Inflation, utjämning och ett ytbaserat koordinatsystem. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B. och Dale, A. M. (1999b). Högupplöst intersubjektmedelvärdering och ett koordinatsystem för den kortikala ytan. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C. och DeKosky, S. T. (2004). Mild kognitiv nedsättning, amnestisk typ: en epidemiologisk studie. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P. och Goldberg, T. E. (2011). Användbarhet av kombinationer av biomarkörer, kognitiva markörer och riskfaktorer för att förutsäga omvandling från mild kognitiv försämring till Alzheimers sjukdom hos patienter i Alzheimer’s disease neuroimaging initiative. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld cognitive impairment can be distinguished from alzheimer disease and normal aging for clinical trials. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Prediktiv validitet och diagnostisk stabilitet hos subtyper av mild kognitiv funktionsnedsättning. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K. och Minthon, L. (2006). Samband mellan biomarkörer i CSF och begynnande Alzheimers sjukdom hos patienter med mild kognitiv nedsättning: en uppföljningsstudie. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R. och Phillips, L. H. (2004). Verbal fluency performance in dementia of the Alzheimer’s type: a meta-analysis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Användning av strukturell magnetisk resonansavbildning för att förutsäga vem som kommer att få Alzheimers sjukdom. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidens och resultat av mild kognitiv funktionsnedsättning i en befolkningsbaserad prospektiv kohort. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J. och Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W. och Hodges, J. R. (2000). Ett kort kognitivt testbatteri för att skilja Alzheimers sjukdom från frontotemporal demens. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). Biomarkörer i CSF och begynnande Alzheimers sjukdom hos patienter med mild kognitiv nedsättning. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimers sjukdom: kvantitativ strukturell neuroimaging för upptäckt och förutsägelse av kliniska och strukturella förändringar vid mild kognitiv nedsättning. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI-omvandling till demens och APOE-genotypen: en prediktionsstudie med FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Flera spridningsindex identifierar skador på vit substans vid mild kognitiv nedsättning och Alzheimers sjukdom. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Mild kognitiv nedsättning som en diagnostisk enhet. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Lindrig kognitiv nedsättning: en översikt. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Mild kognitiv nedsättning: klinisk karakterisering och resultat. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L. och DeKosky, S. T. (2001). Practice parameter: Early detection of dementia: mild cognitive impairment (an evidence-based review). Rapport från underkommittén för kvalitetsstandarder vid American Academy of Neurology. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Förhållandet mellan testet för spårbildning och organisk hjärnskada. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Mycket noggrann invers konsekvent registrering: ett robust tillvägagångssätt. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). En hybridmetod för att lösa problemet med skallestrippning vid MRT. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Mild kognitiv nedsättning: samma identitet för olika enheter. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Övervakning av tidiga tecken på kognitiv nedgång hos äldre genom datorspel: en MRI-studie. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R. och Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). ”Mini Mental State Examination (MMSE)”, i Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A och B: normativa data stratifierade efter ålder och utbildning. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Koherent spontan aktivitet identifierar ett hippocampal-parietalt minnesnätverk. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatric depression scale. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Grå substansatrofi i basala framhjärnan och hippocampus vid lindrig kognitiv nedsättning. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar