- Introducción
- Métodos
- Declaración ética
- Participantes
- Adquisición y procesamiento de imágenes de RM
- Procedimientos
- Análisis estadístico
- Resultados
- Diferencias en los volúmenes corticales, el grosor cortical y el rendimiento cognitivo entre los sujetos con amci, namci y los controles
- Análisis correlacionales
- Discusión
- Limitaciones
- Conclusiones
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
Introducción
Los principales trastornos neurocognitivos (NCD) o la demencia, incluida la enfermedad de Alzheimer (EA), son un problema devastador de nuestra sociedad que envejece y que tiene una enorme carga social, económica y médica. Dado que por el momento no disponemos de un tratamiento eficaz para las ENC, las investigaciones recientes se han centrado en la detección de los primeros síntomas. Las pruebas convergentes de muchos estudios recientes revelan que el proceso patológico de la EA comienza décadas antes de los primeros síntomas de deterioro cognitivo (Mattsson et al., 2009). La etapa intermedia entre el deterioro cognitivo esperado en el envejecimiento fisiológico y el deterioro grave de la demencia, conocida como «deterioro cognitivo leve» (DCL), ha suscitado un gran interés. «En el DCL el deterioro leve de las habilidades cognitivas puede ser revelado por las pruebas neuropsicológicas, mientras que las funciones cognitivas globales y las actividades cotidianas están preservadas» (Petersen, 2004). La mayor tasa de conversión a ECM en el DCL da cuenta de la importancia clínica de esta condición previa a la enfermedad. La tasa de conversión a ECM es del 10-15% anual en el DCL, en comparación con la tasa anual del 1-4% en la población media de ancianos (Petersen et al., 2001; Bischkopf et al., 2002). La mayoría de estos pacientes desarrollan EA clínica. Hay que tener en cuenta que el DCL puede ser también una condición estable o inversa que no progresa hacia la demencia. Los estudios epidemiológicos longitudinales informaron de una tasa de conversión variante y una reversión relativamente frecuente a la cognición normal (Larrieu et al., 2002; Ganguli et al., 2004). Diferentes hallazgos sugieren inestabilidad en la precisión del diagnóstico y la necesidad de una identificación más específica entre los pacientes con DCL (Han et al., 2012). En vista de lo anterior, es comprensible que varios estudios se centren en los síntomas y las diferencias con respecto a la población media que están estrechamente relacionados con el desarrollo de la demencia y, por lo tanto, pueden utilizarse para ayudar al diagnóstico precoz.
Los pacientes con DCL pueden clasificarse además en DCL amnésico (aMCI) y DCL no amnésico (naMCI). En el DCLa la pérdida de memoria es predominante y se asocia con un alto riesgo de conversión a EA (Grundman, 2004). Los individuos con DCLn tienen alteraciones en otros ámbitos además de la memoria y tienen un mayor riesgo de convertirse en otras formas de demencia, como la demencia difusa de cuerpos de Lewy. Ambos tipos pueden clasificarse en subtipos de dominio único y multidominio; sin embargo, en la presente investigación no se realizó ninguna otra categorización debido al tamaño limitado de la muestra. Se han probado tipos significativos de biomarcadores de DCL con el objetivo de identificar las características especiales de los pacientes que se convierten en EA. Mientras que los resultados de los biomarcadores del líquido cefalorraquídeo (Hansson et al., 2006) y los estudios de tomografía por emisión de positrones (Mosconi et al., 2004) señalaron una especificidad y una sensibilidad muy variadas, los estudios de resonancia magnética estructural revelaron resultados impresionantes (Jack et al., 1999; deToledo-Morrell et al., 2004). Curiosamente, varios estudios anteriores investigaron las diferencias entre los sujetos con DCL y los controles sanos, sólo unos pocos estudios trataron de diferenciar entre los subtipos de DCL (Zhang et al., 2011; Serra et al., 2013).
Aunque el aMCI y el naMCI son entidades teóricamente diferentes, sólo unas pocas investigaciones estudiaron las diferencias estructurales del cerebro entre estos subtipos de DCL (Serra et al., 2013). El objetivo del estudio fue encontrar las diferencias estructurales entre el DCL y el DCLn, y replicar los hallazgos previos sobre la diferenciación entre el DCL y los controles sanos. Basándonos en estudios previos sobre DCL y conversión a demencia nos centramos en las estructuras del lóbulo temporal y las regiones vecinas (Chiang et al., 2011): la corteza entorrinal, el hipocampo, la corteza parahipocampal, la amígdala, la circunvolución fusiforme, el precuneus, la corteza cingulada posterior y el istmo de la circunvolución cingulada.
Métodos
Este estudio es una continuación de nuestro trabajo publicado anteriormente (Sirály et al., 2015). Dado que en el presente estudio se ha utilizado una batería de pruebas neuropsicológicas similar, así como la misma línea de adquisición y procesamiento de imágenes por resonancia magnética, los métodos y procedimientos se han descrito de forma similar en ambos trabajos.
Declaración ética
Los experimentos se llevaron a cabo en pleno cumplimiento de la Declaración de Helsinki y de todas las directrices éticas nacionales e internacionales pertinentes. La investigación fue aprobada por el Comité Nacional de Ética de Budapest, Hungría. Todos los procedimientos se llevaron a cabo sólo después de obtener el consentimiento informado por escrito de los participantes. Todos los participantes potenciales que se negaron a participar o no lo hicieron no se vieron perjudicados de ninguna manera por no participar en el estudio.
Participantes
El estudio se llevó a cabo en el Departamento de Psiquiatría y Psicoterapia de la Universidad Semmelweis de Budapest. En total se inscribieron 62 sujetos en el estudio. Todos los sujetos solicitaron participar en un programa de entrenamiento cognitivo anunciado entre los médicos de cabecera y en una Residencia de Ancianos (El estudio está registrado en ClinicalTrials.gov, el identificador es «NCT02310620»). Todos los sujetos eran capaces de llevar una vida independiente. Los datos demográficos y neuropsicológicos básicos se resumen en la Tabla 1.

Tabla 1. Datos demográficos y resultado de las pruebas neuropsicológicas básicas.
Los sujetos con aMCI y naMCI, y los controles sanos se incluyeron en el estudio basándose en los criterios de Petersen (Petersen, 2004). Los criterios de Petersen incluyen la queja subjetiva de memoria corroborada por un informante junto con actividades cotidianas preservadas, un deterioro de la memoria basado en una prueba neuropsicológica estándar, funciones cognitivas globales preservadas y, finalmente, la exclusión de la demencia. No especifica una prueba neuropsicológica para la evaluación de las alteraciones de la memoria, por lo que se aplicó el Test de Aprendizaje Verbal Auditivo de Rey (RAVLT), que es la prueba más utilizada en base a la literatura (Gomar et al., 2011). Para la diferenciación entre aMCI y controles sanos aplicamos una puntuación de corte de 1 SD bajo la media de la población estandarizada para la edad y el género. Los participantes que obtuvieron una puntuación por debajo del valor de corte, ya sea en la subpuntuación de recuerdo retardado o en la puntuación total, se incluyeron en el grupo de DME. Los criterios aplicados se basan en las recomendaciones de los grupos de trabajo del National Institute on Aging-Alzheimer’s Association sobre las directrices de diagnóstico de la enfermedad de Alzheimer (Albert et al., 2011). Las puntuaciones exactas de corte de la RAVLT para los diferentes grupos de edad se proporcionan en la Tabla 2A. Los sujetos que no estaban en el grupo aMCI, pero que obtuvieron una puntuación de 1 SD por debajo de la media de la población estandarizada para la edad y el género/educación, ya sea en el Trail making Test B o en el Addenbrooke’s Cognitive Examination (ACE), fueron puestos en el grupo naMCI. Un criterio adicional para el grupo de naMCI fue una proporción de VLOM (fluidez verbal + puntuación de lenguaje/orientación + puntuación de memoria) inferior a 3,2 en el ACE para excluir a los posibles sujetos con aMCI del grupo de naMCI (estos sujetos fueron excluidos del estudio).

Tabla 2. (A). Prueba de Aprendizaje Verbal Auditivo de Rey (RAVLT): datos normativos y puntuaciones de corte para el Deterioro Cognitivo Leve (DCL) ajustadas por edad; (B) Mini Examen Mental (MMSE): puntuaciones de corte para la demencia ajustadas por edad y educación.
Los sujetos con demencia fueron excluidos del estudio según las puntuaciones del Mini Examen Mental (MMSE) estandarizadas por edad y educación (Strauss et al., 2006b). Las puntuaciones exactas de corte para el MMSE en los diferentes grupos de edad y educación se proporcionan en la Tabla 2B. También se excluyeron del estudio los sujetos con antecedentes de traumatismo craneoencefálico, epilepsia o accidente cerebrovascular, o con diagnóstico de trastorno psiquiátrico agudo, esquizofrenia o manía, o dependencia del alcohol.
Adquisición y procesamiento de imágenes de RM
Todos los sujetos fueron examinados mediante RM cerebral produciendo imágenes estructurales de alta resolución, que se utilizaron para su posterior procesamiento y análisis. Las adquisiciones de imágenes se realizaron en el Centro de Investigación de RM de la Universidad Semmelweis de Budapest en un escáner de RM clínica Philips Achieva de 3 Tesla equipado con una bobina de cabeza SENSE de ocho canales. Las imágenes anatómicas de alta resolución de todo el cerebro se obtuvieron utilizando una secuencia de eco de gradiente tridimensional ponderada en T1 (T1W 3D TFE). Se adquirieron 180 cortes contiguos de cada sujeto con los siguientes parámetros de imagen: TR = 9,7 ms; TE = 4,6 ms; flip angle = 8°; FOV de 240 × 240 mm; tamaño de voxel de 1,0 × 1,0 × 1,0 mm.
La reconstrucción cortical y la segmentación volumétrica se realizaron con la suite de análisis de imágenes Freesurfer 5.3, que está documentada y disponible gratuitamente para su descarga en línea (http://surfer.nmr.mgh.harvard.edu/). Los detalles técnicos de estos procedimientos se describen en publicaciones anteriores, no hicimos ningún cambio en esta tubería. Brevemente, el procesamiento de imágenes incluye la corrección del movimiento (Reuter et al., 2010), la eliminación del tejido no cerebral utilizando un procedimiento híbrido de cuenca/deformación de la superficie (Segonne et al., 2004), la transformación automatizada de Talairach, la segmentación de la materia blanca subcortical, y las estructuras volumétricas de la materia gris profunda (incluyendo el hipocampo, la amígdala, el caudado, el putamen, los ventrículos) (Fischl et al., 2004), la normalización de la intensidad, la teselación de los límites de la materia gris y la materia blanca, la corrección topológica automatizada y la deformación de la superficie siguiendo los gradientes de intensidad para situar de forma óptima los límites gris/blanco y gris/líquido cefalorraquídeo en el lugar en el que el mayor cambio de intensidad define la transición a la otra clase de tejido (Dale et al., 1999; Fischl y Dale, 2000). Una vez completados los modelos corticales, Freesurfer llevó a cabo una serie de procedimientos deformables para el posterior procesamiento y análisis de los datos. Los pasos incluían el inflado de la superficie (Fischl et al., 1999a), el registro en un atlas esférico que utilizaba patrones de plegado cortical individuales para hacer coincidir la geometría cortical entre los sujetos (Fischl et al., 1999b), la parcelación de la corteza cerebral en unidades basadas en la estructura giral y sulcal (Fischl et al., 2004), y la creación de una variedad de datos basados en la superficie, incluyendo mapas de curvatura y profundidad sulcal. Por último, los modelos corticales y los resultados de la segmentación se comprobaron en cuanto a la calidad y se corrigieron manualmente en cada sujeto; sin embargo, la corrección no mostró cambios significativos en los resultados.
Procedimientos
Los exámenes neuropsicológicos se llevaron a cabo los días laborables entre las 8 y las 16 horas. Las pruebas se realizaron en una sala separada y bien iluminada en la que sólo estaban presentes el paciente y un examinador. Las pruebas de referencia también se completaron y evaluaron según las recomendaciones del Compendio Neuropsicológico (Strauss et al., 2006a), mientras que las pruebas informatizadas fueron evaluadas por el software.
Las pruebas neuropsicológicas fueron administradas por dos estudiantes de medicina previamente formados bajo la supervisión de un psicólogo y un psiquiatra. Durante la evaluación de las pruebas se siguieron las directrices del Compendio Neuropsicológico (Strauss et al., 2006a). Las pruebas basadas en papel fueron evaluadas por el mismo psicólogo y un psiquiatra de acuerdo con el compendio. Las pruebas de aprendizaje por parejas (PAL) fueron evaluadas automáticamente por un software. Los datos de RM también fueron analizados y evaluados automáticamente por el software Freesurfer y SAS; por lo tanto, no hubo juicios subjetivos en el análisis de los datos de neuroimagen. Dado que la valoración y la evaluación de la prueba PAL y de los datos de neuroimagen fueron totalmente automáticas, el sesgo de los juicios humanos fue bajo (limitado únicamente a la evaluación de las pruebas en papel).
Los sujetos con demencia fueron excluidos del estudio en función del Mini Mental State Examination (MMSE). El MMSE es una prueba estándar; su eficacia fue demostrada por varios estudios, como un método útil para diferenciar entre sujetos con demencia y controles sanos (Petersen et al., 1999; Gomar et al., 2011). La mayoría de los estudios anteriores utilizaron la puntuación de corte de 26 o la puntuación ajustada por edad para la demencia. Las subtareas de la prueba evalúan la orientación, la función ejecutiva central, la formación de asociaciones rápidas, la capacidad de identificación verbal y la capacidad de análisis y síntesis.
El Examen Cognitivo de Addenbrooke se utilizó para evaluar el rendimiento cognitivo global, incluyendo la orientación, la atención, la memoria, la fluidez verbal y las habilidades visoespaciales (Mathuranath et al, 2000; Alexopoulos et al., 2010).
El Test de Aprendizaje Verbal Auditivo de Rey se utilizó para la evaluación detallada de las funciones de la memoria según los criterios de Petersen. El test de Rey evalúa el aprendizaje verbal y la memoria (Rey, 1958). El sujeto debe repetir inmediatamente una lista de 15 palabras (lista A). Esta prueba se repite 5 veces. A continuación, se presenta una vez otra lista de 15 palabras (lista B o lista de interferencia) que debe ser recordada. A continuación, la lista A debe ser recordada sin repetirse, y luego esta tarea se repite después de 30 minutos.
La prueba de creación de rastros, parte A y parte B (conexión de números; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) se utiliza para evaluar la atención selectiva, las funciones ejecutivas y la flexibilidad cognitiva. En la parte A, los números distribuidos al azar deben conectarse en orden numérico, mientras que en la parte B se muestran números y letras distribuidos al azar. Al sujeto se le indica que conecte los números y las letras en un orden predefinido. La variable dependiente es el tiempo necesario para completar la prueba. La parte A del TMT mide las funciones ejecutivas y la atención, mientras que en el rendimiento en la parte B también se refleja la flexibilidad cognitiva.
Los resultados de las pruebas neuropsicológicas se resumen en la Tabla 1.
Todos los participantes rellenaron un formulario en el que evaluaban su propio estado de salud y la función de la memoria; además, tenían que informar sobre su uso del ordenador y de Internet, las actividades recreativas, el consumo de alcohol, los hábitos alimenticios y el tabaquismo (Yesavage, 1988). Se utilizó la Escala de Depresión Geriátrica (GDS) para evaluar los síntomas depresivos, mientras que los síntomas de ansiedad se midieron con el Inventario de Ansiedad Estado-Rasgo de Spielberger (STAI; Spielberger et al., 1970).
La memoria visoespacial se midió mediante una implementación de la prueba PAL utilizada en varias baterías de pruebas neuropsicológicas (Siraly et al., 2013). «En la prueba PAL se abren ventanas en posiciones aleatorias en la pantalla una tras otra durante 3 s con formas abstractas mostradas en una o más ventanas. Otras ventanas permanecen en blanco dependiendo del nivel de dificultad. Cuando se muestran todos los cuadrados, las formas mostradas anteriormente aparecen en el centro de la pantalla y los participantes tienen que decidir en qué ventana vieron esa forma antes. La prueba consta de cinco niveles diferentes en ocho etapas en total, el número de formas aumenta de 1 a 8 en las diferentes etapas. Los sujetos tenían 10 ensayos para completar una etapa determinada, de lo contrario la prueba terminaba. La disposición de las ventanas era asimétrica en la prueba y cambiaba de una etapa a otra». (Siraly et al., 2013) Durante la prueba informatizada los sujetos estaban sentados cómodamente a una distancia de medio metro de la pantalla del ordenador y siguiendo la información previa resolvían las tareas con el uso de un ratón.
Análisis estadístico
Las diferencias entre los grupos de estudio en los volúmenes cerebrales, el grosor cortical y el rendimiento cognitivo se analizaron mediante un Análisis de Modelo Lineal General (GLM en SAS 9.2) con la edad y el género como covariables. Los volúmenes se estandarizaron para el volumen intracraneal total (VIT), y se dan en porcentaje. Para analizar las diferencias entre grupos se aplicaron comparaciones t post hoc, donde los valores p se ajustaron a 0,05/3 = 0,016, donde tres representa el número de comparaciones entre grupos.
La relación entre los resultados de las pruebas neuropsicológicas y el tamaño de las estructuras del SNC se analizó mediante correlaciones de Pearson. Las correlaciones con el número de etapas completadas en la prueba PAL se analizaron mediante la correlación de Spearman, ya que la distribución de esta variable se desviaba en gran medida de la distribución normal.
Resultados
Diferencias en los volúmenes corticales, el grosor cortical y el rendimiento cognitivo entre los sujetos con amci, namci y los controles
Se encontró una diferencia significativa en el volumen del hipocampo y en el volumen de la corteza entorrinal entre los grupos de estudio . Las pruebas post hoc mostraron que los volúmenes están significativamente disminuidos en el grupo aMCI en relación con los controles y con el grupo naMCI, mientras que los otros dos grupos no difirieron significativamente (Tabla 3 y Figura 1) Entre las covariables, el género tuvo un efecto significativo en el volumen del hipocampo, los sujetos masculinos tuvieron un tamaño del hipocampo significativamente disminuido en relación con las mujeres.
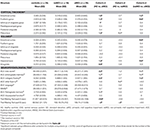
Tabla 3. Diferencias de las estructuras del SNC y de los resultados de las pruebas neuropsicológicas entre los grupos de estudio.
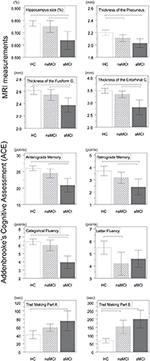
Figura 1. Diferencias entre grupos en estructuras del SNC y pruebas neuropsicológicas. Las barras verticales representan las medias de los grupos, mientras que las barras de error representan las desviaciones estándar. Las líneas horizontales sobre las barras verticales indican diferencias significativas entre grupos tras la corrección por comparaciones múltiples (p < 0,016). HC: controles sanos; aMCI: deterioro cognitivo leve amnésico; naMCI: deterioro cognitivo leve no amnésico; SNC: sistema nervioso central.
El grosor medio de la corteza entorrinal, la circunvolución fusiforme, el istmo de la circunvolución cingulada y el precuneus también difieren significativamente entre los grupos de estudio. De acuerdo con las pruebas post-hoc, se encontró una disminución del grosor cortical en el aMCI en relación con los controles en las cuatro estructuras, mientras que el grosor de la corteza entorrinal y el giro fusiforme también se redujo significativamente en el grupo aMCI en relación con el grupo naMCI. Las medias de los grupos, los resultados de las pruebas post-hoc y las diferencias entre grupos en términos de d de Cohen se resumen en la Tabla 3.
Hubo una diferencia significativa entre los grupos de estudio en la memoria anterógrada , la memoria retrógrada , la fluidez categórica . En la memoria anterógrada y en la fluidez categórica, tanto el grupo de control como el grupo naMCI superaron al grupo aMCI, mientras que los primeros grupos no difirieron significativamente (Tabla 3). En la memoria retrógrada, los controles superaron al grupo aMCI, pero no al grupo naMCI. En cuanto a la fluidez de las letras, los controles superaron al grupo naMCI, pero no al grupo aMCI, mientras que los dos grupos MCI no se diferenciaron entre sí (p > 0,05). Además, en la fluidez categórica los sujetos femeninos obtuvieron mejores resultados que los masculinos, mientras que la edad no tuvo un efecto significativo en el rendimiento.
Análisis correlacionales
En toda la muestra se encontraron fuertes correlaciones entre los resultados de las pruebas neuropsicológicas y el volumen y el grosor de las estructuras cerebrales temporales (Tabla 4).

Tabla 4. Correlaciones entre las estructuras del SNC y los resultados de las pruebas neuropsicológicas en toda la muestra.
En el grupo aMCI el resultado del Test de Aprendizaje Verbal de Rey mostró una correlación positiva significativa con el tamaño de la amígdala (r = 0,47, n = 20, p = 0,03), y el grosor de la corteza entorrinal (r = 0,46, n = 20, p = 0,04; Figura 2). Los sujetos con volúmenes de amígdala y grosor entorrinal disminuidos mostraron un peor rendimiento en la prueba de memoria.

Figura 2. Correlación entre el rendimiento de la memoria a corto plazo, indexado por la prueba de aprendizaje verbal de Rey, y el volumen de la amígdala y el grosor de la corteza entorrinal en los grupos de estudio. Las correlaciones de Pearson fueron significativas (p < 0,05) en el grupo de DCL amnésico y en toda la muestra, mientras que no fueron significativas en los grupos de control y de DCL no amnésico. Línea roja, línea de regresión en el grupo con DCL amnésico; línea discontinua, línea de regresión en toda la muestra; DCL, deterioro cognitivo leve; r y p, coeficiente de correlación de Pearson ajustado por edad y nivel de significación correspondiente en el grupo con DCL amnésico.
Además, los sujetos con volúmenes entorrinales disminuidos (r = 0,49, n = 19, p = 0,03), y volúmenes del giro fusiforme disminuidos (r = 0,48, n = 19, p = 0,04) y el grosor cortical fusiforme (r = 0.53, n = 19, p = 0,02) tuvieron un desempeño más débil en la subprueba de memoria retrógrada del ACE.
Discusión
El DCL amnésico y el no amnésico fueron asignados como pródromos potenciales a diferentes tipos de ECM. Se supone que los sujetos con deterioro cognitivo leve amnésico tienen un mayor riesgo de convertirse en demencia de Alzheimer, mientras que se dice que los sujetos con deterioro cognitivo leve no amnésico tienen un mayor riesgo de convertirse en demencia no de Alzheimer (Petersen et al, 1999; Killiany et al., 2000; Petersen y Negash, 2008).
Las diferencias estructurales del cerebro se examinaron mediante RMN en los subgrupos con DCL y en el grupo de control sano, mientras que las diferencias en el rendimiento cognitivo se investigaron mediante pruebas neuropsicológicas. Según los resultados de la IRM, el grosor de la corteza entorrinal, la circunvolución fusiforme, el istmo de la circunvolución cingular y el precuneus, y el volumen de la amígdala y el hipocampo estaban disminuidos en el DCL en relación con los controles sanos. Estos resultados están en consonancia con estudios anteriores que informan de que los sujetos sanos, los pacientes con DCL o la enfermedad de Alzheimer pueden diferenciarse entre sí en función de los volúmenes de las estructuras del lóbulo temporal, como la amígdala o el hipocampo (Desikan et al, 2009; McEvoy et al., 2009).
Los volúmenes del hipocampo y de la corteza entorrinal, y el grosor de la corteza entorrinal y de la circunvolución fusiforme están significativamente disminuidos en el grupo aMCI en relación con el grupo naMCI. La mayor diferencia entre grupos se detectó en el volumen y el grosor de la corteza entorrinal (0,9 y 1,2 DE, respectivamente), lo que concuerda con el hecho de que la atrofia en la EA comienza en esta región. Estos resultados muestran que existen diferencias estructurales tempranas entre los subtipos de DCL. Además, el patrón de estos hallazgos estructurales se ajusta a la patología de la enfermedad de Alzheimer (Braak y Braak, 1991), lo que subraya los resultados anteriores de que el DCLa progresa hacia la enfermedad de Alzheimer con una frecuencia mayor en relación con el DCLa (Killiany et al., 2000; Petersen y Negash, 2008).
Comparando el grupo de control y el de DCLa, sólo se encontró una diferencia significativa en el grosor del precuneus, que estaba disminuido en el grupo de DCLa. Curiosamente, un estudio reciente encontró lesiones de la materia blanca en pacientes con naMCI también en el precuneus (O’Dwyer et al., 2011), que es un importante centro que sostiene la transferencia de información entre la circunvolución parahipocampal y la corteza prefrontal (Vincent et al., 2006) y juega un papel importante en el proceso de la memoria y el imaginario visual.
Entre las pruebas neuropsicológicas, el MMSE no difirió entre los grupos de estudio, lo que es una consecuencia probable de la exclusión de los pacientes con demencia. En las subpruebas ACE total, ACE de memoria anterógrada y ACE de fluidez de categorías, el grupo aMCI obtuvo peores resultados en relación con el grupo naMCI y el grupo de control sano. En la prueba de memoria retrógrada de la ACE y en las pruebas de Trail Making A y B el grupo aMCI sólo obtuvo peores resultados que los controles sanos, mientras que no se detectaron diferencias entre los dos subgrupos de DCL. El menor rendimiento en las tareas de memoria (RAVLT y tarea de memoria retrógrada de la ACE) en el grupo aMCI se correlacionó con la mayor afectación de estructuras del lóbulo temporal como el córtex entorrinal, y la amígdala (Figura 2), lo que confirma aún más nuestros resultados sobre las diferencias entre grupos.
En la tarea de fluidez de letras el grupo naMCI tuvo un peor rendimiento que el grupo sano, mientras que el aMCI no se diferenció de los otros grupos. La prueba de creación de rastros B es un índice de atención visual y cambio de tareas. El menor rendimiento de ambos grupos con DCL en relación con los controles (Tabla 3) es probablemente el resultado de la afectación frontal. Tanto las tareas de categoría como las de fluidez de letras dependen en gran medida del funcionamiento del lóbulo frontal, incluidos los procesos ejecutivos que requieren que los sujetos organicen la recuperación, supervisen las respuestas recordadas previamente, inicien respuestas verbales e inhiban las respuestas que no se ajustan a los criterios (Henry et al., 2004). «Ambas medidas también acceden a los almacenes de memoria semántica, una función del lóbulo temporal; aunque la fluidez de letras parece aprovechar esta capacidad vinculada al lóbulo temporal en menor medida que la fluidez de categorías» (Lezak et al., 2004). Los estudios sobre lesiones e imágenes cerebrales funcionales también apoyan la implicación de los lóbulos temporal y frontal en la capacidad de fluidez. Estudios anteriores de IRMf mostraron que la fluidez de las letras está asociada con una mayor activación en los lóbulos frontales, mientras que tanto los lóbulos frontales como los temporales están activos durante la fluidez de las categorías (Birn et al., 2010). Esto se corresponde bien con nuestros hallazgos de que el aMCI difiere significativamente según la fluidez de la categoría en comparación con el grupo sano y el naMCI, mientras que no hay diferencias significativas entre los dos subgrupos en el resultado de la fluidez de las letras.
Se encontraron fuertes correlaciones entre las funciones de la memoria verbal y visual indexadas por el RAVLT y las pruebas PAL, y los volúmenes y el grosor cortical de las estructuras temporales como la corteza entorrinal (Tabla 4) en toda la muestra y también en el grupo aMCI (Figura 2). Estos hallazgos validan de forma cruzada la utilidad de estos marcadores neuropsicológicos y de RMN en el diagnóstico precoz del deterioro cognitivo patológico y en el seguimiento de la progresión de la enfermedad.
Limitaciones
Una limitación del estudio es que la mayoría de los sujetos del grupo de aMCI eran de tipo multidominio, ya que su rendimiento en las funciones ejecutivas evaluadas por el test de creación de senderos B y el ACE estaban por debajo del rango normal. Esta limitación, junto con el hecho de que la ECMN es una entidad más heterogénea en relación con la ECMa, puede explicar por qué el presente estudio no fue capaz de encontrar estructuras del SNC con un tamaño disminuido en el grupo de la ECMN en relación con el grupo de la ECMa.
Conclusiones
La denominación de la ECMa y de la ECMN no es sólo teórica, sino que estos subtipos son entidades diferentes tanto desde el punto de vista neuropsicológico como desde el estructural del cerebro. El desarrollo de criterios específicos de IRM y neuropsicológicos para los diferentes subtipos de deterioro cognitivo leve permitirá entonces evaluar los determinantes y la prevalencia de los subtipos de DCL.
La asignación de subtipos de DCL será útil para mejorar la predicción del tipo de demencia y el riesgo de conversión a demencia. Además, la asignación de subtipos de DCL puede proporcionar un mejor enfoque para probar la eficacia de las opciones terapéuticas en la prevención de la conversión a trastornos neurocognitivos. En base a nuestros resultados la RM puede ser una herramienta útil para la separación más precisa entre los subtipos de DCL.
Contribuciones de los autores
GC diseñó el estudio, redactó el protocolo, realizó el análisis estadístico, creó las figuras y redactó el primer borrador del manuscrito ES participó en la realización de las mediciones, gestionó las búsquedas bibliográficas y los análisis, y redactó el primer borrador de la introducción y la conclusión. ÁS contribuyó a la finalización de todas las secciones del manuscrito. ZF, AH participó en la ejecución de las mediciones, y contribuyó a la redacción de la sección de métodos. ÉC, PS, ZH, GR dio la supervisión de los experimentos durante el estudio, incluida la redacción del manuscrito. Todos los autores contribuyeron y han aprobado el manuscrito final.
Financiación
El estudio fue apoyado por la subvención «Ambient Assisted Living Joint Programme (AAL)-Call 2» (Identificador de proyecto: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). El diagnóstico de deterioro cognitivo leve debido a la enfermedad de Alzheimer: recomendaciones de los grupos de trabajo del Instituto Nacional sobre el Envejecimiento-Asociación de Alzheimer sobre las directrices de diagnóstico de la enfermedad de Alzheimer. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validación del examen cognitivo alemán revisado de Addenbrooke para detectar el deterioro cognitivo leve, la demencia leve en la enfermedad de alzheimer y la degeneración lobar frontotemporal. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Sistemas neuronales que apoyan la búsqueda léxica guiada por claves de letras y categorías semánticas: un estudio de resonancia magnética funcional de la fluidez verbal a ritmo propio. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., y Angermeyer, M. C. (2002). Deterioro cognitivo leve: una revisión de la prevalencia, la incidencia y el resultado según los enfoques actuales. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., y Braak, E. (1991). Estadificación neuropatológica de los cambios relacionados con el Alzheimer. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identificación de los individuos de edad avanzada cognitivamente sanos con disminución de la memoria posterior mediante el uso de volúmenes temporoparietales de RM automatizados. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., y Sereno, M. I. (1999). Análisis basado en la superficie cortical. I. Segmentación y reconstrucción de superficies. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer’s disease. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., y Dale, A. M. (2000). Measuring the thickness of the human cerebral cortex from magnetic resonance images. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequence-independent segmentation of magnetic resonance images. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., y Dale, A. M. (1999a). Análisis basado en la superficie cortical. II: Inflación, aplanamiento y un sistema de coordenadas basado en la superficie. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., y Dale, A. M. (1999b). High-resolution intersubject averaging and a coordinate system for the cortical surface. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., y DeKosky, S. T. (2004). Mild cognitive impairment, amnestic type: an epidemiologic study. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., y Goldberg, T. E. (2011). Utilidad de las combinaciones de biomarcadores, marcadores cognitivos y factores de riesgo para predecir la conversión de deterioro cognitivo leve a enfermedad de Alzheimer en pacientes de la iniciativa de neuroimagen de la enfermedad de Alzheimer. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). El deterioro cognitivo leve se puede distinguir de la enfermedad de alzheimer y el envejecimiento normal para los ensayos clínicos. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Predictive validity and diagnostic stability of mild cognitive impairment subtypes. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., y Minthon, L. (2006). Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., y Phillips, L. H. (2004). Rendimiento de la fluidez verbal en la demencia de tipo Alzheimer: un meta-análisis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Use of structural magnetic resonance imaging to predict who will get Alzheimer’s disease. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidence and outcome of mild cognitive impairment in a population-based prospective cohort. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., y Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., y Hodges, J. R. (2000). A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkers and incipient Alzheimer disease in patients with mild cognitive impairment. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer disease: quantitative structural neuroimaging for detection and prediction of clinical and structural changes in mild cognitive impairment. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversion to dementia and the APOE genotype: a prediction study with FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Múltiples índices de difusión identifican el daño en la materia blanca en el deterioro cognitivo leve y la enfermedad de Alzheimer. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Deterioro cognitivo leve como entidad diagnóstica. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., y Negash, S. (2008). Deterioro cognitivo leve: una visión general. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., y Kokmen, E. (1999). Mild cognitive impairment: clinical characterization and outcome. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., y DeKosky, S. T. (2001). Parámetro de práctica: detección precoz de la demencia: deterioro cognitivo leve (una revisión basada en la evidencia). Informe del subcomité de estándares de calidad de la academia americana de neurología. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). La relación de la prueba de elaboración de rastros con el daño cerebral orgánico. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Registro consistente inverso de alta precisión: un enfoque robusto. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A hybrid approach to the skull stripping problem in MRI. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Deterioro cognitivo leve: la misma identidad para diferentes entidades. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Seguimiento de los primeros signos de deterioro cognitivo en los ancianos por los juegos de ordenador: un estudio de resonancia magnética. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., y Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., y Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., y Spreen, O. (eds.). (2006b). «Mini Mental State Examination (MMSE)», en Compendium of Neuropsychological Tests, 3rd Edn. (Nueva York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A y B: datos normativos estratificados por edad y educación. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). La actividad espontánea coherente identifica una red de memoria hipocampal-parietal. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Escala de depresión geriátrica. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Atrofia de la materia gris del cerebro anterior basal y el hipocampo en el deterioro cognitivo leve. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar