- Introduction
- Metody
- Oświadczenie etyczne
- Uczestnicy
- Pozyskiwanie i przetwarzanie obrazów MR
- Procedury
- Analiza statystyczna
- Wyniki
- Różnice w objętości korowej, grubości korowej i wynikach poznawczych między osobami z amci, namci i grupą kontrolną
- Analizy korelacyjne
- Dyskusja
- Ograniczenia
- Wnioski
- Wkład autorów
- Funding
- Oświadczenie o konflikcie interesów
Introduction
Major neurocognitive disorders (NCD) or dementia including Alzheimer’s disease (AD) are a devastating problem of our aging society having tremendous social, economic and medical burden. Ponieważ w chwili obecnej nie dysponujemy skutecznymi metodami leczenia chorób niezakaźnych, ostatnie badania skupiają się na wykrywaniu wczesnych objawów. Zbieżne dowody z wielu najnowszych badań wykazały, że proces patologiczny choroby Alzheimera rozpoczyna się dziesiątki lat przed wystąpieniem pierwszych objawów zaburzeń funkcji poznawczych (Mattsson i in., 2009). Dużym zainteresowaniem cieszy się etap pośredni między oczekiwanym pogorszeniem funkcji poznawczych w fizjologicznym starzeniu się a poważnym pogorszeniem w otępieniu, znany jako „łagodne zaburzenia poznawcze” (mild cognitive impairment – MCI). „W MCI łagodne pogorszenie zdolności poznawczych może być ujawnione przez testy neuropsychologiczne, podczas gdy globalne funkcje poznawcze i codzienne czynności są zachowane” (Petersen, 2004). Wyższy wskaźnik konwersji do NCD w MCI wskazuje na znaczenie kliniczne tego stanu przedchorobowego. Wskaźnik konwersji do NCD wynosi 10-15% rocznie w MCI w porównaniu do rocznego wskaźnika 1-4% w przeciętnej populacji osób starszych (Petersen i in., 2001; Bischkopf i in., 2002). U większości z tych pacjentów dochodzi do rozwoju klinicznego AD. Należy zaznaczyć, że MCI może być również stanem stabilnym lub odwrotnym, nie przechodzącym w otępienie. W podłużnych badaniach epidemiologicznych odnotowano wariantowy wskaźnik konwersji i stosunkowo częsty powrót do normalnego stanu poznawczego (Larrieu i in., 2002; Ganguli i in., 2004). Odmienne wyniki sugerują niestabilność dokładności diagnostycznej i potrzebę bardziej szczegółowej identyfikacji pacjentów z MCI (Han et al., 2012). W związku z powyższym zrozumiałe jest, że wiele badań ukierunkowanych jest na objawy i różnice w stosunku do przeciętnej populacji, które są ściśle związane z rozwojem otępienia, a zatem mogą być wykorzystane do pomocy we wczesnej diagnostyce.
Pacjentów z MCI można dalej podzielić na amnestyczne (aMCI) i nieamnestyczne MCI (naMCI). W aMCI dominuje utrata pamięci i jest ona związana z wysokim ryzykiem dalszej konwersji do AD (Grundman, 2004). Osoby z naMCI mają upośledzenie w innych domenach niż pamięć i są bardziej narażone na konwersję do innych form demencji, takich jak rozlane otępienie z ciałami Lewy’ego. Oba typy mogą być podzielone na podtypy jedno- i wielodomenowe, jednak w niniejszym badaniu nie dokonano dalszej kategoryzacji ze względu na ograniczoną liczebność próby. Znaczące rodzaje biomarkerów MCI były testowane w celu zidentyfikowania cech szczególnych pacjentów przechodzących w AD. Podczas gdy wyniki badań biomarkerów płynu mózgowo-rdzeniowego (Hansson i in., 2006) i pozytronowej tomografii emisyjnej (Mosconi i in., 2004) wskazywały na wysoce zróżnicowaną swoistość i czułość, badania strukturalnego rezonansu magnetycznego ujawniły imponujące wyniki (Jack i in., 1999; deToledo-Morrell i in., 2004). Co ciekawe, w kilku wcześniejszych badaniach badano różnice między osobami z MCI a zdrowymi kontrolami, tylko w nielicznych próbowano różnicować podtypy MCI (Zhang i wsp., 2011; Serra i wsp., 2013).
Pomimo że aMCI i naMCI są teoretycznie różnymi jednostkami, tylko w nielicznych badaniach badano strukturalne różnice mózgowe między tymi podtypami MCI (Serra i wsp., 2013). Celem pracy było znalezienie różnic strukturalnych pomiędzy aMCI i naMCI oraz replikacja wcześniejszych ustaleń dotyczących różnicowania pomiędzy aMCI a zdrowymi kontrolami. Opierając się na wcześniejszych badaniach dotyczących MCI i konwersji do otępienia, skupiliśmy się na strukturach płata skroniowego i sąsiadujących z nim regionach (Chiang i in., 2011): korze entorhinalnej, hipokampie, korze parahippocampalnej, amygdale, zakręcie bruzdowatym, prekuneusie, tylnej korze zakrętu obręczy i cieśni zakrętu obręczy.
Metody
Badanie to jest kontynuacją naszej wcześniej opublikowanej pracy (Sirály i in., 2015). Ponieważ w obecnym badaniu wykorzystano podobną baterię testów neuropsychologicznych oraz ten sam potok akwizycji i przetwarzania MRI, metody i procedury zostały opisane podobnie w obu pracach.
Oświadczenie etyczne
Doświadczenia przeprowadzono w pełnej zgodności z Deklaracją Helsińską oraz wszystkimi odpowiednimi krajowymi i międzynarodowymi wytycznymi etycznymi. Badania zostały zatwierdzone przez Krajowy Komitet Etyczny, Budapeszt, Węgry. Wszystkie procedury były przeprowadzane wyłącznie po uzyskaniu pisemnej świadomej zgody uczestników. Wszyscy potencjalni uczestnicy, którzy odmówili udziału w badaniu lub w inny sposób nie wzięli w nim udziału, nie zostali w żaden sposób pokrzywdzeni przez brak udziału w badaniu.
Uczestnicy
Badanie przeprowadzono na Wydziale Psychiatrii i Psychoterapii Uniwersytetu Semmelweisa w Budapeszcie. Łącznie do badania włączono 62 osoby. Wszyscy badani zgłosili się do udziału w programie treningu poznawczego ogłoszonego wśród lekarzy pierwszego kontaktu oraz w domu spokojnej starości (badanie jest zarejestrowane na ClinicalTrials.gov, identyfikator to „NCT02310620”). Wszyscy badani byli zdolni do prowadzenia samodzielnego życia. Podstawowe dane demograficzne i neuropsychologiczne podsumowano w Tabeli 1.

Tabela 1. Dane demograficzne i wynik podstawowych testów neuropsychologicznych.
Badani z aMCI i naMCI oraz zdrowe osoby z grupy kontrolnej zostali włączeni do badania na podstawie kryteriów Petersena (Petersen, 2004). Kryteria Petersena obejmują subiektywne skargi dotyczące pamięci potwierdzone przez informatora wraz z zachowaną codzienną aktywnością, zaburzenia pamięci na podstawie standardowego testu neuropsychologicznego, zachowane globalne funkcje poznawcze i wreszcie wykluczenie otępienia. Nie precyzuje on testu neuropsychologicznego do oceny zaburzeń pamięci, dlatego zastosowaliśmy test Rey Auditory Verbal Learning Test (RAVLT), który na podstawie literatury jest najczęściej wykorzystywanym testem (Gomar i wsp., 2011). W celu odróżnienia aMCI od zdrowych osób z grupy kontrolnej przyjęto wartość graniczną 1 SD poniżej średniej populacyjnej standaryzowanej dla wieku i płci. Uczestnicy, którzy uzyskali wynik poniżej wartości odcięcia zarówno w podkategorii delayed recall, jak i w wyniku całkowitym, zostali zakwalifikowani do grupy aMCI. Zastosowane kryteria oparte są na rekomendacjach National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease (Albert et al., 2011). Dokładne wartości punktów odcięcia dla RAVLT dla różnych grup wiekowych przedstawiono w tabeli 2A. Osoby, które nie należały do grupy aMCI, ale uzyskały wynik 1 SD poniżej średniej populacyjnej standaryzowanej dla wieku i płci/wykształcenia w teście Trail making Test B lub w teście Addenbrooke’s Cognitive Examination (ACE), zostały zaliczone do grupy naMCI. Dodatkowym kryterium dla grupy naMCI był niższy niż 3,2 wskaźnik VLOM (verbal fluency + language score/orientation + memory score) w ACE w celu wykluczenia ewentualnych osób z aMCI z grupy naMCI (osoby te zostały wykluczone z badania).

Tabela 2. (A). Rey Auditory Verbal Learning Test (RAVLT): dane normatywne i wyniki odcięcia dla łagodnych zaburzeń poznawczych (MCI) dostosowane do wieku; (B) Mini Mental Examination Test (MMSE): wyniki odcięcia dla demencji dostosowane do wieku i wykształcenia.
Badani z demencją zostali wykluczeni z badania zgodnie z wynikami Mini Mental State Examination (MMSE) wystandaryzowanymi dla wieku i wykształcenia (Strauss i in., 2006b). Dokładne wyniki odcięcia dla MMSE w różnych grupach wiekowych i edukacyjnych przedstawiono w tabeli 2B. Z badania wykluczono również osoby z urazem głowy, padaczką lub udarem mózgu w wywiadzie lub z rozpoznaniem ostrych zaburzeń psychicznych, schizofrenii lub manii, uzależnienia od alkoholu.
Pozyskiwanie i przetwarzanie obrazów MR
Wszystkie osoby badane były za pomocą MRI mózgu, uzyskując obrazy strukturalne o wysokiej rozdzielczości, które były wykorzystywane do dalszego przetwarzania i analizy. Akwizycje obrazów przeprowadzono w Centrum Badań MR, Uniwersytet Semmelweisa, Budapeszt na klinicznym skanerze MRI Philips Achieva 3 Tesla wyposażonym w ośmiokanałową cewkę SENSE. Wysokorozdzielcze obrazy anatomiczne całego mózgu uzyskano przy użyciu trójwymiarowej sekwencji T1W 3D TFE (T1W 3D spoiled gradient echo). U każdego uczestnika uzyskano 180 ciągłych warstw przy następujących parametrach obrazowania: TR = 9,7 ms; TE = 4,6 ms; flip angle = 8°; FOV 240 × 240 mm; rozmiar wokseli 1,0 × 1,0 × 1,0 mm.
Rekonstrukcja korowa i segmentacja wolumetryczna zostały wykonane przez Freesurfer 5.3 image analysis suite, który jest udokumentowany i swobodnie dostępny do pobrania online (http://surfer.nmr.mgh.harvard.edu/). Szczegóły techniczne tych procedur są opisane we wcześniejszych publikacjach, nie wprowadziliśmy żadnych zmian do tego potoku. W skrócie, przetwarzanie obrazu obejmuje korekcję ruchu (Reuter i in., 2010), usuwanie tkanki pozamózgowej za pomocą hybrydowej procedury watershed/deformacji powierzchni (Segonne i in., 2004), automatyczną transformację Talairach, segmentację podkorowej istoty białej i struktur wolumetrycznych głębokiej istoty szarej (w tym hipokamp, migdał, ogoniaste, putamen, komory) (Fischl i in., 2004) normalizacja intensywności, teselacja granicy istoty szarej i białej, automatyczna korekcja topologii i deformacja powierzchni po gradientach intensywności w celu optymalnego umieszczenia granic istoty szarej/białej i szarej/płynu mózgowo-rdzeniowego w miejscu, gdzie największa zmiana intensywności definiuje przejście do innej klasy tkanek (Dale i in., 1999; Fischl i Dale, 2000). Po zakończeniu tworzenia modeli korowych, program Freesurfer wykonał szereg procedur deformacyjnych w celu dalszego przetwarzania i analizy danych. Etapy obejmowały inflację powierzchni (Fischl i in., 1999a), rejestrację do atlasu sferycznego, który wykorzystywał indywidualne wzory pofałdowań kory w celu dopasowania geometrii kory u różnych osób (Fischl i in., 1999b), parcelację kory mózgowej na jednostki oparte na strukturze gyralnej i sulkularnej (Fischl i in., 2004) oraz tworzenie różnych danych powierzchniowych, w tym map krzywizn i głębokości sulkularnej. Ostatecznie modele korowe i wyniki segmentacji były sprawdzane pod względem jakości i ręcznie korygowane u każdego badanego, jednak korekta nie wykazała istotnych zmian w wynikach.
Procedury
Badania neuropsychologiczne przeprowadzano w dni powszednie w godzinach od 8 do 16. Badania odbywały się w oddzielnym, dobrze oświetlonym pomieszczeniu, w którym znajdował się tylko pacjent i egzaminator. Testy referencyjne były również wypełniane i oceniane zgodnie z zaleceniami Kompendium Neuropsychologicznego (Strauss i wsp., 2006a), natomiast testy komputerowe były oceniane przez oprogramowanie.
Testy neuropsychologiczne były administrowane przez dwóch wcześniej przeszkolonych studentów medycyny pod nadzorem psychologa i psychiatry. Podczas oceny testów kierowano się wytycznymi Kompendium Neuropsychologicznego (Strauss i in., 2006a). Testy papierowe były oceniane przez tego samego psychologa i psychiatrę zgodnie z kompendium. Test Paired Associates Learning Test (PAL test) był oceniany automatycznie przez oprogramowanie. Dane MR były również analizowane i oceniane automatycznie przez oprogramowanie Freesurfer i SAS, dlatego w analizie danych neuroobrazowych nie stosowano subiektywnych ocen. Ponieważ ocena i ewaluacja testu PAL oraz danych neuroobrazowania były całkowicie automatyczne, stronniczość ocen ludzkich była niska (ograniczona tylko do oceny testów papierowych).
Przedmioty z demencją zostały wykluczone z badania na podstawie Mini Mental State Examination (MMSE). MMSE jest standardowym testem; jego skuteczność została udowodniona w kilku badaniach, jako użyteczna metoda w różnicowaniu pomiędzy osobami z demencją a zdrowymi kontrolami (Petersen i in., 1999; Gomar i in., 2011). W większości wcześniejszych badań stosowano wynik odcięcia 26 lub wynik skorygowany o wiek dla demencji. Podtesty testu oceniają orientację, centralne funkcje wykonawcze, szybkie tworzenie skojarzeń, zdolność identyfikacji werbalnej oraz zdolność do analizy i syntezy.
Badanie Addenbrooke’s Cognitive Examination zostało wykorzystane do oceny globalnych wyników poznawczych, w tym orientacji, uwagi, pamięci, fluencji słownej, umiejętności werbalnych i wzrokowo-przestrzennych (Mathuranath i wsp., 2000; Alexopoulos et al., 2010).
Test Rey Auditory Verbal Learning Test był używany do szczegółowej oceny funkcji pamięci w oparciu o kryteria Petersena. Test Reya ocenia werbalne uczenie się i pamięć (Rey, 1958). Lista 15 słów (lista A) powinna być natychmiast powtórzona przez badanego. Test ten powtarza się 5 razy. Następnie prezentowana jest raz inna lista 15 słów (lista B lub lista interferencyjna), którą należy przypomnieć. Następnie lista A powinna być przywołana bez powtórzeń, a następnie zadanie to jest powtarzane po 30 min.
Test Trail Making, Część A i Część B (połączenie liczb; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) jest używany do oceny uwagi selektywnej, funkcji wykonawczych i elastyczności poznawczej. W części A należy połączyć losowo rozmieszczone liczby w kolejności numerycznej, natomiast w części B wyświetlane są losowo rozmieszczone liczby i litery. Badany jest instruowany, aby połączyć liczby i litery w określonej wcześniej kolejności. Zmienną zależną jest czas potrzebny na wykonanie testu. Część A TMT mierzy funkcje wykonawcze i uwagę, natomiast w wynikach części B odzwierciedlona jest również elastyczność poznawcza.
Wyniki testów neuropsychologicznych podsumowano w tabeli 1.
Wszyscy uczestnicy wypełnili formularz, w którym oceniali swój stan zdrowia i funkcje pamięciowe; ponadto musieli informować o korzystaniu z komputera i Internetu, zajęciach rekreacyjnych, spożywaniu alkoholu, nawykach żywieniowych i paleniu tytoniu (Yesavage, 1988). Do oceny objawów depresyjnych wykorzystano Geriatryczną Skalę Depresji (GDS), natomiast objawy lękowe mierzono za pomocą kwestionariusza Spielberger State-Trait Anxiety Inventory (STAI; Spielberger i wsp., 1970).
Pamięć wzrokowo-przestrzenną mierzono za pomocą implementacji testu PAL stosowanego w kilku bateriach testów neuropsychologicznych (Siraly i wsp., 2013). „W teście PAL okna otwierają się w losowych pozycjach na ekranie po sobie przez 3 s, przy czym w jednym lub kilku oknach pokazywane są abstrakcyjne kształty. Inne okna pozostają puste w zależności od poziomu trudności. Kiedy wszystkie kwadraty zostały pokazane, poprzednio pokazane kształty pojawiają się na środku ekranu, a uczestnicy muszą zdecydować, w którym oknie widzieli dany kształt wcześniej. Test składał się z pięciu różnych poziomów w ośmiu etapach w sumie, liczba kształtów wzrasta od 1 do 8 na poszczególnych etapach. Osoby badane miały 10 prób na ukończenie danego etapu, w przeciwnym razie test kończył się. Układ okienek był w teście asymetryczny i zmieniał się z etapu na etap.” (Siraly et al., 2013) Podczas testu komputerowego badani siedzieli wygodnie w odległości pół metra od ekranu komputera i po wcześniejszych informacjach rozwiązywali zadania za pomocą myszki.
Analiza statystyczna
Różnice między grupami badanymi w objętościach mózgu, grubości korowej i wynikach poznawczych analizowano za pomocą analizy ogólnego modelu liniowego (GLM w SAS 9.2) z wiekiem i płcią jako kowariantami. Objętości były standaryzowane na całkowitą objętość wewnątrzczaszkową (TIV) i są podane w procentach. W celu analizy różnic między grupami zastosowano porównania post hoc t, gdzie wartości p zostały skorygowane do 0,05/3 = 0,016, gdzie trzy oznacza liczbę porównań między grupami.
Zależności między wynikami testów neuropsychologicznych a wielkością struktur OUN analizowano za pomocą korelacji Pearsona. Korelacje z liczbą etapów ukończonych w teście PAL analizowano za pomocą korelacji Spearmana, ponieważ rozkład tej zmiennej w znacznym stopniu odbiegał od rozkładu normalnego.
Wyniki
Różnice w objętości korowej, grubości korowej i wynikach poznawczych między osobami z amci, namci i grupą kontrolną
Stwierdzono istotną różnicę w objętości hipokampa i w objętości kory entorhinalnej między grupami badanymi. Testy post hoc wykazały, że objętości są istotnie zmniejszone w grupie aMCI w stosunku do kontroli i do grupy naMCI, podczas gdy pozostałe dwie grupy nie różniły się istotnie (Tabela 3 i Rycina 1) Wśród kowariantów, płeć miała istotny wpływ na objętość hipokampa, mężczyźni badani mieli istotnie zmniejszoną wielkość hipokampa w stosunku do kobiet .
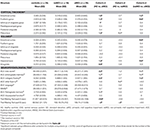
Tabela 3. Różnice struktur OUN i wyników testów neuropsychologicznych między grupami badanymi.
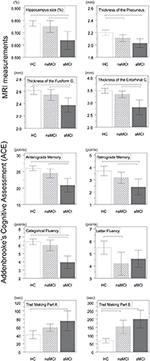
Rysunek 1. Różnice między grupami w strukturach OUN i testach neuropsychologicznych. Pionowe słupki reprezentują średnie grupowe, a słupki błędów – odchylenia standardowe. Linie poziome nad pionowymi słupkami wskazują istotne różnice między grupami po korekcie dla wielokrotnych porównań (p < 0,016). HC, zdrowe kontrole; aMCI, amnestyczne łagodne zaburzenia poznawcze; naMCI, nieamnestyczne łagodne zaburzenia poznawcze; CNS, centralny układ nerwowy.
Średnia grubość kory entorhinalnej, zakrętu bruzdowatego, cieśni zakrętu obręczy i przedklinka również różniły się znacząco w badanych grupach. Zgodnie z testami post-hoc, w grupie aMCI stwierdzono zmniejszoną grubość kory w stosunku do osób z grupy kontrolnej we wszystkich czterech strukturach, podczas gdy grubość kory zakrętu obręczy i zakrętu obręczy była również istotnie zmniejszona w grupie aMCI w stosunku do grupy naMCI. Średnie grupowe, wyniki testów post-hoc i różnice między grupami pod względem d Cohena są podsumowane w tabeli 3.
Była znacząca różnica między grupami badawczymi w pamięci anterograde, pamięci retrograde, fluencji kategorialnej. W pamięci anterograde i fluencji kategorialnej zarówno grupa kontrolna, jak i grupa naMCI przewyższały grupę aMCI, podczas gdy pierwsze grupy nie różniły się istotnie (Tabela 3). W zakresie pamięci wstecznej grupa kontrolna przewyższała grupę aMCI, ale nie grupę naMCI. W zakresie fluencji literowej kontrole przewyższały grupę naMCI, ale nie grupę aMCI, natomiast obie grupy MCI nie różniły się od siebie (p > 0,05). Ponadto w fluencji kategorialnej kobiety osiągały lepsze wyniki niż mężczyźni, natomiast wiek nie miał istotnego wpływu na wyniki.
Analizy korelacyjne
W całej próbie stwierdzono silne korelacje pomiędzy wynikami testów neuropsychologicznych a objętością i grubością struktur skroniowych mózgu (Tabela 4).

Tabela 4. Korelacje pomiędzy strukturami OUN a wynikami testów neuropsychologicznych w całej próbie.
W grupie aMCI wynik testu Rey Verbal Learning Test wykazywał istotną dodatnią korelację z wielkością jądra migdałowatego (r = 0,47, n = 20, p = 0,03), oraz grubością kory entorhinalnej (r = 0,46, n = 20, p = 0,04; Rycina 2). Osoby ze zmniejszoną objętością amygdali i zmniejszoną grubością kory entorhinalnej wykazywały gorsze wyniki w teście pamięci.

Rysunek 2. Korelacja między wynikami w zakresie pamięci krótkotrwałej indeksowanymi testem werbalnego uczenia się Reya a objętością jądra migdałowatego i grubością kory entorhinalnej w badanych grupach. Korelacje Pearsona były istotne (p < 0,05) w grupie amnestycznej MCI i w całej próbie, natomiast nieistotne w grupie kontrolnej i w grupie nieamnestycznej MCI. Całkowity wynik testu słownego Rey na osiach pionowych równa się sumie słów w pierwszych pięciu próbach. linia czerwona, linia regresji w grupie aMCI; linia przerywana, linia regresji w całej próbie; MCI, łagodne zaburzenia poznawcze; r i p, współczynnik korelacji Pearsona skorygowany o wiek i odpowiedni poziom istotności w grupie aMCI.
Ponadto badani ze zmniejszoną objętością entorhinalu (r = 0,49, n = 19, p = 0,03) oraz zmniejszoną objętością zakrętu bruzdowatego (r = 0,48, n = 19, p = 0,04) i grubością kory bruzdowatej (r = 0.53, n = 19, p = 0,02) słabiej wypadli w podteście pamięci wstecznej ACE.
Dyskusja
Amnestyczne i nieamnestyczne MCI zostały przypisane jako potencjalne prodromy do różnych typów NCD. Zakłada się, że osoby z amnestycznymi łagodnymi zaburzeniami poznawczymi mają wyższe ryzyko przejścia w otępienie typu alzheimerowskiego, podczas gdy osoby z nieamnestycznymi łagodnymi zaburzeniami poznawczymi mają wyższe ryzyko przejścia w otępienie niealzheimerowskie (Petersen i in., 1999; Killiany i wsp., 2000; Petersen i Negash, 2008).
Różnice strukturalne mózgu badano za pomocą MRI w podgrupach MCI i w zdrowej grupie kontrolnej, natomiast różnice w zakresie funkcjonowania poznawczego badano za pomocą testów neuropsychologicznych. Na podstawie wyników MRI stwierdzono, że grubość kory zakrętu obręczy, zakrętu bruzdowatego, cieśni zakrętu obręczy i zakrętu obręczy, a także objętość migdała i hipokampa były zmniejszone w aMCI w porównaniu ze zdrowymi osobami z grupy kontrolnej. Wyniki te są zgodne z wcześniejszymi badaniami donoszącymi, że osoby zdrowe, pacjenci z MCI lub chorobą Alzheimera mogą być odróżniani od siebie na podstawie objętości struktur płatów skroniowych, takich jak migdałek czy hipokamp (Desikan i in., 2009; McEvoy et al., 2009).
Objętość hipokampa i kory zakrętu obręczy, a także grubość kory zakrętu obręczy i zakrętu bruzdowatego są znacząco zmniejszone w grupie aMCI w porównaniu z grupą naMCI. Największą różnicę między grupami wykryto w objętości i grubości kory entorhinalnej (odpowiednio 0,9 i 1,2 SD), co jest zgodne z faktem, że atrofia w AD zaczyna się właśnie w tym regionie. Wyniki te pokazują, że istnieją wczesne różnice strukturalne pomiędzy podtypami MCI. Ponadto wzór tych strukturalnych wyników pasuje do patologii choroby Alzheimera (Braak i Braak, 1991), co podkreśla te wcześniejsze wyniki, że aMCI postępuje do choroby Alzheimera z większą częstością w porównaniu z naMCI (Killiany i in., 2000; Petersen i Negash, 2008).
Porównując grupę kontrolną i grupę naMCI, znaczącą różnicę znaleziono tylko w grubości precuneus, która była zmniejszona w grupie naMCI. Co ciekawe, ostatnie badania wykazały zmiany w istocie białej u pacjentów z naMCI również w obrębie istoty przedczołowej (O’Dwyer i in., 2011), która jest ważnym węzłem podtrzymującym transfer informacji między zakrętem przyhipokampowym a korą przedczołową (Vincent i in., 2006) i odgrywa ważną rolę w procesach pamięci i wyobrażeniach wzrokowych.
Wśród testów neuropsychologicznych, MMSE nie różniło się w grupach badanych, co jest prawdopodobną konsekwencją wykluczenia pacjentów z demencją. W podtestach ACE total, ACE anterograde memory i ACE category fluency grupa aMCI wypadła gorzej w porównaniu z grupą naMCI i zdrową grupą kontrolną. W teście pamięci wstecznej ACE oraz w testach Trail Making A i B grupa aMCI wypadła gorzej jedynie od zdrowych osób z grupy kontrolnej, natomiast nie wykryto różnicy między dwiema podgrupami MCI. Obniżone wyniki w zadaniach pamięciowych (RAVLT i zadanie pamięci wstecznej ACE) w grupie aMCI korelowały ze zwiększonym zaangażowaniem struktur płatów skroniowych, takich jak kora entorhinalna i migdałek (Rycina 2), co dodatkowo potwierdza nasze wyniki dotyczące różnic między grupami.
W zadaniu fluencji literowej grupa naMCI wypadła gorzej niż grupa zdrowa, podczas gdy aMCI nie różniła się od pozostałych grup. Test Trail making B jest wskaźnikiem uwagi wzrokowej i przełączania zadań. Obniżone wyniki obu grup MCI w stosunku do grupy kontrolnej (tab. 3) są prawdopodobnie wynikiem zaangażowania czołowego. Zarówno zadania na kategorie, jak i na płynność literową silnie opierają się na funkcjonowaniu płatów czołowych, włączając procesy wykonawcze, które wymagają od badanych organizacji pobierania informacji, monitorowania wcześniej przywołanych odpowiedzi, inicjowania odpowiedzi słownych i hamowania odpowiedzi, które nie mieszczą się w kryteriach (Henry i in., 2004). „Obie miary umożliwiają również dostęp do pamięci semantycznej, która jest funkcją płata skroniowego; chociaż fluencja literowa wydaje się wykorzystywać tę zdolność związaną z płatem skroniowym w mniejszym stopniu niż fluencja kategorii” (Lezak i in., 2004). Badania lezji i funkcjonalnego obrazowania mózgu również potwierdzają zaangażowanie płatów skroniowych i czołowych w zdolność do płynności. Poprzednie badania fMRI wykazały, że płynność literowa jest związana ze zwiększoną aktywacją w płatach czołowych, podczas gdy zarówno płaty czołowe, jak i skroniowe są aktywne podczas płynności kategorialnej (Birn i in., 2010). To dobrze koresponduje z naszymi ustaleniami, że aMCI różni się istotnie pod względem płynności kategorii w porównaniu z grupą zdrową i grupą naMCI, podczas gdy nie ma istotnej różnicy między tymi dwiema podgrupami w wyniku fluencji literowej.
Stwierdzono silne korelacje między funkcjami pamięci werbalnej i wzrokowej, indeksowanymi przez testy RAVLT i PAL, a objętością i grubością korową struktur skroniowych, takich jak kora zakrętu obręczy (Tabela 4) w całej próbie, a także w grupie aMCI (Rycina 2). Wyniki te potwierdzają przydatność tych neuropsychologicznych i MRI markerów we wczesnej diagnostyce patologicznego spadku poznawczego i w monitorowaniu progresji choroby.
Ograniczenia
Ograniczeniem badania jest to, że większość badanych w grupie aMCI była typem wielodomenowym, ponieważ ich wyniki w funkcjach wykonawczych oceniane przez test B i ACE były poniżej normalnego zakresu. To ograniczenie w połączeniu z faktem, że naMCI jest bardziej heterogenną jednostką w stosunku do aMCI może wyjaśniać, dlaczego obecne badanie nie było w stanie znaleźć struktur OUN o zmniejszonym rozmiarze w grupie naMCI w stosunku do grupy aMCI.
Wnioski
Nazwy aMCI i naMCI nie są tylko teoretyczne, ale te podtypy są różnymi jednostkami zarówno z neuropsychologicznego jak i strukturalnego punktu widzenia mózgu. Opracowanie specyficznych kryteriów MRI i neuropsychologicznych dla różnych podtypów łagodnych zaburzeń poznawczych umożliwi ocenę uwarunkowań i częstości występowania podtypów MCI.
Przypisanie podtypów MCI będzie przydatne do poprawy przewidywania typu otępienia i ryzyka konwersji do otępienia. Ponadto przyporządkowanie podtypów MCI może zapewnić lepsze podejście do badania skuteczności opcji terapeutycznych w zapobieganiu konwersji do zaburzeń neurokognitywnych. W oparciu o nasze wyniki MRI może być użytecznym narzędziem do bardziej precyzyjnego rozdzielenia podtypów MCI.
Wkład autorów
GC zaprojektował badanie, napisał protokół, podjął się analizy statystycznej, stworzył ryciny i napisał pierwszy szkic manuskryptu ES uczestniczył w wykonaniu pomiarów, zarządzał wyszukiwaniem literatury i analizami, napisał pierwszy szkic wstępu i wniosków. ÁS przyczyniła się do ukończenia wszystkich części manuskryptu. ZF, AH uczestniczyli w wykonywaniu pomiarów i przyczynili się do napisania rozdziału dotyczącego metod. ÉC, PS, ZH, GR sprawowali nadzór nad eksperymentami w trakcie badania, w tym nad pisaniem manuskryptu. All authors contributed to and have approved the final manuscript.
Funding
The study was supported by the „Ambient Assisted Living Joint Programme (AAL)-Call 2” grant (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validation of the German revised Addenbrooke’s cognitive examination for detecting mild cognitive impairment, mild dementia in alzheimer’s disease and frontotemporal lobar degeneration. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neural systems supporting lexical search guided by letter and semantic category cues: Badanie płynności słownej z wykorzystaniem rezonansu magnetycznego (FMRI) z autopaced overt response. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Mild cognitive impairment-a review of prevalence, incidence and outcome according to current approaches. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identifying cognitively healthy elderly individuals with subsequent memory decline by using automated MR temporoparietal volumes. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Analiza powierzchni korowych. I. Segmentacja i rekonstrukcja powierzchni. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer’s disease. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Measuring the thickness of the human cerebral cortex from magnetic resonance images. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequence-independent segmentation of magnetic resonance images. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Analiza oparta na powierzchni korowej. II: Inflation, flattening, and a surface-based coordinate system. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). High-resolution intersubject averaging and a coordinate system for the cortical surface. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., and DeKosky, S. T. (2004). Mild cognitive impairment, amnestic type: an epidemiologic study. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). Utility of combinations of biomarkers, cognitive markers, and risk factors to predict conversion from mild cognitive impairment to Alzheimer disease in patients in the Alzheimer’s disease neuroimaging initiative. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld cognitive impairment can be distinguished from alzheimer disease and normal aging for clinical trials. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Predictive validity and diagnostic stability of mild cognitive impairment subtypes. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). Verbal fluency performance in dementia of the Alzheimer’s type: a meta-analysis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Use of structural magnetic resonance imaging to predict who will get Alzheimer’s disease. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidence and outcome of mild cognitive impairment in a population-based prospective cohort. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkers and incipient Alzheimer disease in patients with mild cognitive impairment. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr, Holland, D., et al. (2009). Alzheimer disease: quantitative structural neuroimaging for detection and prediction of clinical and structural changes in mild cognitive impairment. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversion to dementia and the APOE genotype: a prediction study with FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Multiple indices of diffusion identifies white matter damage in mild cognitive impairment and Alzheimer’s disease. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Łagodne zaburzenia poznawcze jako jednostka diagnostyczna. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Łagodne upośledzenie funkcji poznawczych: przegląd. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Mild cognitive impairment: clinical characterization and outcome. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., and DeKosky, S. T. (2001). Practice parameter: early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality standards subcommittee of the American academy of neurology. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Związek testu tworzenia śladów z organicznym uszkodzeniem mózgu. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Highly accurate inverse consistent registration: a robust approach. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A hybrid approach to the skull stripping problem in MRI. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Mild cognitive impairment: ta sama tożsamość dla różnych jednostek. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Monitorowanie wczesnych oznak pogorszenia funkcji poznawczych u osób starszych przez gry komputerowe: badanie MRI. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstrakt | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). „Mini Mental State Examination (MMSE),” in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A i B: dane normatywne rozwarstwione według wieku i wykształcenia. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Coherent spontaneous activity identifies a hippocampal-parietal memory network. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatryczna skala depresji. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Grey matter atrophy of basal forebrain and hippocampus in mild cognitive impairment. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar
.