- Introduction
- Methodieken
- Ethiekverklaring
- Deelnemers
- MR beeldacquisitie en -verwerking
- Procedures
- Statistische analyse
- Resultaten
- Verschillen in Corticale Volumes, Corticale Dikte en Cognitieve Prestaties tussen proefpersonen met amci, namci, en Controles
- Correlationele Analyses
- Discussie
- Beperkingen
- Conclusies
- Bijdragen van de auteur
- Funding
- Conflict of Interest Statement
Introduction
Grote neurocognitieve stoornissen (NCD) of dementie waaronder de ziekte van Alzheimer (AD) zijn een verwoestend probleem van onze ouder wordende samenleving met een enorme sociale, economische en medische last. Omdat we op dit moment geen effectieve behandeling hebben voor NCD, heeft recent onderzoek zich gericht op het opsporen van vroege symptomen. Uit vele recente studies is gebleken dat het pathologische proces van AD tientallen jaren vóór de eerste symptomen van cognitieve achteruitgang begint (Mattsson et al., 2009). De tussenfase tussen de verwachte cognitieve achteruitgang bij fysiologische veroudering en de ernstige achteruitgang bij dementie, bekend als “mild cognitive impairment” (MCI), heeft veel belangstelling gekregen. “Bij MCI kan milde verslechtering van cognitieve vaardigheden worden aangetoond door neuropsychologische tests, terwijl globale cognitieve functies en dagelijkse activiteiten behouden blijven” (Petersen, 2004). De hogere conversiegraad naar NCD bij MCI geeft de klinische betekenis van deze pre-disease conditie aan. Het conversiepercentage naar NCD is 10-15% per jaar bij MCI vergeleken met het jaarlijkse percentage van 1-4% bij de gemiddelde oudere bevolking (Petersen et al., 2001; Bischkopf et al., 2002). De meerderheid van deze patiënten ontwikkelt klinische AD. Opgemerkt moet worden dat MCI ook een stabiele of omgekeerde aandoening kan zijn die niet overgaat in dementie. Longitudinale epidemiologische studies rapporteren een variabel conversiepercentage en een relatief frequente terugkeer naar normale cognitie (Larrieu et al., 2002; Ganguli et al., 2004). Verschillende bevindingen suggereren instabiliteit in de diagnostische accuratesse en een behoefte aan meer specifieke identificatie tussen de MCI-patiënten (Han et al., 2012). Gezien het bovenstaande is het begrijpelijk dat verschillende studies zich richten op de symptomen en verschillen met de gemiddelde populatie die nauw samenhangen met de ontwikkeling van dementie en daarom kunnen worden gebruikt om de vroege diagnose te ondersteunen.
Patiënten met MCI kunnen verder worden gecategoriseerd als amnestische (aMCI) en niet-amnestische MCI (naMCI). Bij aMCI overheerst het geheugenverlies en het wordt geassocieerd met een hoog risico op verdere conversie naar AD (Grundman, 2004). Personen met naMCI hebben stoornissen op andere gebieden dan het geheugen en hebben een hoger risico op conversie naar andere vormen van dementie, zoals diffuse Lewy body dementie. Beide typen kunnen verder gecategoriseerd worden in single-domain en multi domain subtypes, maar in het huidige onderzoek werd geen verdere categorisatie gedaan vanwege de beperkte steekproefomvang. Er zijn belangrijke soorten biomarkers van MCI getest met het doel de speciale kenmerken van patiënten die overgaan in AD te identificeren. Terwijl de resultaten van cerebrospinale vloeistof biomarkers (Hansson et al., 2006) en positron emissie tomografie studies (Mosconi et al., 2004) wezen op sterk wisselende specificiteit en gevoeligheid, lieten structurele magnetische resonantie beeldvorming studies indrukwekkende resultaten zien (Jack et al., 1999; deToledo-Morrell et al., 2004). Interessant genoeg onderzochten verschillende eerdere studies de verschillen tussen proefpersonen met MCI en gezonde controles, slechts een paar studies probeerden onderscheid te maken tussen de MCI-subtypen (Zhang et al., 2011; Serra et al., 2013).
Hoewel aMCI en naMCI theoretisch verschillende entiteiten zijn, bestudeerden slechts een paar onderzoeken de structurele hersenverschillen tussen deze subtypen van MCI (Serra et al., 2013). Het doel van deze studie was om de structurele verschillen tussen aMCI en naMCI te vinden, en om eerdere bevindingen over de differentiatie tussen aMCI en gezonde controles te repliceren. Op basis van eerdere studies naar MCI en conversie naar dementie richtten we ons op structuren van de temporale kwab en de aangrenzende regio’s (Chiang et al, 2011): de entorhinale cortex, de hippocampus, de parahippocampale cortex, de amygdala, de fusiforme gyrus, de precuneus, de posterieure cingulate cortex, en de isthmus van cingulate gyrus.
Methodieken
Deze studie is een voortzetting van ons eerder gepubliceerde werk (Sirály et al., 2015). Aangezien een vergelijkbare neuropsychologische testbatterij, en dezelfde MRI-acquisitie en -verwerkingspijplijn is gebruikt in de huidige studie, zijn methoden en procedures op vergelijkbare wijze beschreven in beide papers.
Ethiekverklaring
De experimenten werden uitgevoerd in volledige overeenstemming met de Verklaring van Helsinki en alle relevante nationale en internationale ethische richtlijnen. Het onderzoek werd goedgekeurd door het Nationaal Ethisch Comité, Boedapest, Hongarije. Alle procedures werden pas uitgevoerd nadat schriftelijke geïnformeerde toestemming was verkregen van de deelnemers. Alle potentiële deelnemers die weigerden deel te nemen of anderszins niet deelnamen, werden op geen enkele wijze benadeeld door niet aan de studie deel te nemen.
Deelnemers
De studie werd uitgevoerd in het Departement Psychiatrie en Psychotherapie, Semmelweis Universiteit, Boedapest. In totaal werden 62 proefpersonen ingeschreven in de studie. Alle proefpersonen meldden zich aan voor deelname aan een cognitief trainingsprogramma dat was aangekondigd bij huisartsen en in een Retirement Home (De studie is geregistreerd bij ClinicalTrials.gov, identifier is “NCT02310620”). Alle proefpersonen waren in staat om een zelfstandig leven te leiden. De demografische en neuropsychologische basisgegevens zijn samengevat in tabel 1.

Tabel 1. Demografische gegevens en resultaat van neuropsychologische basistests.
Onderwerpen met aMCI en naMCI, en gezonde controles werden geïncludeerd in de studie op basis van de Petersen-criteria (Petersen, 2004). De Petersen criteria omvatten subjectieve geheugenklachten bevestigd door een informant samen met behouden dagelijkse activiteiten, een geheugenstoornis gebaseerd op een standaard neuropsychologische test, behouden globale cognitieve functies en tenslotte de uitsluiting van dementie. Er wordt geen neuropsychologische test gespecificeerd voor de beoordeling van geheugenstoornissen, daarom hebben wij de Rey Auditory Verbal Learning Test (RAVLT) toegepast, die op basis van de literatuur de meest gebruikte test is (Gomar et al., 2011). Voor de differentiatie tussen aMCI en gezonde controles pasten we een cutoff score toe van 1 SD onder het gemiddelde van de populatie, gestandaardiseerd voor leeftijd en geslacht. Deelnemers die onder de afkapwaarde scoorden in de delayed recall subscore of in de totaalscore, werden in de aMCI-groep geplaatst. De toegepaste criteria zijn gebaseerd op de aanbevelingen van de werkgroepen van het National Institute on Aging-Alzheimer’s Association voor diagnostische richtlijnen voor de ziekte van Alzheimer (Albert et al., 2011). De exacte cutoff scores voor de RAVLT voor de verschillende leeftijdsgroepen worden gegeven in Tabel 2A. Proefpersonen die niet in de aMCI-groep zaten, maar 1 SD onder het voor leeftijd en geslacht/opleiding gestandaardiseerde populatiegemiddelde scoorden op de Trail making Test B of op de Addenbrooke’s Cognitive Examination (ACE), werden in de naMCI-groep geplaatst. Een extra criterium voor de naMCI-groep was een VLOM-ratio (verbal fluency + language score/orientation + memory score) lager dan 3,2 in de ACE om mogelijke aMCI-profielen uit te sluiten van de naMCI-groep (deze proefpersonen werden uitgesloten van de studie).

Tabel 2. (A). Rey Auditory Verbal Learning Test (RAVLT): normatieve gegevens en cut-off scores voor Mild Cognitive Impairment (MCI) gecorrigeerd voor leeftijd; (B) Mini Mental Examination Test (MMSE): cut-off scores voor dementie gecorrigeerd voor leeftijd en opleiding.
Dementerenden werden van de studie uitgesloten volgens de Mini Mental State Examination (MMSE) scores gestandaardiseerd voor leeftijd en opleiding (Strauss et al., 2006b). De exacte cutoff scores voor de MMSE in de verschillende leeftijds- en opleidingsgroepen worden gegeven in Tabel 2B. Proefpersonen met een voorgeschiedenis van hoofdtrauma, epilepsie of beroerte, of diagnose van acute psychiatrische stoornis, schizofrenie of manie, alcoholafhankelijkheid werden ook uitgesloten van het onderzoek.
MR beeldacquisitie en -verwerking
Alle proefpersonen werden onderzocht met hersen-MRI, waarbij hoge resolutie structurele beelden werden geproduceerd, die werden gebruikt voor verdere verwerking en analyse. Beeldacquisities werden uitgevoerd in het MR Research Center, Semmelweis Universiteit, Boedapest op een 3 Tesla Philips Achieva klinische MRI scanner uitgerust met een acht-kanaals SENSE hoofdspoel. De hoge resolutie, anatomische beelden van de gehele hersenen werden verkregen met behulp van een T1 gewogen 3 dimensionale spoiled gradient echo (T1W 3D TFE) sequentie. Van elk onderwerp werden 180 aaneengesloten plakken verkregen met de volgende beeldvormingsparameters: TR = 9,7 ms; TE = 4,6 ms; flip hoek = 8 °; FOV van 240 × 240 mm; voxel grootte van 1,0 × 1,0 × 1,0 mm.
Corticale reconstructie en volumetrische segmentatie werden uitgevoerd door Freesurfer 5.3 beeldanalyse suite, die is gedocumenteerd en vrij beschikbaar voor download online (http://surfer.nmr.mgh.harvard.edu/). De technische details van deze procedures worden beschreven in eerdere publicaties, hebben we geen wijzigingen aangebracht in deze pijplijn. Kort samengevat, beeldverwerking omvat motion correctie (Reuter et al., 2010), verwijdering van niet-hersenweefsel met behulp van een hybride watershed / oppervlak vervorming procedure (Segonne et al., 2004), geautomatiseerde Talairach transformatie, segmentatie van de subcorticale witte stof, en diepe grijze stof volumetrische structuren (met inbegrip van hippocampus, amygdala, caudate, putamen, ventrikels) (Fischl et al., 2004) intensiteitsnormalisatie, vlakvulling van de grijze stof witte stof grens, geautomatiseerde topologie correctie, en oppervlakte vervorming na intensiteitsgradiënten om optimaal de grijs / witte en grijs / cerebrospinale vloeistof grenzen te plaatsen op de plaats waar de grootste verschuiving in intensiteit definieert de overgang naar de andere weefsel klasse (Dale et al., 1999; Fischl en Dale, 2000). Zodra de corticale modellen werden voltooid, Freesurfer voerde een aantal vervormbare procedures voor in de verdere verwerking en analyse van gegevens. Stappen omvatten oppervlakte inflatie (Fischl et al., 1999a), registratie aan een sferische atlas die individuele corticale vouwpatronen gebruikte om corticale geometrie tussen proefpersonen te matchen (Fischl et al., 1999b), verkaveling van de cerebrale cortex in eenheden gebaseerd op gyrale en sulcale structuur (Fischl et al., 2004), en creatie van een verscheidenheid van oppervlakte gebaseerde gegevens met inbegrip van kaarten van kromming en sulcale diepte. Tenslotte werden de corticale modellen en de resultaten van de segmentatie gecontroleerd op kwaliteit en handmatig gecorrigeerd bij elke proefpersoon, maar correctie toonde geen significante veranderingen in de resultaten.
Procedures
De neuropsychologische onderzoeken werden uitgevoerd op weekdagen tussen 8 uur ’s ochtends en 4 uur ’s middags. De onderzoeken bestonden uit gecomputeriseerde (d.w.z., PAL-test) en papieren neuropsychologische tests. De tests vonden plaats in een aparte goed verlichte kamer waar alleen de patiënt en een examinator aanwezig waren. Referentietests werden ook ingevuld en geëvalueerd volgens de aanbevelingen van het Neuropsychologisch Compendium (Strauss et al., 2006a), terwijl de gecomputeriseerde tests werden geëvalueerd door de software.
Neuropsychologische tests werden afgenomen door twee eerder opgeleide geneeskundestudenten onder supervisie van een psycholoog en een psychiater. Bij de beoordeling van de tests werden de richtlijnen van het Neuropsychologisch Compendium (Strauss et al., 2006a) gevolgd. De tests op papier werden door dezelfde psycholoog en een psychiater geëvalueerd volgens het compendium. De Paired Associates Learning Test (PAL test) werd automatisch geëvalueerd door een software. MR-gegevens werden eveneens automatisch geanalyseerd en geëvalueerd door de Freesurfer- en SAS-software; bij de analyse van neuro-imaginggegevens waren dus geen subjectieve oordelen betrokken. Aangezien de beoordeling en evaluatie van de PAL-test en de neuro-beeldvormingsgegevens volledig automatisch verliepen, was de vertekening door menselijke oordelen gering (alleen beperkt tot de evaluatie van de op papier gebaseerde tests).
Dementerenden werden van de studie uitgesloten op basis van de Mini Mental State Examination (MMSE). De MMSE is een standaardtest; de doeltreffendheid ervan werd in verschillende studies aangetoond als een nuttige methode om een onderscheid te maken tussen personen met dementie en gezonde controles (Petersen et al., 1999; Gomar et al., 2011). De meerderheid van de eerdere studies gebruikte de cut off score van 26 of de voor leeftijd gecorrigeerde score voor dementie. De subtaken van de test beoordelen oriëntatie, centrale executieve functie, snelle associatievorming, verbaal identificatievermogen, en het vermogen tot analyseren en synthetiseren.
De Addenbrooke’s Cognitive Examination werd gebruikt om de globale cognitieve prestaties te beoordelen, waaronder oriëntatie, aandacht, geheugen, verbale vloeiendheid, verbale, en visuospatiale vaardigheden (Mathuranath et al., 2000; Alexopoulos et al., 2010).
De Rey Auditory Verbal Learning Test werd gebruikt voor de gedetailleerde beoordeling van geheugenfuncties op basis van Petersen criteria. De Rey test evalueert verbaal leren en geheugen (Rey, 1958). Een lijst van 15 woorden (lijst A) moet door de proefpersoon onmiddellijk worden herhaald. Deze test wordt 5 keer herhaald. Dan wordt een andere lijst van 15 woorden (lijst B of interferentielijst) eenmaal gepresenteerd die moet worden opgeroepen. Daarna moet lijst A worden teruggeroepen zonder herhaling, en dan wordt deze taak na 30 min herhaald.
De Trail Making test, Part A en Part B (nummer verbinding; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) wordt gebruikt om selectieve aandacht, executieve functies, en cognitieve flexibiliteit te evalueren. In deel A moeten willekeurig verdeelde getallen in numerieke volgorde met elkaar worden verbonden, terwijl in deel B willekeurig verdeelde getallen en letters worden getoond. De proefpersoon krijgt de opdracht de cijfers en letters in een vooraf bepaalde volgorde met elkaar te verbinden. De afhankelijke variabele is de tijd die nodig is om de test te voltooien. Deel A van TMT meet executieve functies en aandacht, terwijl in de prestatie op deel B ook cognitieve flexibiliteit tot uitdrukking komt.
De resultaten van de neuropsychologische tests zijn samengevat in tabel 1.
Alle deelnemers vulden een formulier in waarin zij hun eigen gezondheidstoestand en geheugenfunctie evalueerden; verder moesten zij rapporteren over hun computer- en internetgebruik, recreatieve activiteiten, alcoholgebruik, voedingsgewoonten en roken (Yesavage, 1988). De Geriatric Depression Scale (GDS) werd gebruikt om depressieve symptomen te beoordelen, terwijl angstsymptomen werden gemeten met de Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
Visuospatieel geheugen werd gemeten door een implementatie van de PAL-test die in verschillende neuropsychologische testbatterijen wordt gebruikt (Siraly et al., 2013). “In de PAL-test openen vensters op willekeurige posities op het scherm na elkaar gedurende 3 s met abstracte vormen getoond in een of meer vensters. Andere vensters blijven leeg, afhankelijk van de moeilijkheidsgraad. Wanneer alle vierkanten getoond zijn, verschijnen de eerder getoonde vormen in het midden van het scherm en moeten de deelnemers beslissen in welk venster ze die vorm eerder gezien hebben. De test bestaat uit vijf verschillende niveaus in acht fasen in totaal, het aantal vormen neemt toe van 1 tot 8 in de verschillende fasen. De proefpersonen hadden 10 proeven om een bepaalde fase te voltooien, anders was de test afgelopen. De opstelling van de vensters was asymmetrisch in de test en het veranderde van stadium tot stadium.” (Siraly et al., 2013) Tijdens de gecomputeriseerde test zaten de proefpersonen comfortabel op een afstand van een halve meter van het computerscherm en na voorafgaande informatie losten ze de taken op met behulp van een muis.
Statistische analyse
Verschillen tussen de studiegroepen in hersenvolumes, corticale dikte en cognitieve prestaties werden geanalyseerd door General Linear Model Analysis (GLM in SAS 9.2) met leeftijd en geslacht als covariaten. Volumes werden gestandaardiseerd voor totaal intracranieel volume (TIV), en worden gegeven in percentages. Om verschillen tussen groepen te analyseren werden post hoc t vergelijkingen toegepast, waarbij p-waarden werden aangepast tot 0.05/3 = 0.016, waarbij drie staat voor het aantal vergelijkingen tussen groepen.
De relatie tussen de resultaten van de neuropsychologische tests en de grootte van de CNS structuren werden geanalyseerd door Pearson correlaties. Correlaties met het aantal voltooide fasen in de PAL-test werden geanalyseerd door Spearman Correlatie, omdat de verdeling van deze variabele grotendeels afweek van de normale verdeling.
Resultaten
Verschillen in Corticale Volumes, Corticale Dikte en Cognitieve Prestaties tussen proefpersonen met amci, namci, en Controles
Er werd een significant verschil gevonden in het volume van de hippocampus en in het volume van de entorhinale cortex tussen de studiegroepen . De post hoc tests toonden aan dat de volumes significant verlaagd zijn in de aMCI groep ten opzichte van de controles en de naMCI groep, terwijl de andere twee groepen niet significant verschilden (Tabel 3 en Figuur 1) Onder de covariaten had geslacht een significant effect op het volume van de hippocampus, mannelijke proefpersonen hadden een significant verlaagde hippocampusgrootte ten opzichte van vrouwen .
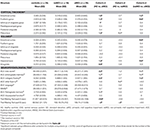
Tabel 3. Verschillen van de CNS structuren en de neuropsychologische testresultaten tussen de onderzoeksgroepen.
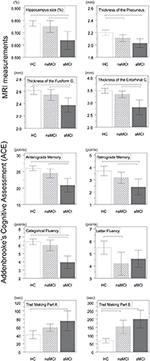
Figuur 1. Verschillen tussen groepen in CNS-structuren en neuropsychologische tests. De verticale balken geven de groepsgemiddelden weer, terwijl de foutbalken de standaarddeviaties weergeven. De horizontale lijnen boven de verticale balken geven significante verschillen tussen groepen aan na correctie voor meervoudige vergelijkingen (p < 0,016). HC, gezonde controles; aMCI, amnestische milde cognitieve stoornis; naMCI, niet-amnestische milde cognitieve stoornis; CNS, centraal zenuwstelsel.
De gemiddelde dikte van de entorhinale cortex , de fusiforme gyrus , de isthmus van cingulated gyrus , en de precuneus zijn ook significant verschilde tussen de studiegroepen. Volgens de post-hoc tests, werden verminderde corticale dikte gevonden in de aMCI ten opzichte van de controles in alle vier de structuren, terwijl de dikte van de entorhinale cortex en de fusiforme gyrus ook significant verminderd waren in de aMCI groep ten opzichte van de naMCI groep. De groepsgemiddelden, de resultaten van de post-hoc tests, en de verschillen tussen groepen in termen van Cohen’s d zijn samengevat in Tabel 3.
Er was een significant verschil tussen de studiegroepen in anterograde geheugen , retrograde geheugen , categorische vloeiendheid . In anterograde geheugen en categorische vloeiendheid zowel de controlegroep en de naMCI groep beter presteren dan de aMCI groep, terwijl de eerste groepen niet significant verschillen (tabel 3). In retrograde geheugen presteerden de controles beter dan de aMCI groep, maar niet de naMCI groep. In lettervloeiendheid presteerden de controles beter dan de naMCI-groep, maar niet de aMCI-groep, terwijl de twee MCI-groepen niet van elkaar verschilden (p > 0,05). Bovendien presteerden vrouwelijke proefpersonen in categorische vloeiendheid beter dan mannen, terwijl leeftijd geen significant effect had op de prestaties.
Correlationele Analyses
In de gehele steekproef werden sterke correlaties gevonden tussen de resultaten van de neuropsychologische tests en het volume en de dikte van de temporale hersenstructuren (tabel 4).

Tabel 4. Correlaties tussen de CNS-structuren en de neuropsychologische testresultaten over de gehele steekproef.
In de aMCI-groep vertoonde het resultaat van de Rey Verbal Learning Test een significante positieve correlatie met de grootte van de amygdala (r = 0,47, n = 20, p = 0,03), en de dikte van de entorhinale cortex (r = 0,46, n = 20, p = 0,04; figuur 2). Proefpersonen met verminderde amygdala-volumes en verminderde entorhinale dikte vertoonden slechtere prestaties op de geheugentest.

Figuur 2. Correlatie tussen de prestaties op het gebied van het korte-termijngeheugen, zoals geïndexeerd door de Rey verbale leertest, en het volume van de amygdala en de dikte van de entorhinale cortex in de onderzoeksgroepen. Pearson correlaties waren significant (p < 0.05) in de amnestische MCI groep en in de gehele steekproef, terwijl niet-significant in de controle en in de niet-amnestische MCI groepen. Rode lijn, regressielijn in de aMCI-groep; stippellijn, regressielijn in de gehele steekproef; MCI, mild cognitive impairment; r en p, Pearson correlatiecoëfficiënt gecorrigeerd voor leeftijd en corresponderend significantieniveau in de aMCI-groep.
Daarnaast proefpersonen met verminderde entorhinale volumes (r = 0,49, n = 19, p = 0,03), en verminderde fusiform gyrus volumes (r = 0,48, n = 19, p = 0,04) en fusiforme corticale dikte (r = 0.53, n = 19, p = 0,02) presteerden zwakker in de retrograde geheugen subtest van de ACE.
Discussie
Amnestische en niet-amnestische MCI werden toegewezen als potentiële prodromen van verschillende soorten NCD’s. Aangenomen wordt dat personen met amnestische milde cognitieve stoornissen een hoger risico hebben om over te gaan in Alzheimerdementie, terwijl personen met niet-amnestische milde cognitieve stoornissen een hoger risico zouden hebben om over te gaan in nietAlzheimerdementie (Petersen et al, 1999; Killiany et al., 2000; Petersen and Negash, 2008).
De structurele verschillen van de hersenen werden onderzocht met MRI in de MCI-subgroepen en de gezonde controlegroep, terwijl de verschillen in cognitieve prestaties werden onderzocht met neuropsychologische tests. Volgens de MRI resultaten waren de dikte van de entorhinale cortex, de fusiforme gyrus, de isthmus van cingular gyrus, en de precuneus, en het volume van de amygdala en de hippocampus verminderd bij aMCI in vergelijking met gezonde controles. Deze bevindingen komen overeen met eerdere studies die rapporteerden dat gezonde proefpersonen, patiënten met MCI of de ziekte van Alzheimer van elkaar kunnen worden onderscheiden op basis van de volumes van de temporale kwabstructuren zoals de amygdala of de hippocampus (Desikan et al, 2009; McEvoy et al., 2009).
De volumes van de hippocampus en de entorhinale cortex, en de dikte van de entorhinale cortex en de fusiforme gyrus zijn significant afgenomen in de aMCI-groep ten opzichte van de naMCI-groep. Het grootste verschil tussen de groepen werd gevonden in het volume en de dikte van de entorhinale cortex (respectievelijk 0,9 en 1,2 SD), wat in overeenstemming is met het feit dat atrofie bij AD begint in deze regio. Deze resultaten tonen aan dat er vroege structurele verschillen zijn tussen de subtypes van MCI. Bovendien past het patroon van deze structurele bevindingen bij de pathologie van de ziekte van Alzheimer (Braak en Braak, 1991), hetgeen de eerdere resultaten onderstreept dat aMCI met een hogere frequentie overgaat in de ziekte van Alzheimer dan naMCI (Killiany et al., 2000; Petersen en Negash, 2008).
Vergelijking van de controle en de naMCI groep leverde alleen een significant verschil op in de dikte van de precuneus, die was afgenomen in de naMCI groep. Interessant is dat in een recente studie witte stof laesies bij patiënten met naMCI ook in de precuneus werden gevonden (O’Dwyer et al., 2011), die een belangrijk knooppunt is dat de informatieoverdracht tussen de parahippocampale gyrus en de prefrontale cortex ondersteunt (Vincent et al., 2006) en een belangrijke rol speelt in het geheugenproces en de visuele verbeelding.
Van de neuropsychologische tests verschilde de MMSE niet tussen de onderzoeksgroepen, wat waarschijnlijk een gevolg is van de exclusie van patiënten met dementie. In de ACE totaal, ACE anterograde geheugen, en ACE categorie vloeiendheid subtests presteerde de aMCI groep slechter ten opzichte van de naMCI groep en de gezonde controlegroep. In de retrograde geheugentest van de ACE en in de Trail Making A en B tests presteerde de aMCI groep alleen slechter dan de gezonde controles, terwijl er geen verschil werd waargenomen tussen de twee MCI subgroepen. De verminderde prestatie op de geheugentaken (RAVLT en ACE retrograde geheugentaak) in de aMCI groep correleerde met de verhoogde betrokkenheid van temporale kwab structuren zoals de entorhinale cortex, en de amygdala (figuur 2), wat onze resultaten over tussen groep verschillen verder bevestigt.
In de letter vloeiendheid taak presteerde de naMCI groep slechter dan de gezonde groep, terwijl de aMCI niet verschilde van de andere groepen. Trail making B test is een index van visuele aandacht en taak omschakeling. De verminderde prestatie van beide MCI groepen ten opzichte van de controles (Tabel 3) is waarschijnlijk het gevolg van frontale betrokkenheid. Zowel categorie- als lettervloeiendheidstaken steunen sterk op het functioneren van de frontale kwab, inclusief uitvoerende processen die vereisen dat de proefpersonen het ophalen organiseren, eerder opgeroepen reacties controleren, verbale reacties initiëren en reacties inhiberen die niet binnen de criteria passen (Henry et al., 2004). “Beide metingen hebben ook toegang tot semantische geheugenopslagplaatsen, een functie van de temporale kwab; hoewel lettervloeiendheid dit vermogen gekoppeld aan de temporale kwab in mindere mate lijkt aan te spreken dan categorievloeiendheid” (Lezak e.a., 2004). Lesie en functionele beeldvormingsstudies van de hersenen ondersteunen ook de betrokkenheid van de temporale en frontale kwabben bij vloeiendheid. Eerdere fMRI studies toonden aan dat Letter fluency geassocieerd is met verhoogde activatie in de frontale kwabben, terwijl zowel de frontale als temporale kwabben actief zijn tijdens category fluency (Birn et al., 2010). Dit komt goed overeen met onze bevindingen dat aMCI significant verschilt naar categorie vloeiendheid in vergelijking met gezonde en naMCI groep, terwijl er geen significant verschil is tussen de twee subgroepen in de letter vloeiendheid resultaat.
Er werden sterke correlaties gevonden tussen verbale en visuele geheugenfuncties zoals geïndexeerd door de RAVLT en de PAL-tests, en de volumes en corticale dikte van de temporale structuren zoals de entorrhinale cortex (tabel 4) in de gehele steekproef en ook in de aMCI groep (figuur 2). Deze bevindingen kruisvalideren het nut van deze neuropsychologische en MRI markers in de vroege diagnose van pathologische cognitieve achteruitgang en in het monitoren van ziekteprogressie.
Beperkingen
Een beperking van de studie is dat de meerderheid van de proefpersonen in de aMCI groep van het multi-domein type waren, aangezien hun prestaties in uitvoerende functies zoals beoordeeld door de trail making test B en de ACE onder het normale bereik lagen. Deze beperking, samen met het feit dat naMCI een meer heterogene entiteit is ten opzichte van aMCI, kan verklaren waarom de huidige studie niet in staat was om CNS-structuren met verminderde omvang te vinden in de naMCI-groep ten opzichte van de aMCI-groep.
Conclusies
De naamgeving van aMCI en naMCI is niet alleen theoretisch, maar deze subtypes zijn verschillende entiteiten, zowel vanuit neuropsychologisch als vanuit hersenstructureel oogpunt. De ontwikkeling van specifieke MRI- en neuropsychologische criteria voor de verschillende subtypen van milde cognitieve stoornissen zal het vervolgens mogelijk maken de determinanten en de prevalentie van de MCI-subtypen te beoordelen.
De toewijzing van MCI-subtypen zal nuttig zijn om de voorspelling van het type dementie en het risico van conversie naar dementie te verbeteren. Bovendien kan de toewijzing van MCI-subtypes een betere benadering opleveren voor het testen van de werkzaamheid van therapeutische opties bij het voorkomen van conversie naar neurocognitieve stoornissen. Op basis van onze resultaten kan MRI een nuttig instrument zijn om MCI subtypes nauwkeuriger te scheiden.
Bijdragen van de auteur
GC ontwierp de studie, schreef het protocol, deed de statistische analyse, maakte de figuren, en schreef het eerste ontwerp van het manuscript ES nam deel aan de uitvoering van de metingen, beheerde de literatuuronderzoeken en analyses, en schreef het eerste ontwerp van de inleiding en de conclusie. ÁS heeft bijgedragen aan de afronding van alle delen van het manuscript. ZF, AH namen deel aan de uitvoering van de metingen, en droegen bij aan het schrijven van de methoden sectie. ÉC, PS, ZH, GR gaven supervisie over de experimenten tijdens de studie, inclusief het schrijven van het manuscript. Alle auteurs hebben bijgedragen aan en hebben het definitieve manuscript goedgekeurd.
Funding
De studie werd ondersteund door de “Ambient Assisted Living Joint Programme (AAL)-Call 2” subsidie (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). De diagnose van milde cognitieve stoornissen ten gevolge van de ziekte van Alzheimer: aanbevelingen van de werkgroepen van het National Institute on Aging-Alzheimer’s Association inzake diagnostische richtlijnen voor de ziekte van Alzheimer. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validation of the German revised Addenbrooke’s cognitive examination for detecting mild cognitive impairment, mild dementia in alzheimer’s disease and frontotemporal lobar degeneration. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neurale systemen ter ondersteuning van lexicaal zoeken geleid door letter en semantische categorie cues: een fMRI studie van verbale vloeiendheid. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Mild cognitive impairment-een overzicht van prevalentie, incidentie en uitkomst volgens de huidige benaderingen. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Neuropathologische stadiëring van Alzheimer-gerelateerde veranderingen. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identificatie van cognitief gezonde ouderen met latere geheugenachteruitgang aan de hand van geautomatiseerde MR temporopariëtale volumes. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Corticale oppervlakte-analyse. I. Segmentatie en oppervlakte reconstructie. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Geautomatiseerde MRI metingen identificeren individuen met milde cognitieve stoornissen en de ziekte van Alzheimer. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-afgeleide entorhinale volume is een goede voorspeller van conversie van MCI naar AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Measuring the thickness of the human cerebral cortex from magnetic resonance images. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequentie-onafhankelijke segmentatie van magnetische resonantie beelden. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Corticale oppervlakte-analyse. II: Inflation, afvlakking, en een oppervlakte-gebaseerd coördinatenstelsel. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). Hoge-resolutie intersubject gemiddelden en een coördinaten systeem voor de corticale oppervlak. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., and DeKosky, S. T. (2004). Mild cognitive impairment, amnestisch type: een epidemiologische studie. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). Utility of combinations of biomarkers, cognitive markers, and risk factors to predict conversion from mild cognitive impairment to Alzheimer disease in patients in the Alzheimer’s disease neuroimaging initiative. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld cognitive impairment can be distinguished from alzheimer disease and normal aging for clinical trials. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Predictive validity and diagnostic stability of mild cognitive impairment subtypes. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Association between CSF biomarkers and incipient Alzheimer’s disease in patients with mild cognitive impairment: a follow-up study. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). Verbal fluency performance in dementia of the Alzheimer’s type: a meta-analysis. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R.C., Xu, Y.C., O’Brien, P.C., Smith, G.E., Ivnik, R.J., et al. (1999). Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Gebruik van structurele magnetische resonantie beeldvorming om te voorspellen wie de ziekte van Alzheimer zal krijgen. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidentie en uitkomst van milde cognitieve stoornissen in een bevolkingsgericht prospectief cohort. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). Een korte cognitieve testbatterij om de ziekte van Alzheimer van frontotemporale dementie te onderscheiden. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkers and incipient Alzheimer disease in patients with mild cognitive impairment. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer disease: quantitative structural neuroimaging for detection and prediction of clinical and structural changes in mild cognitive impairment. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversie naar dementie en het APOE genotype: een voorspellende studie met FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Multiple indices of diffusion identifies white matter damage in mild cognitive impairment and Alzheimer’s disease. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Mild cognitive impairment als een diagnostische entiteit. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Mild cognitive impairment: een overzicht. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Mild cognitieve stoornis: klinische karakterisering en uitkomst. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R.C., Stevens, J.C., Ganguli, M., Tangalos, E.G., Cummings, J.L., and DeKosky, S.T. (2001). Praktijk parameter: vroegtijdige opsporing van dementie: mild cognitive impairment (een evidence-based review). Rapport van de subcommissie kwaliteitsnormen van de Amerikaanse academie voor neurologie. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Het verband tussen de spoorzoekerstest en organische hersenbeschadiging. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Zeer nauwkeurige inverse consistente registratie: een robuuste aanpak. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen clinique en psychologie Parijs: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). Een hybride benadering van het schedelstrippingsprobleem in MRI. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Milde cognitieve stoornis: dezelfde identiteit voor verschillende entiteiten. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Monitoring van de vroege tekenen van cognitieve achteruitgang bij ouderen door computerspelletjes: een MRI-studie. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). “Mini Mental State Examination (MMSE),” in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A and B: normatieve gegevens gestratificeerd naar leeftijd en opleiding. Arch. Klin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Coherente spontane activiteit identificeert een hippocampus-pariëtaal geheugen netwerk. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatrische depressieschaal. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Grey matter atrophy of basal forebrain and hippocampus in mild cognitive impairment. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar