- Introducere
- Metode
- Declarație etică
- Participanți
- Achiziționarea și prelucrarea imaginilor RMN
- Proceduri
- Analiză statistică
- Rezultate
- Diferențe în volumele corticale, grosimea corticală și performanța cognitivă între subiecții cu amci, namci și controale
- Analize corelaționale
- Discuție
- Limitări
- Concluzii
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
Introducere
Turbările neurocognitive majore (NCD) sau demența, inclusiv boala Alzheimer (AD) sunt o problemă devastatoare a societății noastre îmbătrânite, având o povară socială, economică și medicală imensă. Deoarece nu dispunem în prezent de un tratament eficient pentru NCD, cercetările recente s-au concentrat pe detectarea simptomelor timpurii. Dovezile convergente din numeroase studii recente au arătat că procesul patologic al bolii Alzheimer începe cu zeci de ani înainte de apariția primelor simptome de declin cognitiv (Mattsson et al., 2009). Stadiul intermediar dintre declinul cognitiv așteptat în cazul îmbătrânirii fiziologice și declinul sever al demenței, cunoscut sub numele de „tulburări cognitive ușoare” (MCI), a stârnit un interes deosebit. „În cazul MCI, afectarea ușoară a abilităților cognitive poate fi evidențiată prin teste neuropsihologice, în timp ce funcțiile cognitive globale și activitățile zilnice sunt păstrate” (Petersen, 2004). Rata mai mare de conversie în NCD în cazul MCI dă semnificația clinică a acestei stări de pre-boală. Rata de conversie în NCD este de 10-15% anual în cazul MCI, comparativ cu rata anuală de 1-4% în cazul populației vârstnice medii (Petersen et al., 2001; Bischkopf et al., 2002). Majoritatea acestor pacienți dezvoltă AD clinic. Trebuie remarcat faptul că MCI ar putea fi, de asemenea, o afecțiune stabilă sau inversă care nu evoluează spre demență. Studiile epidemiologice longitudinale au raportat o rată de conversie variabilă și o revenire relativ frecventă la o cogniție normală (Larrieu et al., 2002; Ganguli et al., 2004). Diferite constatări sugerează instabilitate în acuratețea diagnosticului și necesitatea unei identificări mai specifice între pacienții cu MCI (Han et al., 2012). Având în vedere cele de mai sus, este de înțeles că mai multe studii vizează simptomele și diferențele față de populația medie care sunt strâns legate de dezvoltarea demenței și, prin urmare, pot fi utilizate pentru a ajuta la diagnosticarea precoce.
Pacienții cu MCI pot fi clasificați în continuare în MCI amnestic (aMCI) și MCI non-amnestic (naMCI). În aMCI, pierderea de memorie este predominantă și este asociată cu un risc ridicat de conversie ulterioară în AD (Grundman, 2004). Indivizii care suferă de o AMC naMCI au deficiențe în alte domenii decât memoria și prezintă un risc mai mare de a se transforma în alte forme de demență, cum ar fi demența difuză cu corpuri Lewy. Ambele tipuri pot fi clasificate în continuare în subtipuri cu un singur domeniu și subtipuri cu mai multe domenii, cu toate acestea, în cadrul prezentei investigații nu s-a făcut o clasificare suplimentară din cauza dimensiunii limitate a eșantionului. Au fost testate tipuri semnificative de biomarkeri ai MCI cu scopul de a identifica caracteristicile speciale ale pacienților care convertesc în AD. În timp ce rezultatele biomarkerilor din lichidul cefalorahidian (Hansson et al., 2006) și ale studiilor de tomografie cu emisie de pozitroni (Mosconi et al., 2004) au evidențiat o specificitate și o sensibilitate foarte variată, studiile de imagistică prin rezonanță magnetică structurală au relevat rezultate impresionante (Jack et al., 1999; deToledo-Morrell et al., 2004). În mod interesant, mai multe studii anterioare au investigat diferențele dintre subiecții cu MCI și controalele sănătoase, doar câteva studii au încercat să diferențieze între subtipurile de MCI (Zhang et al., 2011; Serra et al., 2013).
În timp ce aMCI și naMCI sunt entități teoretic diferite, doar câteva investigații au studiat diferențele structurale ale creierului între aceste subtipuri de MCI (Serra et al., 2013). Scopul studiului a fost de a găsi diferențele structurale dintre aMCI și naMCI și de a replica constatările anterioare privind diferențierea dintre aMCI și controalele sănătoase. Pe baza studiilor anterioare privind MCI și conversia la demență, ne-am concentrat pe structurile lobului temporal și ale regiunilor învecinate (Chiang et al., 2011): cortexul entorinal, hipocampul, cortexul parahipocampal, amigdala, girusul fusiform, precuneul, cortexul cingular posterior și istmul girusului cingular.
Metode
Acest studiu este o continuare a lucrării noastre publicate anterior (Sirály et al., 2015). Deoarece în studiul de față a fost utilizată o baterie de teste neuropsihologice similară și aceeași achiziție și procesare RMN, metodele și procedurile au fost descrise în mod similar în ambele lucrări.
Declarație etică
Experimentele au fost efectuate în deplină conformitate cu Declarația de la Helsinki și cu toate orientările etice naționale și internaționale relevante. Cercetarea a fost aprobată de Comitetul Național de Etică, Budapesta, Ungaria. Toate procedurile au fost efectuate numai după ce s-a obținut consimțământul informat în scris al participanților. Toți participanții potențiali care au refuzat să participe sau care nu au participat în alt mod nu au fost dezavantajați în niciun fel prin neparticiparea la studiu.
Participanți
Studiul a fost realizat în cadrul Departamentului de Psihiatrie și Psihoterapie, Universitatea Semmelweis, Budapesta. În total, 62 de subiecți au fost înrolați în studiu. Toți subiecții au aplicat pentru a participa la un program de antrenament cognitiv anunțat în rândul medicilor generaliști și într-un Cămin de bătrâni (Studiul este înregistrat la ClinicalTrials.gov, identificatorul este „NCT02310620”). Toți subiecții au fost capabili să ducă o viață independentă. Datele demografice și neuropsihologice de bază sunt rezumate în tabelul 1.

Tabel 1. Date demografice și rezultatul testelor neuropsihologice de bază.
Subiecții cu aMCI și naMCI, precum și martorii sănătoși au fost incluși în studiu pe baza criteriilor Petersen (Petersen, 2004). Criteriile Petersen includ o plângere subiectivă de memorie coroborată de un informator împreună cu activități zilnice conservate, o afectare a memoriei pe baza unui test neuropsihologic standard, funcții cognitive globale conservate și, în cele din urmă, excluderea demenței. Acesta nu specifică un test neuropsihologic pentru evaluarea tulburărilor de memorie, prin urmare am aplicat testul Rey Auditory Verbal Learning Test (RAVLT), care este cel mai frecvent utilizat pe baza literaturii de specialitate (Gomar et al., 2011). Pentru diferențierea între aMCI și martorii sănătoși am aplicat un scor limită de 1 SD sub media populației standardizată pentru vârstă și sex. Participanții, care au obținut un scor sub valoarea de cutoff fie la subscorul de reamintire întârziată, fie la scorul total, au fost incluși în grupul aMCI. Criteriile aplicate se bazează pe recomandările grupurilor de lucru ale National Institute on Aging-Alzheimer’s Association privind ghidurile de diagnostic pentru boala Alzheimer (Albert et al., 2011). Scorurile limită exacte pentru RAVLT pentru diferitele grupe de vârstă sunt furnizate în tabelul 2A. Subiecții care nu făceau parte din grupul aMCI, dar care au obținut un scor cu 1 SD sub media populației standardizată pentru vârstă și sex/educație, fie la Trail making Test B, fie la Addenbrooke’s Cognitive Examination (ACE), au fost plasați în grupul naMCI. Un criteriu suplimentar pentru grupul naMCI a fost un raport VLOM (scor de fluență verbală + scor de limbaj/ scor de orientare + scor de memorie) mai mic de 3,2 în cadrul ACE pentru a exclude posibilii subiecți aMCI din grupul naMCI (acești subiecți au fost excluși din studiu).

Tabelul 2. (A). Testul de învățare verbală auditivă Rey (Rey Auditory Verbal Learning Test – RAVLT): date normative și scoruri cut-off pentru deficiență cognitivă ușoară (MCI) ajustate în funcție de vârstă; (B) Testul Mini Mental Examination Test (MMSE): scoruri cut-off pentru demență ajustate în funcție de vârstă și educație.
Subiecții cu demență au fost excluși din studiu în funcție de scorurile Mini Mental State Examination (MMSE) standardizate în funcție de vârstă și educație (Strauss et al., 2006b). Scorurile limită exacte pentru MMSE în diferitele grupe de vârstă și educație sunt furnizate în tabelul 2B. Subiecții cu antecedente de traumatism cranian, epilepsie sau accident vascular cerebral, sau cu diagnostic de tulburare psihiatrică acută, schizofrenie sau manie, dependență de alcool au fost, de asemenea, excluși din studiu.
Achiziționarea și prelucrarea imaginilor RMN
Toți subiecții au fost examinați prin RMN cerebral care a produs imagini structurale de înaltă rezoluție, care au fost utilizate pentru prelucrarea și analiza ulterioară. Achizițiile de imagini au fost realizate la Centrul de Cercetare MR, Universitatea Semmelweis, Budapesta, pe un scaner RMN clinic Philips Achieva de 3 Tesla echipat cu o bobină de cap SENSE cu opt canale. Imaginile anatomice de înaltă rezoluție, la nivelul întregului creier, au fost obținute cu ajutorul unei secvențe de ecou de gradient răsfățat tridimensional ponderat T1 (T1W 3D TFE). Au fost achiziționate 180 de felii contigue de la fiecare subiect cu următorii parametri de imagistică: TR = 9,7 ms; TE = 4,6 ms; unghiul de întoarcere = 8°; FOV de 240 × 240 mm; dimensiunea voxelului de 1,0 × 1,0 × 1,0 mm.
Reconstrucția corticală și segmentarea volumetrică au fost realizate de suita de analiză a imaginilor Freesurfer 5.3, care este documentată și disponibilă gratuit pentru descărcare online (http://surfer.nmr.mgh.harvard.edu/). Detaliile tehnice ale acestor proceduri sunt descrise în publicații anterioare, noi nu am făcut nicio modificare la acest pipeline. Pe scurt, procesarea imaginilor include corecția mișcării (Reuter et al., 2010), îndepărtarea țesutului non-cerebral utilizând o procedură hibridă de deformare a bazinului hidrografic/suprafață (Segonne et al., 2004), transformarea automată Talairach, segmentarea materiei albe subcorticale și a structurilor volumetrice ale materiei cenușii profunde (inclusiv hipocampul, amigdala, caudatul, putamenul, ventriculele) (Fischl et al., 2004), normalizarea intensității, teselarea limitei materiei albe a materiei cenușii, corecția automată a topologiei și deformarea suprafeței în urma gradienților de intensitate pentru a plasa în mod optim granițele cenușie/albă și cenușie/ lichid cefalorahidian în locul în care cea mai mare schimbare de intensitate definește tranziția către cealaltă clasă de țesut (Dale et al., 1999; Fischl și Dale, 2000). Odată ce modelele corticale au fost finalizate, Freesurfer a efectuat o serie de proceduri deformabile pentru în continuare prelucrarea și analiza datelor. Etapele au inclus umflarea suprafeței (Fischl et al., 1999a), înregistrarea la un atlas sferic care a utilizat modelele individuale de pliere corticală pentru a potrivi geometria corticală între subiecți (Fischl et al., 1999b), parcelarea cortexului cerebral în unități bazate pe structura girală și sulcală (Fischl et al., 2004) și crearea unei varietăți de date bazate pe suprafață, inclusiv hărți de curbură și adâncime sulcală. În cele din urmă, modelele corticale și rezultatele segmentării au fost verificate din punct de vedere calitativ și corectate manual pe fiecare subiect, însă corecția nu a arătat modificări semnificative ale rezultatelor.
Proceduri
Examinările neuropsihologice au fost efectuate în zilele lucrătoare, între orele 8 a.m. și 4 p.m. Examenele au constat în teste neuropsihologice computerizate (de exemplu, testul PAL) și pe suport de hârtie. Testele au avut loc într-o cameră separată, bine luminată, în care au fost prezenți doar pacientul și un examinator. Testele de referință au fost, de asemenea, completate și evaluate în conformitate cu recomandările Compendiului neuropsihologic (Strauss et al., 2006a), în timp ce testele computerizate au fost evaluate de software.
Testele neuropsihologice au fost administrate de doi studenți la medicină instruiți anterior, sub supravegherea unui psiholog și a unui psihiatru. În timpul evaluării testelor au fost respectate liniile directoare ale Compendiului neuropsihologic (Strauss et al., 2006a). Testele pe suport de hârtie au fost evaluate de același psiholog și de un psihiatru în conformitate cu compendiumul. Testele de învățare cu asociați perechi (Paired Associates Learning Test – PAL) au fost evaluate automat de un software. Datele MR au fost, de asemenea, analizate și evaluate automat de software-ul Freesurfer și SAS; prin urmare, nu au fost implicate judecăți subiective în analiza datelor de neuroimagistică. Deoarece evaluarea și evaluarea testului PAL și a datelor de neuroimagistică au fost total automate, prejudecățile cauzate de judecățile umane au fost scăzute (limitate doar la evaluarea testelor pe hârtie).
Subiecții cu demență au fost excluși din studiu pe baza Mini Mental State Examination (MMSE). MMSE este un test standard; eficacitatea sa a fost dovedită de mai multe studii, fiind o metodă utilă în diferențierea subiecților cu demență de controalele sănătoase (Petersen et al., 1999; Gomar et al., 2011). Majoritatea studiilor anterioare au utilizat scorul limită de 26 sau scorul ajustat în funcție de vârstă pentru demență. Subacțiunile testului evaluează orientarea, funcția executivă centrală, formarea rapidă a asocierilor, capacitatea de identificare verbală și capacitatea de analiză și sinteză.
Examinarea cognitivă Addenbrooke’s Cognitive Examination a fost utilizată pentru a evalua performanța cognitivă globală, inclusiv orientarea, atenția, memoria, fluența verbală, abilitățile verbale și visuospațiale (Mathuranath et al., 2000; Alexopoulos et al., 2010).
Testul de învățare verbală auditivă Rey a fost utilizat pentru evaluarea detaliată a funcțiilor memoriei pe baza criteriilor Petersen. Testul Rey evaluează învățarea și memoria verbală (Rey, 1958). O listă de 15 cuvinte (lista A) trebuie să fie repetată imediat de către subiect. Acest test se repetă de 5 ori. Apoi este prezentată o dată o altă listă de 15 cuvinte (lista B sau lista de interferență) care trebuie reamintită. Apoi, lista A ar trebui să fie reamintită fără a se repeta, iar apoi această sarcină se repetă după 30 de minute.
Testul Trail Making, Partea A și Partea B (conexiune numerică; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) este utilizat pentru a evalua atenția selectivă, funcțiile executive și flexibilitatea cognitivă. În partea A, numerele distribuite la întâmplare trebuie conectate în ordine numerică, în timp ce în partea B sunt afișate numere și litere distribuite la întâmplare. Subiectul este instruit să conecteze numerele și literele într-o ordine prestabilită. Variabila dependentă este timpul necesar pentru a finaliza testul. Partea A a TMT măsoară funcțiile executive și atenția, în timp ce în performanța la partea B este reflectată și flexibilitatea cognitivă.
Rezultatele testelor neuropsihologice sunt rezumate în tabelul 1.
Toți participanții au completat un formular în care și-au evaluat propria stare de sănătate și funcția memoriei; în plus, au trebuit să raporteze despre utilizarea calculatorului și a internetului, activitățile recreative, consumul de alcool, obiceiurile alimentare și fumatul (Yesavage, 1988). Scala de depresie geriatrică (GDS) a fost utilizată pentru a evalua simptomele depresive, în timp ce simptomele de anxietate au fost măsurate cu ajutorul Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
Memoria vizuospațială a fost măsurată printr-o implementare a testului PAL utilizat în mai multe baterii de teste neuropsihologice (Siraly et al., 2013). „În testul PAL, ferestrele se deschid în poziții aleatorii pe ecran, una după alta, timp de 3 s, cu forme abstracte afișate în una sau mai multe ferestre. Alte ferestre rămân goale în funcție de nivelul de dificultate. După ce au fost afișate toate pătratele, formele afișate anterior apar în centrul ecranului, iar participanții trebuie să decidă în ce fereastră au văzut forma respectivă înainte. Testul constă din cinci niveluri diferite în opt etape în total, numărul de forme crește de la 1 la 8 în diferitele etape. Subiecții aveau la dispoziție 10 încercări pentru a finaliza o anumită etapă, în caz contrar testul se încheia. Aranjamentul ferestrelor a fost asimetric în cadrul testului și s-a schimbat de la o etapă la alta.” (Siraly et al., 2013) În timpul testului computerizat subiecții au fost așezați confortabil la o distanță de o jumătate de metru față de ecranul computerului și în urma unor informații prealabile au rezolvat sarcinile cu ajutorul unui mouse.
Analiză statistică
Diferențele dintre grupurile de studiu în ceea ce privește volumele cerebrale, grosimea corticală și performanța cognitivă au fost analizate prin analiza modelului general liniar (GLM în SAS 9.2) cu vârsta și sexul ca și covariate. Volumele au fost standardizate pentru volumul intracranian total (TIV) și sunt date în procente. Pentru a analiza diferențele dintre grupuri s-au aplicat comparații t post hoc, unde valorile p au fost ajustate la 0,05/3 = 0,016, unde trei reprezintă numărul de comparații între grupuri.
Relația dintre rezultatele testelor neuropsihologice și dimensiunea structurilor SNC au fost analizate prin corelații Pearson. Corelațiile cu numărul de etape parcurse în testul PAL au fost analizate prin corelația Spearman, deoarece distribuția acestei variabile a deviat în mare măsură de la distribuția normală.
Rezultate
Diferențe în volumele corticale, grosimea corticală și performanța cognitivă între subiecții cu amci, namci și controale
A fost găsită o diferență semnificativă în volumul hipocampusului și în volumul cortexului entorhinal între grupurile de studiu . Testele post hoc au arătat că volumele sunt semnificativ diminuate în grupul aMCI în raport cu controalele și cu grupul naMCI, în timp ce celelalte două grupuri nu diferă semnificativ (Tabelul 3 și Figura 1) Printre covariate, sexul a avut un efect semnificativ asupra volumului hipocampusului, subiecții de sex masculin au avut o dimensiune a hipocampusului semnificativ diminuată în raport cu femeile .
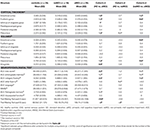
Tabelul 3. Diferențe ale structurilor SNC și ale rezultatelor testelor neuropsihologice între grupurile de studiu.
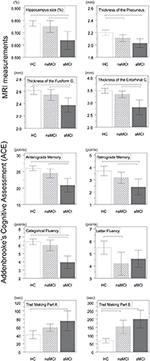
Figura 1. Diferențe între grupuri în ceea ce privește structurile SNC și testele neuropsihologice. Barele verticale reprezintă mediile de grup, în timp ce barele de eroare reprezintă deviațiile standard. Liniile orizontale peste barele verticale indică diferențele semnificative între grupuri după corecția pentru comparații multiple (p < 0,016). HC, controale sănătoase; aMCI, deficiență cognitivă ușoară amnestică; naMCI, deficiență cognitivă ușoară non-amnestică; SNC, sistem nervos central.
Grosimea medie a cortexului entorinal , a girusului fusiform , a istmului girusului cingulat și a precuneusului diferă, de asemenea, în mod semnificativ între grupurile de studiu. Conform testelor post-hoc, s-a constatat o scădere a grosimii corticale la aMCI în raport cu controalele în toate cele patru structuri, în timp ce grosimea cortexului entorinal și a girusului fusiform au fost, de asemenea, semnificativ reduse în grupul aMCI în raport cu grupul naMCI. Mediile de grup, rezultatele testelor post-hoc și diferențele dintre grupuri în termeni de Cohen’s d sunt rezumate în tabelul 3.
A existat o diferență semnificativă între grupurile de studiu în memoria anterogradă , memoria retrogradă , fluența categorială . În memoria anterogradă și fluența categorială, atât grupul de control, cât și grupul naMCI au depășit grupul aMCI, în timp ce primele grupuri nu au prezentat diferențe semnificative (tabelul 3). În memoria retrogradă, controalele au depășit grupul aMCI, dar nu și grupul naMCI. În ceea ce privește fluența literelor, controalele au surclasat grupul naMCI, dar nu și grupul aMCI, în timp ce cele două grupuri MCI nu au diferit unul de celălalt (p > 0,05). Mai mult, în fluența categorială, subiecții de sex feminin au performat mai bine decât cei de sex masculin , în timp ce vârsta nu a avut un efect semnificativ asupra performanței.
Analize corelaționale
În întregul eșantion au fost găsite corelații puternice între rezultatele testelor neuropsihologice și volumul și grosimea structurilor cerebrale temporale (Tabelul 4).

Tabel 4. Corelații între structurile SNC și rezultatele testelor neuropsihologice la nivelul întregului eșantion.
În grupul aMCI, rezultatul Testului de învățare verbală Rey a prezentat o corelație pozitivă semnificativă cu dimensiunea amigdalei (r = 0,47, n = 20, p = 0,03), și cu grosimea cortexului entorinal (r = 0,46, n = 20, p = 0,04; Figura 2). Subiecții cu volume reduse ale amigdalei și grosime entorhinală scăzută au prezentat performanțe mai slabe la testul de memorie.

Figura 2. Corelația dintre performanța memoriei pe termen scurt, indexată de testul de învățare verbală Rey, și volumul amigdalei și grosimea cortexului entorhinal în grupurile de studiu. Corelațiile Pearson au fost semnificative (p < 0,05) în grupul MCI amnezic și în întregul eșantion, în timp ce au fost nesemnificative în grupul de control și în grupurile MCI non-amnezice. Scorul total al testului verbal Rey de pe axele verticale este egal cu suma cuvintelor din primele cinci încercări. linia roșie, linia de regresie în grupul aMCI; linia punctată, linia de regresie în întregul eșantion; MCI, deficiență cognitivă ușoară; r și p, coeficientul de corelație Pearson ajustat în funcție de vârstă și nivelul corespunzător de semnificație în grupul aMCI.
În plus, subiecții cu volume entorhinale reduse (r = 0,49, n = 19, p = 0,03) și volume reduse ale girusului fusiform (r = 0,48, n = 19, p = 0,04) și grosimea corticală fusiformă (r = 0,04).53, n = 19, p = 0,02) au avut performanțe mai slabe în subtestul de memorie retrogradă al ACE.
Discuție
MCI amnestic și non-amnestic au fost atribuite ca potențiale prodromi la diferite tipuri de NCD. Se presupune că subiecții cu insuficiență cognitivă ușoară amnestică au un risc mai mare de a se transforma în demență Alzheimer, în timp ce subiecții cu insuficiență cognitivă ușoară non-amnestică se spune că au un risc mai mare de a se transforma în demență non-Alzheimer (Petersen et al., 1999; Killiany et al., 2000; Petersen și Negash, 2008).
Diferențele structurale ale creierului au fost examinate prin RMN în subgrupurile MCI și în grupul de control sănătos, în timp ce diferențele în performanța cognitivă au fost investigate prin teste neuropsihologice. Conform rezultatelor RMN, grosimea cortexului entorinal, a girusului fusiform, a istmului girusului cingular și a precuneusului, precum și volumul amigdalei și al hipocampusului au fost reduse în cazul aMCI în raport cu controalele sănătoase. Aceste constatări sunt în concordanță cu studiile anterioare care au raportat că subiecții sănătoși, pacienții cu MCI sau cu boala Alzheimer pot fi diferențiați unii de alții pe baza volumelor structurilor lobului temporal, cum ar fi amigdala sau hipocampul (Desikan et al., 2009; McEvoy et al., 2009).
Volumele hipocampusului și cortexului entorhinal, precum și grosimea cortexului entorhinal și a girusului fusiform sunt semnificativ diminuate în grupul aMCI în raport cu grupul naMCI. Cea mai mare diferență între grupuri a fost detectată în volumul și grosimea cortexului entorinal (0,9 și, respectiv, 1,2 SD), ceea ce este în concordanță cu faptul că atrofia în AD începe în această regiune. Aceste rezultate arată că există diferențe structurale timpurii între subtipurile de MCI. În plus, modelul acestor constatări structurale se potrivesc cu patologia bolii Alzheimer (Braak și Braak, 1991), ceea ce subliniază acele rezultate anterioare care arată că aMCI evoluează spre boala Alzheimer cu o frecvență mai mare în raport cu naMCI (Killiany et al., 2000; Petersen și Negash, 2008).
Comparând grupul de control și grupul naMCI, s-a constatat o diferență semnificativă doar în grosimea precuneusului, care a fost scăzută în grupul naMCI. Interesant este faptul că un studiu recent a găsit leziuni ale substanței albe la pacienții cu naMCI și în precuneus (O’Dwyer et al., 2011), care este un nod important care susține transferul de informații între girusul parahipocampal și cortexul prefrontal (Vincent et al., 2006) și joacă un rol important în procesul de memorie și imaginarul vizual.
Printre testele neuropsihologice, MMSE nu a fost diferit între grupurile de studiu, ceea ce este o consecință probabilă a excluderii pacienților cu demență. La subtestele ACE total, ACE memorie anterogradă și ACE fluență categorială, grupul aMCI a avut performanțe mai slabe în raport cu grupul naMCI și cu grupul de control sănătos. În testul de memorie retrogradă al ACE și în testele Trail Making A și B, grupul aMCI a avut performanțe mai slabe doar față de controalele sănătoase, în timp ce nu a fost detectată nicio diferență între cele două subgrupuri MCI. Performanța scăzută la sarcinile de memorie (RAVLT și sarcina de memorie retrogradă ACE) în grupul aMCI s-a corelat cu implicarea crescută a structurilor lobului temporal, cum ar fi cortexul entorinal, și amigdala (Figura 2), ceea ce confirmă și mai mult rezultatele noastre privind diferențele dintre grupuri.
În sarcina de fluență a literelor, grupul naMCI a avut performanțe mai slabe decât grupul sănătos, în timp ce grupul aMCI nu a fost diferit de celelalte grupuri. Testul Trail making B este un indice al atenției vizuale și al schimbării sarcinilor. Performanța scăzută a ambelor grupuri MCI în raport cu controalele (tabelul 3) este probabil rezultatul implicării frontale. Atât sarcinile de fluență a categoriilor, cât și cele de fluență a literelor se bazează puternic pe funcționarea lobului frontal, inclusiv procesele executive care necesită ca subiecții să organizeze recuperarea, să monitorizeze răspunsurile reamintite anterior, să inițieze răspunsuri verbale și să inhibe răspunsurile care nu se încadrează în criterii (Henry et al., 2004). „Ambele măsuri accesează, de asemenea, stocurile de memorie semantică, o funcție a lobului temporal; deși fluența literelor pare să exploateze această capacitate legată de lobul temporal într-o măsură mai mică decât fluența categoriilor” (Lezak et al., 2004). Studiile de imagistică cerebrală lezionară și funcțională susțin, de asemenea, implicarea lobilor temporali și frontali în capacitatea de fluență. Studiile fMRI anterioare au arătat că fluența literelor este asociată cu o activare crescută în lobii frontali, în timp ce atât lobii frontali, cât și cei temporali sunt activi în timpul fluenței categoriale (Birn et al., 2010). Acest lucru corespunde bine cu constatările noastre că aMCI diferă semnificativ în funcție de fluența categorială în comparație cu grupul sănătos și naMCI, în timp ce nu există nicio diferență semnificativă între cele două subgrupuri în ceea ce privește rezultatul fluenței literelor.
S-au găsit corelații puternice între funcțiile memoriei verbale și vizuale, indexate de testele RAVLT și PAL, și volumele și grosimea corticală a structurilor temporale, cum ar fi cortexul entorral (Tabelul 4) în întregul eșantion și, de asemenea, în grupul aMCI (Figura 2). Aceste constatări validează încrucișat utilitatea acestor markeri neuropsihologici și IRM în diagnosticarea precoce a declinului cognitiv patologic și în monitorizarea progresiei bolii.
Limitări
O limitare a studiului este că majoritatea subiecților din grupul aMCI au fost de tip multidomeniu, deoarece performanțele lor în funcțiile executive, evaluate prin testul de realizare a traseelor B și testul ACE, au fost sub limitele normale. Această limitare luată împreună cu faptul că naMCI este o entitate mai eterogenă în raport cu aMCI poate explica de ce studiul actual nu a reușit să găsească structuri ale SNC cu dimensiuni reduse în grupul naMCI în raport cu grupul aMCI.
Concluzii
Numele de aMCI și naMCI nu sunt doar teoretice, ci aceste subtipuri sunt entități diferite atât din punct de vedere neuropsihologic, cât și din punct de vedere structural cerebral. Elaborarea unor criterii IRM și neuropsihologice specifice pentru diferitele subtipuri de tulburări cognitive ușoare va face apoi posibilă evaluarea factorilor determinanți și a prevalenței subtipurilor de MCI.
Asemnarea subtipurilor de MCI va fi utilă pentru a îmbunătăți predicția tipului de demență și a riscului de conversie în demență. Mai mult, atribuirea subtipurilor de MCI poate oferi o abordare mai bună pentru testarea eficacității opțiunilor terapeutice în prevenirea conversiei la tulburări neurocognitive. Pe baza rezultatelor noastre, IRM poate fi un instrument util pentru separarea mai precisă între subtipurile de MCI.
Contribuții ale autorilor
GC a proiectat studiul, a scris protocolul, a întreprins analiza statistică, a creat figurile și a scris prima versiune a manuscrisului ES a participat la efectuarea măsurătorilor, a gestionat căutările și analizele literaturii și a scris prima versiune a introducerii și a concluziei. ÁS a contribuit la finalizarea tuturor secțiunilor manuscrisului. ZF, AH au participat la executarea măsurătorilor și au contribuit la redactarea secțiunii privind metodele. ÉC, PS, ZH, GR au asigurat supravegherea experimentelor pe parcursul studiului, inclusiv la redactarea manuscrisului. Toți autorii au contribuit și au aprobat manuscrisul final.
Finanțare
Studiul a fost susținut de grantul „Ambient Assisted Living Joint Programme (AAL)-Call 2” (Identificatorul proiectului: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | Full CrossRef Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validarea examenului cognitiv german revizuit al lui Addenbrooke pentru detectarea tulburărilor cognitive ușoare, a demenței ușoare în boala Alzheimer și a degenerării lobare frontotemporale. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Sisteme neuronale care susțin căutarea lexicală ghidată de indicii de litere și categorii semantice: un studiu RMN fMRI de fluență verbală cu răspuns deschis în ritm propriu. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Deficiența cognitivă ușoară – o revizuire a prevalenței, incidenței și rezultatelor în conformitate cu abordările actuale. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., și Braak, E. (1991). Etapizarea neuropatologică a modificărilor legate de Alzheimer. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | Full CrossRef Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identificarea persoanelor vârstnice sănătoase din punct de vedere cognitiv cu declin ulterior al memoriei prin utilizarea volumelor temporoparietale MR automate. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., și Sereno, M. I. (1999). Analiza bazată pe suprafața corticală. I. Segmentarea și reconstrucția suprafețelor. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Măsurile RMN automatizate identifică persoanele cu tulburări cognitive ușoare și boala Alzheimer. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | Full CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). Volumul entorhinal derivat din RMN este un bun predictor al conversiei de la MCI la AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Măsurarea grosimii cortexului cerebral uman din imaginile de rezonanță magnetică. Proc. Natl. acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Segmentarea independentă de secvență a imaginilor de rezonanță magnetică. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., și Dale, A. M. (1999a). Analiza bazată pe suprafața corticală. II: Inflația, aplatizarea și un sistem de coordonate bazat pe suprafață. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., și Dale, A. M. (1999b). Mediile intersubiect de înaltă rezoluție și un sistem de coordonate pentru suprafața corticală. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | Publicitate | Text integral | Google Scholar
Ganguli, M., Dodge, H. H. H., Shen, C., și DeKosky, S. T. (2004). Deficiență cognitivă ușoară, tip amnestic: un studiu epidemiologic. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., și Goldberg, T. E. (2011). Utilitatea combinațiilor de biomarkeri, markeri cognitivi și factori de risc pentru a prezice conversia de la tulburări cognitive ușoare la boala Alzheimer la pacienții din inițiativa de neuroimagistică a bolii Alzheimer. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). Tulburarea cognitivă ușoară poate fi distinsă de boala Alzheimer și de îmbătrânirea normală pentru studiile clinice. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J. J., Huh, Y., et al. (2012). Validitatea predictivă și stabilitatea diagnostică a subtipurilor de tulburări cognitive ușoare. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | Reflect Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., și Minthon, L. (2006). Asocierea dintre biomarkerii CSF și boala Alzheimer incipientă la pacienții cu tulburări cognitive ușoare: un studiu de urmărire. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | Textul integral | Google Scholar
Henry, J. D., Crawford, J. R., și Phillips, L. H. (2004). Performanța fluenței verbale în demența de tip Alzheimer: o meta-analiză. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr., Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Predicția AD cu ajutorul volumului hipocampal bazat pe RMN în cazul tulburărilor cognitive ușoare. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Utilizarea imagisticii prin rezonanță magnetică structurală pentru a prezice cine va avea boala Alzheimer. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidența și rezultatul tulburărilor cognitive ușoare într-o cohortă prospectivă bazată pe populație. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., și Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., și Hodges, J. R. (2000). O baterie de teste cognitive scurte pentru a diferenția boala Alzheimer și demența frontotemporală. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). Biomarkeri CSF și boala Alzheimer incipientă la pacienții cu tulburări cognitive ușoare. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | Full CrossRef Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Boala Alzheimer: neuroimagistica structurală cantitativă pentru detectarea și predicția modificărilor clinice și structurale în cazul tulburărilor cognitive ușoare. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract |Ref Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). Conversia MCI în demență și genotipul APOE: un studiu de predicție cu FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Indicii multipli de difuzie identifică leziunile materiei albe în cazul tulburărilor cognitive ușoare și al bolii Alzheimer. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | Ref Full Text | Google Scholar
Petersen, R. C. (2004). Deficiența cognitivă ușoară ca entitate diagnostică. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | Text integral | Google Scholar
Petersen, R. C., și Negash, S. (2008). Deficiența cognitivă ușoară: o prezentare generală. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., și Kokmen, E. (1999). Tulburarea cognitivă ușoară: caracterizare clinică și rezultate. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., și DeKosky, S. T. (2001). Parametru de practică: depistarea precoce a demenței: tulburări cognitive ușoare (o revizuire bazată pe dovezi). Raport al subcomitetului pentru standarde de calitate al Academiei Americane de Neurologie. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Relația dintre testul de realizare a traseelor și leziunile cerebrale organice. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Înregistrare consecventă inversă extrem de precisă: o abordare robustă. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A hybrid approach to the skull stripping problem in MRI. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Tulburarea cognitivă ușoară: aceeași identitate pentru entități diferite. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Monitorizarea semnelor timpurii ale declinului cognitiv la vârstnici prin intermediul jocurilor pe calculator: un studiu RMN. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013) . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., și Lushene, R. (1970). Manual pentru State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., și Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., și Spreen, O. (eds.). (2006b). „Mini Mental State Examination (MMSE)”, în Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A și B: date normative stratificate în funcție de vârstă și educație. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Activitatea spontană coerentă identifică o rețea de memorie hipocampală-parietală. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Scala de depresie geriatrică. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Atrofia materiei cenușii a creierului anterior bazal și a hipocampusului în cazul tulburărilor cognitive ușoare. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | Text integral | Google Scholar
.