- Introduction
- Métodos
- Declaração Ética
- Participantes
- MR Aquisição e Processamento de Imagem
- Procedimentos
- Análise Estatística
- Resultados
- Diferenças nos Volumes Corticais, Espessura Cortical e Desempenho Cognitivo entre Sujeitos com amci, namci e Controles
- Análises correlacionais
- Discussão
- Limitações
- Conclusões
- Contribuições dos autores
- Funding
- Conflict of Interest Statement
Introduction
Major neurocognitive disorders (NCD) or dementia including Alzheimer’s disease (AD) are a devastating problem of our aging society having tremendous social, economic and medical burden. Uma vez que não temos tratamento eficaz para o DANT no momento, pesquisas recentes têm se concentrado na detecção de sintomas precoces. Evidências convergentes de muitos estudos recentes revelaram que o processo patológico da DC começa décadas antes dos primeiros sintomas de declínio cognitivo (Mattsson et al., 2009). O estágio intermediário entre o declínio cognitivo esperado do envelhecimento fisiológico e o declínio severo da demência conhecido como “leve comprometimento cognitivo” (ICM) tem ganho muito interesse. “No ICM, o leve comprometimento das habilidades cognitivas pode ser revelado por testes neuropsicológicos, enquanto as funções cognitivas globais e as atividades diárias são preservadas” (Petersen, 2004). A maior taxa de conversão para CCN no ICM dá o significado clínico desta condição pré-doença. A taxa de conversão para DNC é de 10-15% anualmente no ICM em comparação com a taxa anual de 1-4% na população idosa média (Petersen et al., 2001; Bischkopf et al., 2002). A maioria destes pacientes desenvolve DA clínica. Deve-se notar que o ICM também pode ser uma condição estável ou reversa, não progredindo para demência. Estudos epidemiológicos longitudinais relataram taxa de conversão de variantes e uma reversão relativamente freqüente para cognição normal (Larrieu et al., 2002; Ganguli et al., 2004). Diferentes achados sugerem instabilidade na precisão diagnóstica e uma necessidade de identificação mais específica entre os pacientes com ICM (Han et al., 2012). Em vista do exposto acima, é compreensível que vários estudos tenham como alvo os sintomas e diferenças da população média que estão intimamente ligados ao desenvolvimento da demência e, portanto, podem ser utilizados para auxiliar no diagnóstico precoce.
Patientes com ICM podem ser categorizados como ICM amnésticos (IMCA) e ICM não amnésticos (IMCNAM). NaMCI a perda de memória é predominante e está associada com alto risco de conversão para AD (Grundman, 2004). Indivíduos com naMCI têm deficiências em outros domínios além da memória e têm um risco maior de conversão para outras formas de demência, como a demência difusa do corpo Lewy. Ambos os tipos podem ser categorizados em subtipos de domínio único e multi-domínio, no entanto, na presente investigação não foi feita qualquer categorização adicional devido ao tamanho limitado da amostra. Tipos significativos de biomarcadores de ICM têm sido testados com o objetivo de identificar as características especiais dos pacientes que conversam em AD. Enquanto os resultados dos biomarcadores do líquor (Hansson et al., 2006) e os estudos de tomografia por emissão de pósitrons (Mosconi et al., 2004) apontaram uma especificidade e sensibilidade altamente variantes, os estudos de ressonância magnética estrutural revelaram resultados impressionantes (Jack et al., 1999; deToledo-Morrell et al., 2004). Curiosamente, vários estudos anteriores investigaram as diferenças entre sujeitos com ICM e controles saudáveis, apenas alguns estudos tentaram diferenciar entre os subtipos de ICM (Zhang et al., 2011; Serra et al., 2013).
Embora aMCI e naMCI sejam entidades teoricamente diferentes, apenas algumas investigações estudaram as diferenças estruturais cerebrais entre estes subtipos de ICM (Serra et al., 2013). O objetivo do estudo foi encontrar as diferenças estruturais entre aMCI e naMCI, e replicar os achados anteriores sobre a diferenciação entre aMCI e controles saudáveis. Com base em estudos anteriores sobre ICM e conversão para demência, focalizamos estruturas do lobo temporal e das regiões vizinhas (Chiang et al, 2011): o córtex entorhinal, o hipocampo, o córtex parahipocampal, a amígdala, o giro fusiforme, o precuneus, o córtex cingulado posterior e o istmo do giro cingulado.
Métodos
Este estudo é uma continuação do nosso trabalho publicado anteriormente (Sirály et al., 2015). Desde uma bateria de testes neuropsicológicos similares, e o mesmo pipeline de aquisição e processamento de ressonância magnética tem sido usado no presente estudo, métodos e procedimentos têm sido descritos de forma similar em ambos os trabalhos.
Declaração Ética
Os experimentos foram conduzidos em total conformidade com a Declaração de Helsinki e todas as diretrizes éticas nacionais e internacionais relevantes. A pesquisa foi aprovada pelo Comitê Nacional de Ética, Budapeste, Hungria. Todos os procedimentos foram realizados somente após a obtenção do consentimento livre e esclarecido por escrito dos participantes. Todos os potenciais participantes que se recusaram a participar ou não participaram não foram prejudicados de forma alguma pela não participação no estudo.
Participantes
O estudo foi realizado no Departamento de Psiquiatria e Psicoterapia, Universidade Semmelweis, Budapeste. Ao todo 62 sujeitos foram matriculados no estudo. Todos os sujeitos aplicaram para participar de um programa de treinamento cognitivo anunciado entre clínicos gerais e em uma casa de repouso (O estudo está registrado no ClinicalTrials.gov, o identificador é “NCT02310620”). Todos os sujeitos foram capazes de levar uma vida independente. Os dados demográficos e neuropsicológicos básicos estão resumidos na Tabela 1.

Tábua 1. Dados demográficos e resultado dos testes neuropsicológicos básicos.
Subjetos com aMCI e naMCI, e controles saudáveis foram incluídos no estudo com base nos critérios de Petersen (Petersen, 2004). Os critérios de Petersen incluem a queixa de memória subjetiva corroborada por um informante juntamente com atividades cotidianas preservadas, um comprometimento da memória baseado em um teste neuropsicológico padrão, funções cognitivas globais preservadas e, finalmente, a exclusão da demência. Ele não especifica um teste neuropsicológico para a avaliação do comprometimento da memória, por isso aplicamos o teste Rey Auditory Verbal Learning Test (RAVLT), que é o teste mais frequentemente utilizado com base na literatura (Gomar et al., 2011). Para a diferenciação entre aMCI e controles saudáveis, aplicamos um escore de corte de 1 DP sob a média populacional padronizada para idade e sexo. Os participantes, que obtiveram pontuação abaixo do valor de corte, seja no subscrito de recall tardio ou na pontuação total, foram colocados no grupo aMCI. Os critérios aplicados baseiam-se nas recomendações dos grupos de trabalho do National Institute on Aging-Alzheimer’s Association sobre diretrizes diagnósticas para o mal de Alzheimer (Albert et al., 2011). Os resultados exatos do corte para o RAVLT para os diferentes grupos etários são fornecidos na Tabela 2A. Sujeitos que não estavam no grupo aMCI, mas que obtiveram 1 DP sob a média da população padronizada para idade e sexo/educação tanto no Teste de triagem B quanto no Exame Cognitivo de Addenbrooke (ACE), foram colocados no grupo naMCI. Um critério adicional para o grupo naMCI foi uma relação inferior a 3,2 VLOM (fluência verbal + pontuação/orientação linguística + pontuação de memória) no ACE para excluir possíveis sujeitos aMCI do grupo naMCI (estes sujeitos foram excluídos do estudo).

Tábua 2. (A). Rey Teste de Aprendizagem Auditiva Verbal (RAVLT): dados normativos e escores de corte para o Mild Cognitive Impairment (MCI) ajustados para a idade; (B) Mini Teste de Exame Mental (MMSE): escores de corte para demência ajustados para idade e escolaridade.
Subjectos com demência foram excluídos do estudo de acordo com os escores do Mini Exame de Estado Mental (MMSE) padronizados para idade e escolaridade (Strauss et al., 2006b). Os escores exatos de corte para o MMSE nos diferentes grupos de idade e escolaridade são fornecidos na Tabela 2B. Os sujeitos com história de trauma craniano, epilepsia ou acidente vascular cerebral, ou diagnóstico de distúrbio psiquiátrico agudo, esquizofrenia ou mania, dependência de álcool também foram excluídos do estudo.
MR Aquisição e Processamento de Imagem
Todos os sujeitos foram examinados por RM do cérebro produzindo imagens estruturais de alta resolução, que foram usadas para processamento e análise posterior. As aquisições de imagens foram feitas no Centro de Pesquisa de RM, Universidade Semmelweis, Budapeste, em um scanner de RM clínica Philips Achieva de 3 Tesla, equipado com uma bobina de cabeça SENSE de oito canais. As imagens anatômicas cerebrais inteiras de alta resolução foram obtidas usando uma seqüência de eco de gradiente estragado tridimensional (T1W 3D TFE). Foram adquiridas 180 fatias contíguas de cada sujeito com os seguintes parâmetros de imagem: TR = 9,7 ms; TE = 4,6 ms; ângulo de viragem = 8°; FOV de 240 × 240 mm; tamanho de voxel de 1,0 × 1,0 × 1,0 mm.
Construção cortical e segmentação volumétrica foram realizadas pelo conjunto de análise de imagens Freesurfer 5.3, que está documentado e disponível gratuitamente para download online (http://surfer.nmr.mgh.harvard.edu/). Os detalhes técnicos destes procedimentos estão descritos em publicações anteriores, não fizemos alterações a este pipeline. Em resumo, o processamento da imagem inclui a correção do movimento (Reuter et al., 2010), remoção de tecido não cerebral usando um procedimento híbrido de deformação da bacia hidrográfica/superfície (Segonne et al., 2004), transformação automatizada do Talairach, segmentação da matéria branca subcortical e estruturas volumétricas de matéria cinzenta profunda (incluindo hipocampo, amígdala, caudato, putamen, ventrículos) (Fischl et al, 2004) normalização da intensidade, tesselação do limite de matéria cinzenta, correção automática da topologia e deformação da superfície seguindo gradientes de intensidade para colocar de forma ideal as bordas cinza/branco e cinza/fluído cerebroespinhal no local onde a maior mudança de intensidade define a transição para a outra classe tecidual (Dale et al., 1999; Fischl e Dale, 2000). Uma vez completados os modelos corticais, Freesurfer realizou uma série de procedimentos deformáveis para processamento e análise de dados adicionais. As etapas incluíram inflação superficial (Fischl et al., 1999a), registro em um atlas esférico que utilizou padrões individuais de dobras corticais para combinar a geometria cortical entre sujeitos (Fischl et al., 1999b), parcelamento do córtex cerebral em unidades baseadas na estrutura giroscópica e sulcal (Fischl et al., 2004), e criação de uma variedade de dados baseados na superfície, incluindo mapas de curvatura e profundidade sulcal. Finalmente os modelos corticais e os resultados da segmentação foram verificados e corrigidos manualmente em cada assunto, porém a correção não mostrou alterações significativas nos resultados.
Procedimentos
Os exames neuropsicológicos foram realizados em dias úteis entre 8h e 16h. Os exames foram realizados em uma sala separada bem iluminada, onde apenas o paciente e um examinador estavam presentes. Os testes de referência também foram concluídos e avaliados de acordo com as recomendações do Compêndio Neuropsicológico (Strauss et al., 2006a), enquanto os testes computadorizados foram avaliados pelo software.
Testes neuropsicológicos foram administrados por dois estudantes de medicina previamente treinados sob a supervisão de um psicólogo e um psiquiatra. Durante a avaliação dos testes foram seguidas as orientações do Compêndio Neuropsicológico (Strauss et al., 2006a). Os testes em papel foram avaliados pelo mesmo psicólogo e por um psiquiatra, de acordo com o compêndio. O Teste de Aprendizagem dos Associados Emparelhados (teste PAL) foi avaliado automaticamente por um software. Os dados de RM também foram analisados e avaliados automaticamente pelo software Freesurfer e SAS; portanto, nenhum julgamento subjetivo foi envolvido na análise dos dados de neuroimagem. Como a avaliação e avaliação do teste PAL e os dados de neuroimagem foram totalmente automáticos, o viés dos julgamentos humanos foi baixo (limitado apenas à avaliação dos testes em papel).
Subjetos com demência foram excluídos do estudo com base no Mini Exame de Estado Mental (MMSE). O MMSE é um teste padrão; sua eficácia foi comprovada por vários estudos, como um método útil na diferenciação entre sujeitos com demência e controles saudáveis (Petersen et al., 1999; Gomar et al., 2011). A maioria dos estudos anteriores utilizou o escore de corte de 26 ou o escore ajustado à idade para demência. As subtarefas do teste avaliam orientação, função executiva central, formação rápida de associação, capacidade de identificação verbal e capacidade de analisar e sintetizar.
O Exame Cognitivo de Addenbrooke foi utilizado para avaliar o desempenho cognitivo global, incluindo orientação, atenção, memória, fluência verbal, habilidades verbais e visuoespaciais (Mathuranath et al.., 2000; Alexopoulos et al., 2010).
O Teste Rey Auditory Verbal Learning Test foi utilizado para a avaliação detalhada das funções da memória com base nos critérios de Petersen. O teste Rey avalia a aprendizagem verbal e a memória (Rey, 1958). Uma lista de 15 palavras (lista A) deve ser repetida pelo sujeito imediatamente. Este teste é repetido 5 vezes. Depois é apresentada uma outra lista de 15 palavras (lista B ou lista de interferências) que deve ser chamada de volta. Então a lista A deve ser lembrada sem repetir, e então esta tarefa é repetida após 30 min.
O teste Trail Making, Parte A e Parte B (conexão numérica; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) é usado para avaliar a atenção seletiva, funções executivas e flexibilidade cognitiva. Na Parte A, os números distribuídos aleatoriamente devem ser conectados em ordem numérica, enquanto na Parte B são exibidos números e letras distribuídos aleatoriamente. O sujeito é instruído a conectar os números e letras em uma ordem pré-definida. A variável dependente é o tempo necessário para completar o teste. A Parte A da TMT mede as funções executivas e a atenção, enquanto no desempenho da Parte B a flexibilidade cognitiva também é refletida.
Os resultados dos testes neuropsicológicos estão resumidos na Tabela 1.
Todos os participantes completaram um formulário no qual eles avaliaram sua própria condição de saúde e função de memória; além disso, eles tiveram que relatar o uso do computador e da internet, atividades recreativas, consumo de álcool, hábitos alimentares e tabagismo (Yesavage, 1988). A Escala de Depressão Geriátrica (GDS) foi utilizada para avaliar os sintomas depressivos, enquanto os sintomas de ansiedade foram medidos pelo Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
Visuospatial memory was measured by an implementation of the PAL test used in several neuropsychological test batteries (Siraly et al., 2013). “Nas janelas do teste PAL abrem-se em posições aleatórias na tela uma após a outra durante 3 s com formas abstratas mostradas em uma ou mais janelas. Outras janelas permanecem em branco, dependendo do nível de dificuldade. Quando todos os quadrados foram mostrados, as formas mostradas anteriormente aparecem no centro do ecrã e os participantes têm de decidir em que janela viram essa forma antes. O teste consiste em cinco níveis diferentes em oito estágios no total, o número de formas aumenta de 1 para 8 nos diferentes estágios. Os sujeitos tiveram 10 testes para completar um determinado estágio, caso contrário o teste terminou. A disposição das janelas era assimétrica no teste e mudou de fase para fase”. (Siraly et al., 2013) Durante o teste computadorizado os sujeitos foram sentados confortavelmente a uma distância de meio metro da tela do computador e seguindo informações prévias eles resolveram as tarefas com o uso de um mouse.
Análise Estatística
Diferenças entre grupos de estudo em volume cerebral, espessura cortical e desempenho cognitivo foram analisadas pela Análise Geral do Modelo Linear (GLM na SAS 9.2) com idade e sexo como covariantes. Os volumes foram padronizados para o volume intracraniano total (TIV), e são dados em porcentagem. A fim de analisar as diferenças entre os grupos foram aplicadas comparações pós hoc t, onde os valores de p foram ajustados para 0,05/3 = 0,016, onde três representa o número de comparações entre os grupos.
A relação entre os resultados dos testes neuropsicológicos e o tamanho das estruturas do SNC foi analisada por correlações de Pearson. As correlações com o número de estágios completados no teste PAL foram analisadas pela Correlação de Spearman, uma vez que a distribuição desta variável desviou-se em grande parte da distribuição normal.
Resultados
Diferenças nos Volumes Corticais, Espessura Cortical e Desempenho Cognitivo entre Sujeitos com amci, namci e Controles
Foram encontradas diferenças significativas no volume do hipocampo e no volume do córtex entorhinal entre os grupos de estudo. Os testes post hoc mostraram que os volumes estão significativamente diminuídos no grupo aMCI em relação aos controles e ao grupo naMCI, enquanto os outros dois grupos não diferiram significativamente (Tabela 3 e Figura 1) Entre os covariáveis, gênero teve efeito significativo no volume do hipocampo, sujeitos do sexo masculino tiveram uma diminuição significativa do tamanho do hipocampo em relação ao feminino .
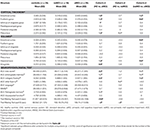
Tábua 3. Diferenças das estruturas do SNC e dos resultados dos testes neuropsicológicos entre os grupos de estudo.
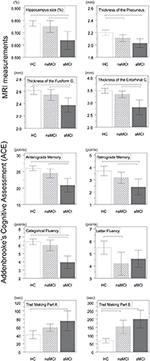
Figura 1. Entre as diferenças de grupo nas estruturas do SNC e os testes neuropsicológicos. As barras verticais representam o grupo, enquanto as barras de erro representam os desvios padrão. As linhas horizontais sobre as barras verticais indicam diferenças significativas entre os grupos após a correção para comparações múltiplas (p < 0,016). HC, controles saudáveis; aMCI, amnéstico leve comprometimento cognitivo; naMCI, não amnéstico leve comprometimento cognitivo; SNC, sistema nervoso central.
A espessura média do córtex entorhinal, o giro fusiforme, o istmo do giro cingulado e o pré-cuno também diferem significativamente entre os grupos de estudo. De acordo com os testes post-hoc, a diminuição da espessura cortical foi encontrada na aMCI em relação aos controles nas quatro estruturas, enquanto a espessura do córtex entorhinal e do giro fusiforme também foram significativamente diminuídas no grupo aMCI em relação ao grupo naMCI. O grupo significa, os resultados dos testes post-hoc e as diferenças entre os grupos em termos de d de Cohen estão resumidos na Tabela 3.
Existiu uma diferença significativa entre os grupos de estudo em memória anterógrada , memória retrógrada , fluência categórica . Em memória anterógrada e fluência categórica, tanto o grupo controle quanto o grupo naMCI tiveram desempenho superior ao grupo aMCI, enquanto os primeiros grupos não diferiram significativamente (Tabela 3). Nos controles de memória retrógrada, o desempenho do grupo aMCI foi superior ao do grupo aMCI, mas não do grupo naMCI. Em controles de fluência de letras superaram o grupo naMCI, mas não o grupo aMCI, enquanto que os dois grupos MCI não diferiram um do outro (p > 0,05). Além disso, em fluência categórica, as mulheres tiveram melhor desempenho que os homens, enquanto a idade não teve efeito significativo no desempenho.
Análises correlacionais
Em toda a amostra foram encontradas fortes correlações entre os resultados dos testes neuropsicológicos e o volume e espessura das estruturas cerebrais temporais (Tabela 4).

Tábua 4. Correlações entre as estruturas do SNC e os resultados do teste neuropsicológico em toda a amostra.
No grupo aMCI o resultado do Rey Verbal Learning Test mostrou uma correlação positiva significativa com o tamanho da amígdala (r = 0,47, n = 20, p = 0,03), e a espessura do córtex entorhinal (r = 0,46, n = 20, p = 0,04; Figura 2). Sujeitos com diminuição dos volumes da amígdala e diminuição da espessura entorhinal apresentaram pior desempenho no teste de memória.

Figura 2. Correlação entre o desempenho da memória de curto prazo indexada pelo teste de aprendizagem verbal Rey e o volume da amígdala e a espessura do córtex entorhinal nos grupos de estudo. As correlações de Pearson foram significativas (p < 0,05) no grupo ICM amnéstico e em toda a amostra, enquanto não significativas nos grupos ICM controle e nos não amnésticos. O escore total do teste verbal Rey nos eixos verticais é igual à soma de palavras nos primeiros cinco testes. linha vermelha, linha de regressão no grupo aMCI; linha tracejada, linha de regressão em toda a amostra; ICM, discreto comprometimento cognitivo; r e p, coeficiente de correlação de Pearson ajustado para idade e correspondente nível de significância no grupo aMCI.
Outros indivíduos com diminuição dos volumes entorhinais (r = 0,49, n = 19, p = 0,03), e diminuição dos volumes de giros fusiformes (r = 0,48, n = 19, p = 0,04) e espessura cortical fusiforme (r = 0.53, n = 19, p = 0,02) realizados mais fracos no sub-teste de memória retrógrada da ACE.
Discussão
MCI amnésticos e não amnésticos foram atribuídos como potenciais prodígios a diferentes tipos de DNCs. Supõe-se que os indivíduos com deficiência cognitiva leve amnéstica tenham um risco maior de conversão para demência de Alzheimer, enquanto os indivíduos com deficiência cognitiva leve não amnéstica têm um risco maior de conversão para demência não-alzheimer (Petersen et al, 1999; Killiany et al., 2000; Petersen e Negash, 2008).
As diferenças estruturais do cérebro foram examinadas por RM nos subgrupos ICM e grupo controle saudável, enquanto as diferenças no desempenho cognitivo foram investigadas por testes neuropsicológicos. De acordo com os resultados da RM, a espessura do córtex entorhinal, o giro fusiforme, o istmo do giro cingular e o pré-cuno, e o volume da amígdala e do hipocampo foram diminuídos na AMCI em relação aos controles saudáveis. Estes achados estão em linha com estudos anteriores relatando que sujeitos saudáveis, pacientes com ICM ou doença de Alzheimer podem ser diferenciados uns dos outros com base nos volumes das estruturas do lobo temporal como a amígdala ou o hipocampo (Desikan et al, 2009; McEvoy et al., 2009).
Os volumes do hipocampo e do córtex entorhinal, e a espessura do córtex entorhinal e do giro fusiforme são significativamente diminuídos na aMCI em relação ao grupo da naMCI. A maior diferença entre os grupos foi detectada no volume e na espessura do córtex entorhinal (0,9 e 1,2 DP, respectivamente), o que está de acordo com o fato de que a atrofia na AD começa nesta região. Estes resultados mostram que existem diferenças estruturais precoces entre os subtipos de ICM. Além disso, o padrão desses achados estruturais é adequado à patologia da doença de Alzheimer (Braak e Braak, 1991), o que sublinha os resultados anteriores de que aMCI progride para a doença de Alzheimer com maior freqüência em relação à naMCI (Killiany et al., 2000; Petersen e Negash, 2008).
Comparando o grupo controle e naMCI uma diferença significativa foi encontrada apenas na espessura do pré-cuno que foi diminuída no grupo naMCI. Curiosamente, um estudo recente encontrou lesões de matéria branca em pacientes com naMCI também no pré-cuno (O’Dwyer et al., 2011), que é um importante centro que sustenta a transferência de informações entre o giro parahipocampal e o córtex pré-frontal (Vincent et al., 2006) e tem um papel importante no processo de memória e imaginário visual.
Dentre os testes neuropsicológicos, o MMSE não diferiu entre os grupos de estudo, o que é uma provável conseqüência da exclusão de pacientes com demência. No total da ECA, memória anterógrada da ECA e sub-testes de fluência da categoria ECA, o grupo aMCI teve pior desempenho em relação ao grupo naMCI e ao grupo controle saudável. No teste de memória retrógrada da ECA e nos testes Trail Making A e B, o grupo aMCI só teve pior desempenho do que os controles saudáveis, enquanto não foi detectada diferença entre os dois subgrupos de ICM. A diminuição do desempenho nas tarefas de memória (RAVLT e tarefa de memória retrógrada da ECA) no grupo aMCI correlacionou-se com o maior envolvimento das estruturas do lobo temporal, como o córtex entorhinal, e a amígdala (Figura 2), o que confirma ainda mais nossos resultados entre as diferenças do grupo.
Na tarefa de fluência da letra, o grupo naMCI realizou pior que o grupo saudável, enquanto que o grupo aMCI não diferiu dos outros grupos. O teste Trail making B é um índice de atenção visual e comutação de tarefa. A diminuição do desempenho dos dois grupos de ICM em relação aos controles (Tabela 3) é provavelmente o resultado do envolvimento frontal. Tanto as tarefas de fluência de categoria como de letra dependem fortemente do funcionamento do lóbulo frontal, incluindo processos executivos que requerem que os sujeitos organizem a recuperação, monitorem respostas previamente lembradas, iniciem respostas verbais e inibam respostas que não se encaixem nos critérios (Henry et al., 2004). “Ambas as medidas também acessam memórias semânticas, uma função do lóbulo temporal; embora a fluência da letra pareça tocar essa habilidade ligada ao lóbulo temporal em menor extensão do que a fluência da categoria” (Lezak et al., 2004). Estudos de lesão e imagens funcionais do cérebro também suportam o envolvimento dos lobos temporal e frontal na capacidade de fluência. Estudos anteriores de fMRI mostraram que a fluência Letter está associada ao aumento da ativação nos lobos frontais, enquanto ambos os lobos frontal e temporal estão ativos durante a fluência de categoria (Birn et al., 2010). Isto corresponde bem aos nossos achados de que aMCI difere significativamente de acordo com a fluência de categoria em relação ao grupo sadio e naMCI, enquanto não há diferença significativa entre os dois subgrupos no resultado da fluência de letra.
Foram encontradas fortes correlações entre as funções de memória verbal e visual indexadas pelos testes RAVLT e PAL, e os volumes e espessura cortical das estruturas temporais como o córtex entorrinal (Tabela 4) em toda a amostra e também no grupo aMCI (Figura 2). Esses achados validam a utilidade desses marcadores neuropsicológicos e de RM no diagnóstico precoce do declínio cognitivo patológico e na monitorização da progressão da doença.
Limitações
A limitação do estudo é que a maioria dos sujeitos do grupo aMCI era do tipo multi-domínio, uma vez que seu desempenho em funções executivas avaliadas pelo teste de trail making test B e pela ECA estavam abaixo da faixa de normalidade. Esta limitação somada ao fato de que a naMCI é uma entidade mais heterogênea em relação à aMCI pode explicar porque o presente estudo não foi capaz de encontrar estruturas do SNC com tamanho reduzido no grupo naMCI em relação ao grupo aMCI.
Conclusões
A nomeação da aMCI e da naMCI não são apenas teóricas, mas estes subtipos são entidades diferentes tanto do ponto de vista neuropsicológico como do ponto de vista estrutural do cérebro. O desenvolvimento de critérios específicos de RM e neuropsicológicos para os diferentes subtipos de comprometimento cognitivo leve permitirá então avaliar os determinantes e a prevalência dos subtipos de ICM.
A atribuição de subtipos de ICM será útil para melhorar a previsão do tipo de demência e o risco de conversão para demência. Além disso, a atribuição de subtipos de ICM pode fornecer uma melhor abordagem para testar a eficácia das opções terapêuticas na prevenção da conversão a distúrbios neurocognitivos. Com base em nossos resultados, a RM pode ser uma ferramenta útil para a separação mais precisa entre subtipos de ICM.
Contribuições dos autores
GC desenhou o estudo, escreveu o protocolo, realizou a análise estatística, criou as figuras, e escreveu o primeiro rascunho do manuscrito ES participou da execução das medidas, gerenciou as pesquisas e análises da literatura, e escreveu o primeiro rascunho da introdução e a conclusão. A ÁS contribuiu para a finalização de todas as seções do manuscrito. ZF, AH participou na execução das medições e contribuiu para a redação da seção de métodos. ÉC, PS, ZH, GR deu supervisão para as experiências durante o estudo, incluindo a redação do manuscrito. Todos os autores contribuíram e aprovaram o manuscrito final.
Funding
O estudo foi apoiado pela bolsa “Ambient Assisted Living Joint Programme (AAL)-Call 2” (Project Identifier: AAL_08-1-2011-0005 M3W), ().
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Albert, M. S, DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). O diagnóstico de uma deficiência cognitiva leve devido ao mal de Alzheimer: recomendações dos grupos de trabalho do National Institute on Aging-Alzheimer’s Association sobre diretrizes diagnósticas para o mal de Alzheimer. Alzheimer Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validação do exame cognitivo alemão revisado de Addenbrooke para detecção de deficiência cognitiva leve, demência leve na doença de Alzheimer e degeneração lobar frontotemporal. Dement. Geriatr. Cogn. Desordem. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Sistemas neurais de suporte à pesquisa lexical guiados por sinais de categoria letra e semântica: um estudo de fMRI de auto-resposta aberta da fluência verbal. Neuroimagem. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Mild cognitive impairment-a review of prevalence, incidence and outcome according to current approaches. Acta Psiquiatra. Escândalo. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Estágio neuropatológico de alterações relacionadas ao Alzheimer. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identificação de indivíduos idosos cognitivamente saudáveis com subsequente declínio da memória através do uso de volumes temporoparietais automatizados de RM. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., e Sereno, M. I. (1999). Análise de superfície cortical. I. Segmentação e reconstrução da superfície. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Medidas de ressonância magnética automatizada identificam indivíduos com deficiência cognitiva leve e doença de Alzheimer. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). O volume entorhinal derivado de ressonância magnética é um bom preditor de conversão de ICM para AD. Neurobiol. Idade 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Medindo a espessura do córtex cerebral humano a partir de imagens de ressonância magnética. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Segmentação independente da sequência de imagens de ressonância magnética. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., e Dale, A. M. (1999a). Análise de superfície cortical. II: Inflação, achatamento, e um sistema de coordenadas baseado na superfície. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., e Dale, A. M. (1999b). Média de intersubjetos de alta resolução e um sistema de coordenadas para a superfície cortical. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., e DeKosky, S. T. (2004). Diminuição cognitiva leve, tipo amnéstico: um estudo epidemiológico. Neurologia 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., e Goldberg, T. E. (2011). Utilidade de combinações de biomarcadores, marcadores cognitivos e fatores de risco para prever a conversão de uma deficiência cognitiva leve para a doença de Alzheimer em pacientes da iniciativa de neuroimagem da doença de Alzheimer. Arco. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). O comprometimento cognitivo MIld pode ser distinguido da doença de alzheimer e do envelhecimento normal para ensaios clínicos. Arco. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J. J., Huh, Y., et al. (2012). Validade preditiva e estabilidade diagnóstica de subtipos de deficiência cognitiva leve. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Association between CSF biomarkers and incipient Alzheimer’s disease incipient patients with mild cognitive impairment: a follow-up study. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., e Phillips, L. H. (2004). Desempenho da fluência verbal em demência do tipo Alzheimer: uma meta-análise. Neuropsicologia 42, 1212-1222. doi: 10.1016/j.neuropsicologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr.., Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Predição de AD com volume hipocampal baseado em ressonância magnética em ligeira deficiência cognitiva. Neurologia 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Uso de ressonância magnética estrutural para prever quem vai contrair a doença de Alzheimer. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidência e resultado de ligeira deficiência cognitiva numa coorte prospectiva de base populacional. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., e Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. Nova York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., e Hodges, J. R. (2000). Uma breve bateria de testes cognitivos para diferenciar a doença de Alzheimer e a demência frontotemporal. Neurologia 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). Biomarcadores do LCR e da doença de Alzheimer incipiente em pacientes com deficiência cognitiva leve. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer disease: quantitative structural neuroimaging for detection and prediction of clinical and structural changes in mild cognitive impairment. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversion to dementia and the APOE genotype: a prediction study with FDG-PET. Neurologia 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Múltiplos índices de difusão identificam os danos da matéria branca em deficiências cognitivas leves e na doença de Alzheimer. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Diminuição cognitiva leve como uma entidade de diagnóstico. J. Estagiário. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., e Negash, S. (2008). Diminuição cognitiva leve: uma visão geral. Espectr. do SNC. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., e Kokmen, E. (1999). Mild cognitive impairment: clinical characterization and outcome. Arco. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., e DeKosky, S. T. (2001). Parâmetro de prática: detecção precoce da demência: deficiência cognitiva leve (uma revisão baseada em evidências). Report of the Quality standards subcommittee of the American academy of neurology. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). A relação da trilha que faz o teste com a lesão cerebral orgânica. J. Consultar. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Registro consistente inverso altamente preciso: uma abordagem robusta. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). Uma abordagem híbrida do problema de remoção do crânio na ressonância magnética. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Diminuição cognitiva leve: mesma identidade para diferentes entidades. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Monitoring the early signs of cognitive decline in elderly by computer games: an MRI study. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). Neuropsicofarmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., e Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., e Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. Nova Iorque, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., e Spreen, O. (eds.). (2006b). “Mini Mental State Examination (MMSE),” in Compendium of Neuropsychological Tests, 3rd Edn. (Nova York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A and B: dados normativos estratificados por idade e escolaridade. Arco. Clin. Neuropsicol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Atividade espontânea coerente identifica uma rede de memória hipocampal-parietal. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Escala de depressão geriátrica. Psicofarmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Atrofia da matéria cinzenta do cérebro basal e hipocampo em ligeira deficiência cognitiva. J. Neurol. Neurocirurgia. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar