- Introduction
- Methoden
- Ethikerklärung
- Teilnehmer
- MR-Bildaufnahme und -Verarbeitung
- Verfahren
- Statistische Analyse
- Ergebnisse
- Unterschiede in den kortikalen Volumina, der kortikalen Dicke und der kognitiven Leistung zwischen Probanden mit amci, namci und Kontrollen
- Korrelationsanalysen
- Diskussion
- Grenzwerte
- Schlussfolgerungen
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
Introduction
Schwerwiegende neurokognitive Störungen (NCD) oder Demenz, einschließlich der Alzheimer-Krankheit (AD), sind ein verheerendes Problem unserer alternden Gesellschaft mit enormen sozialen, wirtschaftlichen und medizinischen Belastungen. Da es derzeit keine wirksame Behandlung für NCD gibt, hat sich die Forschung in letzter Zeit auf die Erkennung von Frühsymptomen konzentriert. Aus zahlreichen aktuellen Studien geht hervor, dass der pathologische Prozess der Alzheimer-Krankheit bereits Jahrzehnte vor den ersten Symptomen des kognitiven Abbaus beginnt (Mattsson et al., 2009). Das Zwischenstadium zwischen dem erwarteten kognitiven Abbau bei physiologischer Alterung und dem schweren Abbau bei Demenz, das als „leichte kognitive Beeinträchtigung“ (MCI) bezeichnet wird, hat großes Interesse gefunden. „Bei MCI kann durch neuropsychologische Tests eine leichte Beeinträchtigung der kognitiven Fähigkeiten festgestellt werden, während die globalen kognitiven Funktionen und Alltagsaktivitäten erhalten bleiben“ (Petersen, 2004). Die höhere Umwandlungsrate in eine NCD bei MCI zeigt die klinische Bedeutung dieser Vorerkrankung. Die Umwandlungsrate in eine NCD liegt bei MCI bei 10-15 % pro Jahr, verglichen mit einer jährlichen Rate von 1-4 % in der durchschnittlichen älteren Bevölkerung (Petersen et al., 2001; Bischkopf et al., 2002). Die Mehrheit dieser Patienten entwickelt eine klinische Alzheimer-Krankheit. Es sei darauf hingewiesen, dass MCI auch ein stabiler oder umgekehrter Zustand sein kann, der nicht in eine Demenz übergeht. Epidemiologische Längsschnittstudien berichteten über eine abweichende Konversionsrate und eine relativ häufige Rückkehr zur normalen Kognition (Larrieu et al., 2002; Ganguli et al., 2004). Verschiedene Befunde deuten auf eine Instabilität der diagnostischen Genauigkeit und die Notwendigkeit einer spezifischeren Identifizierung von MCI-Patienten hin (Han et al., 2012). In Anbetracht dessen ist es verständlich, dass mehrere Studien auf die Symptome und Unterschiede zur Durchschnittsbevölkerung abzielen, die eng mit der Entwicklung einer Demenz verbunden sind und daher zur Unterstützung der Frühdiagnose herangezogen werden können.
Patienten mit MCI können weiter in amnestische (aMCI) und nicht-amnestische MCI (naMCI) kategorisiert werden. Bei der aMCI überwiegt der Gedächtnisverlust, und sie ist mit einem hohen Risiko für eine weitere Umwandlung in eine Alzheimer-Krankheit verbunden (Grundman, 2004). Personen mit naMCI weisen Beeinträchtigungen in anderen Bereichen als dem Gedächtnis auf und haben ein höheres Risiko, zu anderen Demenzformen wie der diffusen Lewy-Körper-Demenz überzugehen. Beide Typen lassen sich weiter in Subtypen mit einem oder mehreren Bereichen unterteilen. In der vorliegenden Untersuchung wurde jedoch aufgrund der begrenzten Stichprobengröße keine weitere Kategorisierung vorgenommen. Mit dem Ziel, die besonderen Merkmale von Patienten zu identifizieren, die in eine Alzheimer-Krankheit übergehen, wurden verschiedene Arten von Biomarkern für MCI getestet. Während die Ergebnisse von Liquor-Biomarkern (Hansson et al., 2006) und Positronen-Emissions-Tomographie-Studien (Mosconi et al., 2004) auf eine stark abweichende Spezifität und Sensitivität hinwiesen, zeigten Studien zur strukturellen Magnetresonanztomographie beeindruckende Ergebnisse (Jack et al., 1999; deToledo-Morrell et al., 2004). Interessanterweise untersuchten mehrere frühere Studien die Unterschiede zwischen Probanden mit MCI und gesunden Kontrollen, nur wenige Studien versuchten, zwischen den MCI-Subtypen zu differenzieren (Zhang et al., 2011; Serra et al., 2013).
Während aMCI und naMCI theoretisch unterschiedliche Entitäten sind, untersuchten nur wenige Untersuchungen die strukturellen Hirnunterschiede zwischen diesen Subtypen von MCI (Serra et al., 2013). Ziel der Studie war es, die strukturellen Unterschiede zwischen aMCI und naMCI zu ermitteln und frühere Ergebnisse zur Unterscheidung zwischen aMCI und gesunden Kontrollen zu wiederholen. Auf der Grundlage früherer Studien über MCI und die Umwandlung in eine Demenz konzentrierten wir uns auf Strukturen des Temporallappens und der angrenzenden Regionen (Chiang et al., 2011): den entorhinalen Kortex, den Hippocampus, den parahippocampalen Kortex, die Amygdala, den fusiformen Gyrus, den Precuneus, den posterioren cingulären Kortex und den Isthmus des cingulären Gyrus.
Methoden
Diese Studie ist eine Fortführung unserer zuvor veröffentlichten Arbeit (Sirály et al., 2015). Da in der vorliegenden Studie eine ähnliche neuropsychologische Testbatterie und dieselbe MRT-Erfassungs- und Verarbeitungspipeline verwendet wurden, sind die Methoden und Verfahren in beiden Arbeiten ähnlich beschrieben.
Ethikerklärung
Die Experimente wurden in voller Übereinstimmung mit der Deklaration von Helsinki und allen relevanten nationalen und internationalen ethischen Richtlinien durchgeführt. Die Forschung wurde von der nationalen Ethikkommission in Budapest, Ungarn, genehmigt. Alle Verfahren wurden nur durchgeführt, nachdem die Teilnehmer ihre schriftliche Einwilligung gegeben hatten. Alle potenziellen Teilnehmer, die die Teilnahme ablehnten oder aus anderen Gründen nicht mitmachten, wurden durch ihre Nichtteilnahme an der Studie in keiner Weise benachteiligt.
Teilnehmer
Die Studie wurde in der Abteilung für Psychiatrie und Psychotherapie der Semmelweis-Universität in Budapest durchgeführt. Insgesamt wurden 62 Probanden in die Studie aufgenommen. Alle Probanden bewarben sich um die Teilnahme an einem kognitiven Trainingsprogramm, das bei Allgemeinärzten und in einem Altersheim angekündigt wurde (die Studie ist bei ClinicalTrials.gov registriert, Identifikator ist „NCT02310620“). Alle Probanden waren in der Lage, ein unabhängiges Leben zu führen. Die grundlegenden demografischen und neuropsychologischen Daten sind in Tabelle 1 zusammengefasst.

Table 1. Demografische Daten und Ergebnisse grundlegender neuropsychologischer Tests.
Personen mit aMCI und naMCI sowie gesunde Kontrollpersonen wurden auf der Grundlage der Petersen-Kriterien (Petersen, 2004) in die Studie aufgenommen. Die Petersen-Kriterien umfassen subjektive Gedächtnisbeschwerden, die von einem Informanten bestätigt werden, zusammen mit erhaltenen Alltagsaktivitäten, eine Gedächtnisbeeinträchtigung auf der Grundlage eines neuropsychologischen Standardtests, erhaltene globale kognitive Funktionen und schließlich den Ausschluss einer Demenz. Da kein neuropsychologischer Test für die Bewertung von Gedächtnisbeeinträchtigungen angegeben ist, haben wir den Rey Auditory Verbal Learning Test (RAVLT) verwendet, der in der Literatur am häufigsten verwendet wird (Gomar et al., 2011). Für die Unterscheidung zwischen aMCI und gesunden Kontrollpersonen wurde ein Cutoff-Score von 1 SD unter dem alters- und geschlechtsstandardisierten Bevölkerungsdurchschnitt verwendet. Teilnehmer, die entweder im Teilergebnis der verzögerten Erinnerung oder im Gesamtergebnis unter dem Cutoff-Wert lagen, wurden in die aMCI-Gruppe eingestuft. Die angewandten Kriterien basieren auf den Empfehlungen der Arbeitsgruppen des National Institute on Aging und der Alzheimer’s Association für diagnostische Richtlinien für die Alzheimer-Krankheit (Albert et al., 2011). Die genauen Cutoff-Werte für den RAVLT für die verschiedenen Altersgruppen sind in Tabelle 2A aufgeführt. Probanden, die nicht zur aMCI-Gruppe gehörten, aber entweder im Trail making Test B oder in der Addenbrooke’s Cognitive Examination (ACE) einen Wert von 1 SD unter dem für Alter und Geschlecht/Bildung standardisierten Bevölkerungsdurchschnitt erzielten, wurden der naMCI-Gruppe zugeordnet. Ein zusätzliches Kriterium für die naMCI-Gruppe war ein Verhältnis von weniger als 3,2 VLOM (verbal fluency + language score/orientation + memory score) im ACE, um mögliche aMCI-Personen aus der naMCI-Gruppe auszuschließen (diese Personen wurden aus der Studie ausgeschlossen).

Table 2. (A). Rey Auditory Verbal Learning Test (RAVLT): normative Daten und altersbereinigte Cut-off-Werte für leichte kognitive Beeinträchtigung (MCI); (B) Mini Mental Examination Test (MMSE): alters- und bildungsbereinigte Cut-off-Werte für Demenz.
Personen mit Demenz wurden entsprechend den alters- und bildungsbereinigten Mini Mental State Examination (MMSE)-Werten von der Studie ausgeschlossen (Strauss et al., 2006b). Die genauen Cutoff-Werte für den MMSE in den verschiedenen Alters- und Bildungsgruppen sind in Tabelle 2B aufgeführt. Probanden mit einem Kopftrauma, Epilepsie oder Schlaganfall in der Vorgeschichte oder mit der Diagnose einer akuten psychiatrischen Störung, Schizophrenie oder Manie oder Alkoholabhängigkeit wurden ebenfalls von der Studie ausgeschlossen.
MR-Bildaufnahme und -Verarbeitung
Alle Probanden wurden mittels MRT des Gehirns untersucht, wobei hochauflösende Strukturbilder erzeugt wurden, die für die weitere Verarbeitung und Analyse verwendet wurden. Die Bilder wurden im MR-Forschungszentrum der Semmelweis-Universität Budapest mit einem klinischen 3-Tesla-MRT-Scanner vom Typ Philips Achieva aufgenommen, der mit einer Acht-Kanal-SENSE-Kopfspule ausgestattet ist. Die hochauflösenden anatomischen Bilder des gesamten Gehirns wurden mit einer T1-gewichteten dreidimensionalen Spoiled-Gradienten-Echo-Sequenz (T1W 3D TFE) aufgenommen. Von jedem Probanden wurden 180 zusammenhängende Schichten mit den folgenden Bildgebungsparametern aufgenommen: TR = 9,7 ms; TE = 4,6 ms; Flip-Winkel = 8°; FOV von 240 × 240 mm; Voxelgröße von 1,0 × 1,0 × 1,0 mm.
Die kortikale Rekonstruktion und die volumetrische Segmentierung wurden mit der Bildanalyse-Suite Freesurfer 5.3 durchgeführt, die dokumentiert ist und online frei heruntergeladen werden kann (http://surfer.nmr.mgh.harvard.edu/). Die technischen Details dieser Verfahren sind in früheren Veröffentlichungen beschrieben, wir haben keine Änderungen an dieser Pipeline vorgenommen. Die Bildverarbeitung umfasst die Bewegungskorrektur (Reuter et al., 2010), die Entfernung von hirnfremdem Gewebe mithilfe eines hybriden Watershed-/Oberflächendeformationsverfahrens (Segonne et al., 2004), die automatische Talairach-Transformation, die Segmentierung der subkortikalen weißen Substanz und der volumetrischen Strukturen der tiefen grauen Substanz (einschließlich Hippocampus, Amygdala, Caudat, Putamen, Ventrikel) (Fischl et al., 2004), Intensitätsnormalisierung, Tesselierung der Grenze zwischen grauer und weißer Substanz, automatische Topologiekorrektur und Oberflächendeformation anhand von Intensitätsgradienten, um die Grenzen zwischen grauem und weißem Gewebe sowie zwischen grauem Gewebe und Liquor optimal an der Stelle zu platzieren, an der die größte Intensitätsverschiebung den Übergang zur anderen Gewebeklasse definiert (Dale et al., 1999; Fischl und Dale, 2000). Nach der Fertigstellung der Kortikalismodelle führte Freesurfer eine Reihe von deformierbaren Prozeduren für die weitere Datenverarbeitung und -analyse durch. Zu den Schritten gehörten die Aufblähung der Oberfläche (Fischl et al., 1999a), die Registrierung in einem sphärischen Atlas, der individuelle kortikale Faltungsmuster nutzte, um die kortikale Geometrie über die Probanden hinweg abzugleichen (Fischl et al., 1999b), die Parzellierung der Großhirnrinde in Einheiten auf der Grundlage der gyralen und sulkalen Struktur (Fischl et al., 2004) und die Erstellung einer Vielzahl von oberflächenbasierten Daten einschließlich Karten der Krümmung und der sulkalen Tiefe. Schließlich wurden die kortikalen Modelle und die Ergebnisse der Segmentierung bei jedem Probanden einer Qualitätsprüfung und manuellen Korrektur unterzogen, wobei die Korrektur keine signifikanten Veränderungen der Ergebnisse ergab.
Verfahren
Die neuropsychologischen Untersuchungen wurden werktags zwischen 8 und 16 Uhr durchgeführt. Die Tests fanden in einem separaten, gut beleuchteten Raum statt, in dem nur der Patient und ein Prüfer anwesend waren. Die Referenztests wurden ebenfalls gemäß den Empfehlungen des Neuropsychologischen Kompendiums (Strauss et al., 2006a) ausgefüllt und ausgewertet, während die computergestützten Tests von der Software ausgewertet wurden.
Die neuropsychologischen Tests wurden von zwei zuvor ausgebildeten Medizinstudenten unter der Aufsicht eines Psychologen und eines Psychiaters durchgeführt. Bei der Auswertung der Tests wurden die Richtlinien des Neuropsychologischen Kompendiums (Strauss et al., 2006a) befolgt. Die papierbasierten Tests wurden von demselben Psychologen und einem Psychiater gemäß dem Kompendium ausgewertet. Der Paired Associates Learning Test (PAL-Test) wurde automatisch von einer Software ausgewertet. Die MR-Daten wurden ebenfalls automatisch mit der Freesurfer- und der SAS-Software analysiert und ausgewertet, so dass bei der Analyse der Neuroimaging-Daten keine subjektiven Beurteilungen vorgenommen wurden. Da die Bewertung und Auswertung des PAL-Tests und der Neuroimaging-Daten vollständig automatisch erfolgte, war die Verzerrung durch menschliche Urteile gering (nur bei der Auswertung der papierbasierten Tests).
Personen mit Demenz wurden auf der Grundlage des Mini Mental State Examination (MMSE) von der Studie ausgeschlossen. Der MMSE ist ein Standardtest; seine Wirksamkeit wurde in mehreren Studien als nützliche Methode zur Unterscheidung zwischen Probanden mit Demenz und gesunden Kontrollen nachgewiesen (Petersen et al., 1999; Gomar et al., 2011). In den meisten früheren Studien wurde der Cut-off-Wert von 26 oder der altersbereinigte Wert für Demenz verwendet. Die Teilaufgaben des Tests bewerten die Orientierung, die zentrale Exekutivfunktion, die schnelle Assoziationsbildung, die verbale Identifikationsfähigkeit und die Fähigkeit zur Analyse und Synthese.
Die Addenbrooke’s Cognitive Examination wurde zur Bewertung der globalen kognitiven Leistung verwendet, einschließlich Orientierung, Aufmerksamkeit, Gedächtnis, verbale Geläufigkeit, verbale und visuospatiale Fähigkeiten (Mathuranath et al., 2000; Alexopoulos et al., 2010).
Der Rey Auditory Verbal Learning Test wurde für die detaillierte Bewertung der Gedächtnisfunktionen auf der Grundlage der Petersen-Kriterien verwendet. Der Rey-Test bewertet das verbale Lernen und das Gedächtnis (Rey, 1958). Eine Liste von 15 Wörtern (Liste A) sollte vom Probanden sofort wiederholt werden. Dieser Test wird 5 Mal wiederholt. Dann wird einmal eine andere Liste mit 15 Wörtern (Liste B oder Interferenzliste) vorgelegt, die abgerufen werden soll. Dann sollte Liste A ohne Wiederholung abgerufen werden, und dann wird diese Aufgabe nach 30 Minuten wiederholt.
Der Trail Making Test, Teil A und Teil B (Zahlenverbindung; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) wird verwendet, um selektive Aufmerksamkeit, exekutive Funktionen und kognitive Flexibilität zu bewerten. In Teil A sollen zufällig verteilte Zahlen in numerischer Reihenfolge verbunden werden, während in Teil B zufällig verteilte Zahlen und Buchstaben angezeigt werden. Die Versuchsperson wird angewiesen, die Zahlen und Buchstaben in einer vorher festgelegten Reihenfolge zu verbinden. Die abhängige Variable ist die Zeit, die benötigt wird, um den Test abzuschließen. Teil A des TMT misst die exekutiven Funktionen und die Aufmerksamkeit, während die Leistung in Teil B auch die kognitive Flexibilität widerspiegelt.
Die Ergebnisse der neuropsychologischen Tests sind in Tabelle 1 zusammengefasst.
Alle Teilnehmer füllten ein Formular aus, in dem sie ihren eigenen Gesundheitszustand und ihre Gedächtnisfunktion bewerteten; außerdem mussten sie über ihre Computer- und Internetnutzung, Freizeitaktivitäten, ihren Alkoholkonsum, ihre Ernährungsgewohnheiten und das Rauchen berichten (Yesavage, 1988). Die Geriatric Depression Scale (GDS) wurde zur Beurteilung depressiver Symptome verwendet, während Angstsymptome mit dem Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970) gemessen wurden.
Das räumliche Gedächtnis wurde mit einer Implementierung des PAL-Tests gemessen, der in mehreren neuropsychologischen Testbatterien verwendet wird (Siraly et al., 2013). „Im PAL-Test öffnen sich an zufälligen Positionen auf dem Bildschirm nacheinander für 3 s Fenster, in denen abstrakte Formen in einem oder mehreren Fenstern gezeigt werden. Andere Fenster bleiben je nach Schwierigkeitsgrad leer. Wenn alle Quadrate gezeigt wurden, erscheinen die zuvor gezeigten Formen in der Mitte des Bildschirms und die Teilnehmer müssen entscheiden, in welchem Fenster sie diese Form zuvor gesehen haben. Der Test bestand aus fünf verschiedenen Ebenen in insgesamt acht Stufen, wobei die Anzahl der Formen in den verschiedenen Stufen von 1 bis 8 anstieg. Die Versuchspersonen hatten 10 Versuche, um eine bestimmte Stufe abzuschließen, ansonsten war der Test beendet. Die Anordnung der Fenster war in dem Test asymmetrisch und änderte sich von Stufe zu Stufe.“ (Siraly et al., 2013) Während des computergestützten Tests saßen die Probanden bequem in einem Abstand von einem halben Meter zum Computerbildschirm und lösten die Aufgaben nach vorheriger Information mit Hilfe einer Maus.
Statistische Analyse
Unterschiede zwischen den Studiengruppen in den Hirnvolumina, der kortikalen Dicke und der kognitiven Leistung wurden durch eine allgemeine lineare Modellanalyse (GLM in SAS 9.2) mit Alter und Geschlecht als Kovariaten analysiert. Die Volumina wurden auf das intrakranielle Gesamtvolumen (TIV) normiert und in Prozent angegeben. Um Unterschiede zwischen den Gruppen zu analysieren, wurden post hoc t-Vergleiche durchgeführt, wobei die p-Werte auf 0,05/3 = 0,016 angepasst wurden, wobei drei für die Anzahl der Vergleiche zwischen den Gruppen steht.
Die Beziehung zwischen den Ergebnissen der neuropsychologischen Tests und der Größe der ZNS-Strukturen wurde durch Pearson-Korrelationen analysiert. Korrelationen mit der Anzahl der im PAL-Test absolvierten Stufen wurden durch Spearman-Korrelation analysiert, da die Verteilung dieser Variable weitgehend von der Normalverteilung abwich.
Ergebnisse
Unterschiede in den kortikalen Volumina, der kortikalen Dicke und der kognitiven Leistung zwischen Probanden mit amci, namci und Kontrollen
Ein signifikanter Unterschied wurde im Volumen des Hippocampus und im Volumen des entorhinalen Kortex zwischen den Studiengruppen festgestellt. Die Post-hoc-Tests zeigten, dass die Volumina in der aMCI-Gruppe im Vergleich zu den Kontrollen und der naMCI-Gruppe signifikant verringert sind, während die beiden anderen Gruppen sich nicht signifikant unterschieden (Tabelle 3 und Abbildung 1). Unter den Kovariaten hatte das Geschlecht einen signifikanten Einfluss auf das Volumen des Hippocampus, männliche Probanden hatten eine signifikant verringerte Hippocampusgröße im Vergleich zu den Frauen.
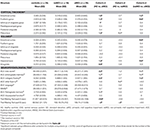
Tabelle 3. Unterschiede der ZNS-Strukturen und der neuropsychologischen Testergebnisse zwischen den Studiengruppen.
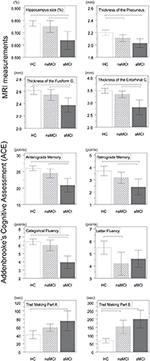
Abbildung 1. Unterschiede zwischen den Gruppen bei ZNS-Strukturen und neuropsychologischen Tests. Die vertikalen Balken stellen die Gruppenmittelwerte dar, die Fehlerbalken die Standardabweichungen. Die horizontalen Linien über den vertikalen Balken zeigen signifikante Unterschiede zwischen den Gruppen nach Korrektur für Mehrfachvergleiche an (p < 0,016). HC, gesunde Kontrollen; aMCI, amnestische leichte kognitive Beeinträchtigung; naMCI, nicht amnestische leichte kognitive Beeinträchtigung; ZNS, zentrales Nervensystem.
Die durchschnittliche Dicke des entorhinalen Kortex, des fusiformen Gyrus, des Isthmus des zingulären Gyrus und des Precuneus unterscheiden sich ebenfalls signifikant zwischen den Studiengruppen. Die Post-hoc-Tests ergaben, dass die Dicke der Kortikalis in der aMCI-Gruppe im Vergleich zur Kontrollgruppe in allen vier Strukturen abnahm, während die Dicke des entorhinalen Kortex und des fusiformen Gyrus in der aMCI-Gruppe im Vergleich zur naMCI-Gruppe ebenfalls signifikant abnahm. Die Gruppenmittelwerte, die Ergebnisse der Post-hoc-Tests und die Unterschiede zwischen den Gruppen in Form von Cohen’s d sind in Tabelle 3 zusammengefasst.
Es gab einen signifikanten Unterschied zwischen den Studiengruppen im anterograden Gedächtnis, im retrograden Gedächtnis und in der kategorialen Geläufigkeit. Im anterograden Gedächtnis und im kategorialen Redefluss übertrafen sowohl die Kontrollgruppe als auch die naMCI-Gruppe die aMCI-Gruppe, während sich die erstgenannten Gruppen nicht signifikant unterschieden (Tabelle 3). Im retrograden Gedächtnis übertraf die Kontrollgruppe die aMCI-Gruppe, aber nicht die naMCI-Gruppe. Bei der Buchstabenflüssigkeit übertrafen die Kontrollpersonen die naMCI-Gruppe, aber nicht die aMCI-Gruppe, während sich die beiden MCI-Gruppen nicht voneinander unterschieden (p > 0,05). Darüber hinaus schnitten weibliche Probanden bei der kategorialen Geläufigkeit besser ab als männliche, während das Alter keinen signifikanten Einfluss auf die Leistung hatte.
Korrelationsanalysen
In der gesamten Stichprobe wurden starke Korrelationen zwischen den Ergebnissen der neuropsychologischen Tests und dem Volumen und der Dicke der temporalen Hirnstrukturen gefunden (Tabelle 4).

Tabelle 4. Korrelationen zwischen den ZNS-Strukturen und den neuropsychologischen Testergebnissen in der gesamten Stichprobe.
In der aMCI-Gruppe zeigte das Ergebnis des Rey Verbal Learning Test eine signifikante positive Korrelation mit der Größe der Amygdala (r = 0,47, n = 20, p = 0,03) und der Dicke des entorhinalen Cortex (r = 0,46, n = 20, p = 0,04; Abbildung 2). Probanden mit verringertem Amygdala-Volumen und verringerter entorhinaler Dicke zeigten schlechtere Leistungen im Gedächtnistest.

Abbildung 2. Korrelation zwischen der Leistung des Kurzzeitgedächtnisses, die durch den Rey-Verbal-Lerntest indiziert wird, und dem Amygdala-Volumen sowie der entorhinalen Kortexdicke in den Studiengruppen. Die Pearson-Korrelationen waren signifikant (p < 0,05) in der amnestischen MCI-Gruppe und in der gesamten Stichprobe, während sie in der Kontrollgruppe und in den nicht amnestischen MCI-Gruppen nicht signifikant waren. Rote Linie, Regressionslinie in der aMCI-Gruppe; gestrichelte Linie, Regressionslinie in der Gesamtstichprobe; MCI, leichte kognitive Beeinträchtigung; r und p, Pearson-Korrelationskoeffizient bereinigt um Alter und entsprechendes Signifikanzniveau in der aMCI-Gruppe.
Außerdem hatten Probanden mit verringerten entorhinalen Volumina (r = 0,49, n = 19, p = 0,03) und verringerten Volumina des fusiformen Gyrus (r = 0,48, n = 19, p = 0,04) und der fusiformen kortikalen Dicke (r = 0.53, n = 19, p = 0,02) schnitten im retrograden Gedächtnis-Subtest des ACE schwächer ab.
Diskussion
Amnestische und nicht-amnestische MCI wurden als potenzielle Prodromi verschiedenen Arten von NCDs zugeordnet. Bei Personen mit amnestischer leichter kognitiver Beeinträchtigung wird angenommen, dass sie ein höheres Risiko haben, in eine Alzheimer-Demenz überzugehen, während bei Personen mit nicht-amnestischer leichter kognitiver Beeinträchtigung ein höheres Risiko besteht, in eine Nicht-Alzheimer-Demenz überzugehen (Petersen et al, 1999; Killiany et al., 2000; Petersen und Negash, 2008).
Die strukturellen Unterschiede des Gehirns wurden mittels MRT in den MCI-Untergruppen und der gesunden Kontrollgruppe untersucht, während die Unterschiede in der kognitiven Leistung durch neuropsychologische Tests untersucht wurden. Den MRT-Ergebnissen zufolge waren die Dicke des entorhinalen Kortex, des fusiformen Gyrus, des Isthmus des Gyrus cingularis und des Precuneus sowie das Volumen der Amygdala und des Hippocampus bei MCI im Vergleich zu den gesunden Kontrollpersonen verringert. Diese Ergebnisse stehen im Einklang mit früheren Studien, in denen berichtet wurde, dass gesunde Probanden, Patienten mit MCI oder Alzheimer-Krankheit anhand des Volumens der Schläfenlappenstrukturen wie der Amygdala oder des Hippocampus voneinander unterschieden werden können (Desikan et al., 2009; McEvoy et al., 2009).
Die Volumina des Hippocampus und des entorhinalen Kortex sowie die Dicke des entorhinalen Kortex und des fusiformen Gyrus sind bei der aMCI-Gruppe im Vergleich zur naMCI-Gruppe signifikant verringert. Der größte Unterschied zwischen den Gruppen wurde beim Volumen und der Dicke des entorhinalen Kortex festgestellt (0,9 bzw. 1,2 SD), was mit der Tatsache in Einklang steht, dass die Atrophie bei Alzheimer in dieser Region beginnt. Diese Ergebnisse zeigen, dass es frühe strukturelle Unterschiede zwischen den Subtypen von MCI gibt. Darüber hinaus passt das Muster dieser strukturellen Befunde zur Pathologie der Alzheimer-Krankheit (Braak und Braak, 1991), was frühere Ergebnisse unterstreicht, wonach die aMCI im Vergleich zur naMCI häufiger zur Alzheimer-Krankheit fortschreitet (Killiany et al., 2000; Petersen und Negash, 2008).
Im Vergleich zwischen der Kontroll- und der naMCI-Gruppe wurde ein signifikanter Unterschied nur bei der Dicke des Precuneus festgestellt, die in der naMCI-Gruppe abnahm. Interessanterweise fand eine neuere Studie Läsionen der weißen Substanz bei Patienten mit naMCI auch im Precuneus (O’Dwyer et al., 2011), einem wichtigen Knotenpunkt, der den Informationstransfer zwischen dem parahippocampalen Gyrus und dem präfrontalen Kortex aufrechterhält (Vincent et al., 2006) und eine wichtige Rolle bei Gedächtnisprozessen und der visuellen Vorstellungskraft spielt.
Bei den neuropsychologischen Tests unterschied sich der MMSE nicht zwischen den Studiengruppen, was wahrscheinlich eine Folge des Ausschlusses von Patienten mit Demenz ist. In den Untertests ACE total, ACE anterograde memory und ACE category fluency schnitt die aMCI-Gruppe schlechter ab als die naMCI-Gruppe und die gesunde Kontrollgruppe. Im retrograden Gedächtnistest des ACE und in den Tests Trail Making A und B schnitt die aMCI-Gruppe nur schlechter ab als die gesunde Kontrollgruppe, während zwischen den beiden MCI-Untergruppen kein Unterschied festgestellt wurde. Die verminderte Leistung bei den Gedächtnisaufgaben (RAVLT und ACE retrograde Gedächtnisaufgabe) in der aMCI-Gruppe korrelierte mit der verstärkten Beteiligung von Temporallappenstrukturen wie dem entorhinalen Kortex und der Amygdala (Abbildung 2), was unsere Ergebnisse zu den Unterschieden zwischen den Gruppen weiter bestätigt.
Bei der Aufgabe zur Buchstabenflüssigkeit schnitt die naMCI-Gruppe schlechter ab als die gesunde Gruppe, während sich die aMCI nicht von den anderen Gruppen unterschied. Der Trail Making B Test ist ein Index für visuelle Aufmerksamkeit und Aufgabenwechsel. Die schlechtere Leistung der beiden MCI-Gruppen im Vergleich zu den Kontrollpersonen (Tabelle 3) ist wahrscheinlich auf eine frontale Beteiligung zurückzuführen. Sowohl die Aufgaben zur Kategorienbildung als auch zur Buchstabenflüssigkeit sind stark von der Funktion des Frontallappens abhängig, einschließlich exekutiver Prozesse, die von den Probanden verlangen, den Abruf zu organisieren, zuvor abgerufene Antworten zu überwachen, verbale Antworten zu initiieren und Antworten zu unterdrücken, die nicht zu den Kriterien passen (Henry et al., 2004). „Beide Messungen greifen auch auf semantische Gedächtnisspeicher zu, eine Funktion des Temporallappens; allerdings scheint die Buchstabenflüssigkeit diese Fähigkeit, die mit dem Temporallappen verbunden ist, in geringerem Maße zu nutzen als die Kategorienflüssigkeit“ (Lezak et al., 2004). Studien zur Läsion und funktionellen Bildgebung des Gehirns stützen ebenfalls die Beteiligung des Temporal- und Frontallappens an der Fähigkeit, flüssig zu schreiben. Frühere fMRI-Studien haben gezeigt, dass die Buchstabenflüssigkeit mit einer erhöhten Aktivierung der Frontallappen einhergeht, während bei der Kategorienflüssigkeit sowohl die Frontal- als auch die Temporallappen aktiv sind (Birn et al., 2010). Dies stimmt gut mit unseren Ergebnissen überein, dass sich die aMCI-Gruppe im Vergleich zu den Gesunden und der naMCI-Gruppe signifikant in Bezug auf das flüssige Lesen von Kategorien unterscheidet, während zwischen den beiden Untergruppen kein signifikanter Unterschied in Bezug auf das flüssige Lesen von Buchstaben besteht.
Es wurden starke Korrelationen zwischen den verbalen und visuellen Gedächtnisfunktionen, wie sie durch den RAVLT- und den PAL-Test indiziert werden, und den Volumina und der kortikalen Dicke der temporalen Strukturen wie dem entorrhinalen Kortex (Tabelle 4) in der gesamten Stichprobe und auch in der aMCI-Gruppe gefunden (Abbildung 2). Diese Ergebnisse bestätigen die Nützlichkeit dieser neuropsychologischen und MRT-Marker bei der Frühdiagnose des pathologischen kognitiven Verfalls und bei der Überwachung des Krankheitsverlaufs.
Grenzwerte
Eine Einschränkung der Studie besteht darin, dass die Mehrheit der Probanden in der aMCI-Gruppe zu den Multidomänen-Typen gehörte, da ihre Leistungen bei den exekutiven Funktionen, die mit dem Trail Making Test B und dem ACE bewertet wurden, unter dem Normalbereich lagen. Diese Einschränkung in Verbindung mit der Tatsache, dass naMCI im Vergleich zu aMCI eine heterogenere Entität ist, könnte erklären, warum in der aktuellen Studie keine ZNS-Strukturen mit verringerter Größe in der naMCI-Gruppe im Vergleich zur aMCI-Gruppe gefunden werden konnten.
Schlussfolgerungen
Die Benennung von aMCI und naMCI ist nicht nur theoretisch, sondern diese Subtypen sind sowohl aus neuropsychologischer als auch aus hirnstruktureller Sicht unterschiedliche Entitäten. Die Entwicklung spezifischer MRT- und neuropsychologischer Kriterien für die verschiedenen Subtypen der leichten kognitiven Beeinträchtigung wird es dann ermöglichen, die Determinanten und die Prävalenz der MCI-Subtypen zu bewerten.
Die Zuordnung von MCI-Subtypen wird nützlich sein, um die Vorhersage des Demenztyps und des Risikos der Umwandlung in eine Demenz zu verbessern. Darüber hinaus kann die Zuordnung von MCI-Subtypen einen besseren Ansatz für die Prüfung der Wirksamkeit von therapeutischen Optionen zur Verhinderung der Umwandlung in neurokognitive Störungen bieten. Auf der Grundlage unserer Ergebnisse kann die MRT ein nützliches Instrument zur genaueren Unterscheidung zwischen MCI-Subtypen sein.
Beiträge der Autoren
GC konzipierte die Studie, schrieb das Protokoll, führte die statistische Analyse durch, erstellte die Abbildungen und verfasste den ersten Entwurf des Manuskripts ES beteiligte sich an der Durchführung der Messungen, leitete die Literaturrecherchen und -analysen und schrieb den ersten Entwurf der Einleitung und der Schlussfolgerung. ÁS trug zur Fertigstellung aller Abschnitte des Manuskripts bei. ZF, AH beteiligten sich an der Durchführung der Messungen und trugen zur Abfassung des Methodenteils bei. ÉC, PS, ZH, GR beaufsichtigten die Experimente während der Studie und verfassten das Manuskript. Alle Autoren trugen zum endgültigen Manuskript bei und haben es genehmigt.
Finanzierung
Die Studie wurde durch das „Ambient Assisted Living Joint Programme (AAL)-Call 2“-Programm (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu) unterstützt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). Die Diagnose der leichten kognitiven Beeinträchtigung aufgrund der Alzheimer-Krankheit: Empfehlungen der Arbeitsgruppen des National Institute on Aging-Alzheimer’s Association zu diagnostischen Richtlinien für die Alzheimer-Krankheit. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validierung der deutschen revidierten Addenbrooke’s kognitiven Untersuchung zur Erkennung einer leichten kognitiven Beeinträchtigung, einer leichten Demenz bei der Alzheimer-Krankheit und einer frontotemporalen lobären Degeneration. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neuronale Systeme zur Unterstützung der lexikalischen Suche, die durch Hinweise auf Buchstaben und semantische Kategorien gesteuert wird: eine selbstgesteuerte fMRI-Studie zur verbalen Geläufigkeit mit offener Antwort. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Leichte kognitive Beeinträchtigung – ein Überblick über Prävalenz, Inzidenz und Ergebnisse nach aktuellen Ansätzen. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Neuropathologische Stadieneinteilung der Alzheimer-bedingten Veränderungen. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identifizierung kognitiv gesunder älterer Menschen mit späterem Gedächtnisverlust mithilfe automatisierter MR temporoparietaler Volumina. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Cortical surface-based analysis. I. Segmentation and surface reconstruction. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automatisierte MRT-Messungen identifizieren Personen mit leichter kognitiver Beeinträchtigung und Alzheimer-Krankheit. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-abgeleitetes entorhinales Volumen ist ein guter Prädiktor für die Umwandlung von MCI in AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Die Messung der Dicke der menschlichen Großhirnrinde anhand von Magnetresonanzbildern. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequenz-unabhängige Segmentierung von Magnetresonanzbildern. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Cortical surface-based analysis. II: Inflation, Flattening, and a surface-based coordinate system. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). Hochauflösende Intersubjekt-Mittelung und ein Koordinatensystem für die kortikale Oberfläche. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., and DeKosky, S. T. (2004). Leichte kognitive Beeinträchtigung, amnestischer Typ: eine epidemiologische Studie. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). Nutzen von Kombinationen aus Biomarkern, kognitiven Markern und Risikofaktoren zur Vorhersage des Übergangs von leichter kognitiver Beeinträchtigung zur Alzheimer-Krankheit bei Patienten in der Alzheimer’s Disease Neuroimaging Initiative. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld kognitive Beeinträchtigung kann von Alzheimer-Krankheit und normaler Alterung für klinische Studien unterschieden werden. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | Querverweis Volltext | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Prädiktive Validität und diagnostische Stabilität von Subtypen der leichten kognitiven Beeinträchtigung. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Zusammenhang zwischen Liquor-Biomarkern und beginnender Alzheimer-Krankheit bei Patienten mit leichter kognitiver Beeinträchtigung: eine Folgestudie. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., und Phillips, L. H. (2004). Verbale Geläufigkeit bei Demenz vom Alzheimer-Typ: eine Meta-Analyse. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Vorhersage von Alzheimer mit MRI-basiertem Hippocampusvolumen bei leichter kognitiver Beeinträchtigung. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Verwendung der strukturellen Magnetresonanztomographie zur Vorhersage, wer an Alzheimer erkranken wird. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Inzidenz und Ergebnis leichter kognitiver Beeinträchtigungen in einer bevölkerungsbezogenen prospektiven Kohorte. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). Eine kurze kognitive Testbatterie zur Unterscheidung von Alzheimer-Krankheit und frontotemporaler Demenz. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). Liquor-Biomarker und beginnende Alzheimer-Krankheit bei Patienten mit leichter kognitiver Beeinträchtigung. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer-Krankheit: Quantitatives strukturelles Neuroimaging zur Erkennung und Vorhersage von klinischen und strukturellen Veränderungen bei leichter kognitiver Beeinträchtigung. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). Die Umwandlung von MCI in Demenz und der APOE-Genotyp: eine Vorhersagestudie mit FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). Mehrere Diffusionsindizes identifizieren Schäden der weißen Substanz bei leichter kognitiver Beeinträchtigung und Alzheimer-Krankheit. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Leichte kognitive Beeinträchtigung als diagnostische Einheit. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Leichte kognitive Beeinträchtigung: ein Überblick. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Leichte kognitive Beeinträchtigung: klinische Charakterisierung und Ergebnisse. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., und DeKosky, S. T. (2001). Praxisparameter: Früherkennung von Demenz: leichte kognitive Beeinträchtigung (eine evidenzbasierte Überprüfung). Bericht des Unterkomitees für Qualitätsstandards der amerikanischen Akademie für Neurologie. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Die Beziehung zwischen dem Trail Making Test und organischen Hirnschäden. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Hochgenaue inverse konsistente Registrierung: ein robuster Ansatz. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). Ein hybrider Ansatz für das Schädel-Stripping-Problem in der MRT. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Milde kognitive Beeinträchtigung: gleiche Identität für verschiedene Entitäten. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Überwachung der frühen Anzeichen des kognitiven Verfalls bei älteren Menschen durch Computerspiele: eine MRI-Studie. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). „Mini Mental State Examination (MMSE)“, in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A und B: Normative Daten geschichtet nach Alter und Bildung. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Kohärente Spontanaktivität identifiziert ein hippocampal-parietales Gedächtnisnetzwerk. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatric Depression Scale. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Atrophie der grauen Substanz des basalen Vorderhirns und des Hippocampus bei leichter kognitiver Beeinträchtigung. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar