- Introduction
- Méthodes
- Déclaration d’éthique
- Participants
- Acquisition et traitement des images RM
- Procédures
- Analyse statistique
- Résultats
- Différences dans les volumes corticaux, l’épaisseur corticale et la performance cognitive entre les sujets avec amci, namci, et les contrôles
- Analyses corrélationnelles
- Discussion
- Limitations
- Conclusions
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
Introduction
Les troubles neurocognitifs majeurs (NCD) ou la démence, y compris la maladie d’Alzheimer (AD), sont un problème dévastateur de notre société vieillissante ayant un énorme fardeau social, économique et médical. Étant donné qu’il n’existe actuellement aucun traitement efficace contre ces troubles, les recherches récentes se sont concentrées sur la détection des symptômes précoces. Des preuves convergentes issues de nombreuses études récentes ont révélé que le processus pathologique de la MA commence des décennies avant les premiers symptômes de déclin cognitif (Mattsson et al., 2009). Le stade intermédiaire entre le déclin cognitif attendu dans le vieillissement physiologique et le déclin sévère de la démence, connu sous le nom de « déficience cognitive légère » (MCI), a suscité beaucoup d’intérêt. » Dans le MCI, une légère altération des capacités cognitives peut être révélée par des tests neuropsychologiques, tandis que les fonctions cognitives globales et les activités quotidiennes sont préservées » (Petersen, 2004). Le taux plus élevé de conversion en NCD dans le MCI donne une importance clinique à cet état pré-malade. Le taux de conversion en maladie neurodégénérative est de 10 à 15 % par an dans le DCL, contre 1 à 4 % par an dans la population âgée moyenne (Petersen et al., 2001 ; Bischkopf et al., 2002). La majorité de ces patients développent une MA clinique. Il convient de noter que le DCL peut également être un état stable ou inverse n’évoluant pas vers la démence. Des études épidémiologiques longitudinales ont signalé un taux de conversion variable et une réversion relativement fréquente vers une cognition normale (Larrieu et al., 2002 ; Ganguli et al., 2004). Différents résultats suggèrent une instabilité dans la précision du diagnostic et la nécessité d’une identification plus spécifique entre les patients MCI (Han et al., 2012). Au vu de ce qui précède, il est compréhensible que plusieurs études ciblent les symptômes et les différences par rapport à la population moyenne qui sont étroitement liés au développement de la démence et qui peuvent donc être utilisés pour aider au diagnostic précoce.
Les patients atteints de DCL peuvent être catégorisés davantage en DCL amnésique (aMCI) et DCL non amnésique (naMCI). Dans le cas d’un aMCI, la perte de mémoire est prédominante et elle est associée à un risque élevé de conversion ultérieure en MA (Grundman, 2004). Les personnes atteintes de naMCI présentent des déficiences dans d’autres domaines que la mémoire et ont un risque plus élevé de se convertir à d’autres formes de démence telles que la démence diffuse à corps de Lewy. Les deux types peuvent être catégorisés en sous-types à domaine unique et multi-domaines, mais dans la présente étude, aucune catégorisation supplémentaire n’a été effectuée en raison de la taille limitée de l’échantillon. D’importants types de biomarqueurs du MCI ont été testés dans le but d’identifier les caractéristiques particulières des patients qui passent à la MA. Alors que les résultats des biomarqueurs du liquide céphalorachidien (Hansson et al., 2006) et des études de tomographie par émission de positons (Mosconi et al., 2004) ont mis en évidence une spécificité et une sensibilité très variables, les études d’imagerie par résonance magnétique structurelle ont révélé des résultats impressionnants (Jack et al., 1999 ; deToledo-Morrell et al., 2004). Il est intéressant de noter que plusieurs études antérieures ont étudié les différences entre les sujets atteints de MCI et les contrôles sains, seules quelques études ont essayé de différencier les sous-types de MCI (Zhang et al., 2011 ; Serra et al., 2013).
Alors que l’aMCI et le naMCI sont des entités théoriquement différentes, seules quelques investigations ont étudié les différences structurelles du cerveau entre ces sous-types de MCI (Serra et al., 2013). L’objectif de cette étude était de trouver les différences structurelles entre l’aMCI et le naMCI, et de reproduire les résultats précédents sur la différenciation entre l’aMCI et les contrôles sains. Sur la base d’études antérieures sur le MCI et la conversion en démence, nous nous sommes concentrés sur les structures du lobe temporal et des régions voisines (Chiang et al, 2011) : le cortex entorhinal, l’hippocampe, le cortex parahippocampique, l’amygdale, le gyrus fusiforme, le précuneus, le cortex cingulaire postérieur et l’isthme du gyrus cingulaire.
Méthodes
Cette étude est une continuation de notre travail précédemment publié (Sirály et al., 2015). Étant donné qu’une batterie de tests neuropsychologiques similaire, et le même pipeline d’acquisition et de traitement IRM ont été utilisés dans la présente étude, les méthodes et les procédures ont été décrites de manière similaire dans les deux articles.
Déclaration d’éthique
Les expériences ont été menées en totale conformité avec la Déclaration d’Helsinki et toutes les directives éthiques nationales et internationales pertinentes. La recherche a été approuvée par le Comité national d’éthique, Budapest, Hongrie. Toutes les procédures n’ont été effectuées qu’après l’obtention du consentement éclairé écrit des participants. Tous les participants potentiels qui ont refusé de participer ou qui n’ont pas participé d’une autre manière n’ont pas été désavantagés de quelque façon que ce soit en ne participant pas à l’étude.
Participants
L’étude a été réalisée dans le département de psychiatrie et de psychothérapie de l’Université Semmelweis, Budapest. Au total, 62 sujets ont été inscrits à l’étude. Tous les sujets ont demandé à participer à un programme d’entraînement cognitif annoncé parmi les médecins généralistes et dans une maison de retraite (L’étude est enregistrée sur ClinicalTrials.gov, l’identifiant est « NCT02310620 »). Tous les sujets étaient capables de mener une vie indépendante. Les données démographiques et neuropsychologiques de base sont résumées dans le tableau 1.

Tableau 1. Données démographiques et résultat des tests neuropsychologiques de base.
Les sujets atteints d’aMCI et de naMCI, et les témoins sains ont été inclus dans l’étude sur la base des critères de Petersen (Petersen, 2004). Les critères de Petersen comprennent une plainte de mémoire subjective corroborée par un informateur ainsi que des activités quotidiennes préservées, un trouble de la mémoire basé sur un test neuropsychologique standard, des fonctions cognitives globales préservées et enfin l’exclusion de la démence. Il ne spécifie pas de test neuropsychologique pour l’évaluation des troubles de la mémoire, nous avons donc appliqué le Rey Auditory Verbal Learning Test (RAVLT), qui est le test le plus fréquemment utilisé d’après la littérature (Gomar et al., 2011). Pour différencier les personnes atteintes de la maladie de Creutzfeldt-Jakob des témoins sains, nous avons appliqué un score seuil de 1 écart-type sous la moyenne de la population standardisée pour l’âge et le sexe. Les participants qui ont obtenu un score inférieur à la valeur seuil soit dans le sous-score de rappel différé, soit dans le score total, ont été placés dans le groupe aMCI. Les critères appliqués sont basés sur les recommandations des groupes de travail du National Institute on Aging-Alzheimer’s Association sur les directives de diagnostic de la maladie d’Alzheimer (Albert et al., 2011). Les scores limites exacts du RAVLT pour les différents groupes d’âge sont indiqués dans le tableau 2A. Les sujets qui ne faisaient pas partie du groupe aMCI, mais dont le score était inférieur d’un écart-type à la moyenne de la population normalisée en fonction de l’âge, du sexe et du niveau d’éducation, soit au test de traçage B, soit à l’examen cognitif d’Addenbrooke (ACE), ont été classés dans le groupe naMCI. Un critère supplémentaire pour le groupe naMCI était un ratio VLOM (fluidité verbale + score de langage/orientation + score de mémoire) inférieur à 3,2 dans l’ACE afin d’exclure les éventuels sujets aMCI du groupe naMCI (ces sujets ont été exclus de l’étude).

Tableau 2. (A). Rey Auditory Verbal Learning Test (RAVLT) : données normatives et scores de coupure pour la déficience cognitive légère (MCI) ajustés pour l’âge ; (B) Mini Mental Examination Test (MMSE) : scores de coupure pour la démence ajustés pour l’âge et l’éducation.
Les sujets atteints de démence ont été exclus de l’étude selon les scores du Mini Mental State Examination (MMSE) standardisés pour l’âge et l’éducation (Strauss et al., 2006b). Les scores limites exacts du MMSE dans les différents groupes d’âge et d’éducation sont indiqués dans le tableau 2B. Les sujets ayant des antécédents de traumatisme crânien, d’épilepsie ou d’accident vasculaire cérébral, ou un diagnostic de trouble psychiatrique aigu, de schizophrénie ou de manie, de dépendance à l’alcool ont également été exclus de l’étude.
Acquisition et traitement des images RM
Tous les sujets ont été examinés par IRM cérébrale produisant des images structurelles à haute résolution, qui ont été utilisées pour un traitement et une analyse ultérieurs. Les acquisitions d’images ont été effectuées au Centre de recherche en RM, Université Semmelweis, Budapest, sur un scanner d’IRM clinique Philips Achieva de 3 Tesla équipé d’une bobine de tête SENSE à huit canaux. Les images anatomiques du cerveau entier à haute résolution ont été obtenues à l’aide d’une séquence d’écho de gradient spoiled tridimensionnelle pondérée en T1 (T1W 3D TFE). 180 coupes contiguës ont été acquises pour chaque sujet avec les paramètres d’imagerie suivants : TR = 9,7 ms ; TE = 4,6 ms ; angle de bascule = 8° ; FOV de 240 × 240 mm ; taille de voxel de 1,0 × 1,0 × 1,0 mm.
La reconstruction corticale et la segmentation volumétrique ont été réalisées par la suite d’analyse d’image Freesurfer 5.3, qui est documentée et librement téléchargeable en ligne (http://surfer.nmr.mgh.harvard.edu/). Les détails techniques de ces procédures sont décrits dans des publications antérieures, nous n’avons apporté aucune modification à ce pipeline. En bref, le traitement de l’image comprend la correction du mouvement (Reuter et al., 2010), l’élimination des tissus non cérébraux à l’aide d’une procédure hybride de bassin versant/déformation de surface (Segonne et al., 2004), la transformation automatisée de Talairach, la segmentation de la matière blanche sous-corticale et des structures volumétriques de la matière grise profonde (y compris l’hippocampe, l’amygdale, le caudat, le putamen, les ventricules) (Fischl et al, 2004), la normalisation de l’intensité, la tessellation de la limite entre la matière grise et la matière blanche, la correction automatique de la topologie et la déformation de la surface suivant des gradients d’intensité afin de placer de façon optimale les limites entre la matière grise et la matière blanche et entre la matière grise et le liquide céphalorachidien à l’endroit où le plus grand changement d’intensité définit la transition vers l’autre classe de tissu (Dale et al., 1999 ; Fischl et Dale, 2000). Une fois les modèles corticaux terminés, Freesurfer a effectué un certain nombre de procédures déformables pour le traitement et l’analyse ultérieurs des données. Ces étapes comprenaient le gonflement de la surface (Fischl et al., 1999a), l’enregistrement sur un atlas sphérique qui utilisait des modèles de pliage cortical individuels pour faire correspondre la géométrie corticale entre les sujets (Fischl et al., 1999b), la parcellation du cortex cérébral en unités basées sur la structure gyrale et sulculaire (Fischl et al., 2004), et la création d’une variété de données basées sur la surface, y compris des cartes de courbure et de profondeur sulculaire. Enfin, les modèles corticaux et les résultats de la segmentation ont fait l’objet d’un contrôle de qualité et d’une correction manuelle sur chaque sujet, cependant la correction n’a pas montré de changements significatifs dans les résultats.
Procédures
Les examens neuropsychologiques ont été réalisés les jours de semaine entre 8h et 16h. Les examens ont consisté en des tests neuropsychologiques informatisés (c’est-à-dire le test PAL) et sur papier. Les tests ont eu lieu dans une pièce séparée bien éclairée où seuls le patient et un examinateur étaient présents. Les tests de référence ont également été complétés et évalués selon les recommandations du compendium neuropsychologique (Strauss et al., 2006a), tandis que les tests informatisés ont été évalués par le logiciel.
Les tests neuropsychologiques ont été administrés par deux étudiants en médecine préalablement formés sous la supervision d’un psychologue et d’un psychiatre. Lors de l’évaluation des tests, les directives du compendium neuropsychologique (Strauss et al., 2006a) ont été suivies. Les tests sur papier ont été évalués par le même psychologue et un psychiatre selon le compendium. Le Paired Associates Learning Test (PAL test) a été évalué automatiquement par un logiciel. Les données de RM ont également été analysées et évaluées automatiquement par les logiciels Freesurfer et SAS ; aucun jugement subjectif n’a donc été impliqué dans l’analyse des données de neuro-imagerie. Puisque l’évaluation du test PAL et des données de neuro-imagerie étaient totalement automatiques, le biais des jugements humains était faible (limité uniquement à l’évaluation des tests sur papier).
Les sujets atteints de démence ont été exclus de l’étude sur la base du Mini Mental State Examination (MMSE). Le MMSE est un test standard ; son efficacité a été prouvée par plusieurs études, comme une méthode utile pour différencier les sujets atteints de démence des contrôles sains (Petersen et al., 1999 ; Gomar et al., 2011). La majorité des études précédentes ont utilisé le score seuil de 26 ou le score ajusté à l’âge pour la démence. Les sous-tâches du test évaluent l’orientation, la fonction exécutive centrale, la formation d’associations rapides, la capacité d’identification verbale et la capacité d’analyse et de synthèse.
L’examen cognitif d’Addenbrooke a été utilisé pour évaluer la performance cognitive globale, y compris l’orientation, l’attention, la mémoire, la fluidité verbale, les compétences verbales et visuospatiales (Mathuranath et al, 2000 ; Alexopoulos et al., 2010).
Le test d’apprentissage verbal auditif de Rey a été utilisé pour l’évaluation détaillée des fonctions de mémoire selon les critères de Petersen. Le test de Rey évalue l’apprentissage verbal et la mémoire (Rey, 1958). Une liste de 15 mots (liste A) doit être répétée immédiatement par le sujet. Ce test est répété 5 fois. Ensuite, une autre liste de 15 mots (liste B ou liste d’interférence) est présentée une fois et doit être rappelée. Ensuite, la liste A doit être rappelée sans être répétée, puis cette tâche est répétée après 30 min.
Le Trail Making test, partie A et partie B (connexion de nombres ; REITAN, 1955 ; Tombaugh, 2004 ; Alexopoulos et al., 2010) est utilisé pour évaluer l’attention sélective, les fonctions exécutives et la flexibilité cognitive. Dans la partie A, des nombres distribués de façon aléatoire doivent être reliés dans l’ordre numérique, tandis que dans la partie B, des nombres et des lettres distribués de façon aléatoire sont affichés. Le sujet a pour instruction de relier les chiffres et les lettres dans un ordre prédéfini. La variable dépendante est le temps nécessaire à la réalisation du test. La partie A du TMT mesure les fonctions exécutives et l’attention, tandis que dans la performance à la partie B, la flexibilité cognitive est également reflétée.
Les résultats des tests neuropsychologiques sont résumés dans le tableau 1.
Tous les participants ont rempli un formulaire dans lequel ils ont évalué leur propre état de santé et leur fonction de mémoire ; en outre, ils ont dû faire un rapport sur leur utilisation de l’ordinateur et d’Internet, leurs activités récréatives, leur consommation d’alcool, leurs habitudes alimentaires et leur tabagisme (Yesavage, 1988). L’échelle de dépression gériatrique (GDS) a été utilisée pour évaluer les symptômes dépressifs, tandis que les symptômes d’anxiété ont été mesurés par l’inventaire d’anxiété d’état et de trait de Spielberger (STAI ; Spielberger et al., 1970).
La mémoire visuospatiale a été mesurée par une mise en œuvre du test PAL utilisé dans plusieurs batteries de tests neuropsychologiques (Siraly et al., 2013). « Dans le test PAL, des fenêtres s’ouvrent à des positions aléatoires sur l’écran les unes après les autres pendant 3 s avec des formes abstraites affichées dans une ou plusieurs fenêtres. D’autres fenêtres restent vides en fonction du niveau de difficulté. Lorsque tous les carrés ont été montrés, les formes précédemment montrées apparaissent au centre de l’écran et les participants doivent décider dans quelle fenêtre ils ont vu cette forme auparavant. Le test se compose de cinq niveaux différents en huit étapes au total, le nombre de formes augmente de 1 à 8 sur les différentes étapes. Les sujets avaient 10 essais pour terminer une étape donnée, sinon le test était terminé. La disposition des fenêtres était asymétrique dans le test et elle changeait d’une étape à l’autre. » (Siraly et al., 2013) Pendant le test informatisé, les sujets étaient assis confortablement à une distance d’un demi-mètre de l’écran de l’ordinateur et suite à des informations préalables, ils ont résolu les tâches à l’aide d’une souris.
Analyse statistique
Les différences entre les groupes d’étude dans les volumes cérébraux, l’épaisseur corticale et la performance cognitive ont été analysées par une analyse de modèle linéaire général (GLM dans SAS 9.2) avec l’âge et le sexe comme covariables. Les volumes ont été normalisés par rapport au volume intracrânien total (VIT) et sont indiqués en pourcentage. Afin d’analyser les différences entre groupes, des comparaisons t post hoc ont été appliquées, où les valeurs p ont été ajustées à 0,05/3 = 0,016, où trois représente le nombre de comparaisons entre groupes.
La relation entre les résultats des tests neuropsychologiques et la taille des structures du SNC a été analysée par des corrélations de Pearson. Les corrélations avec le nombre d’étapes complétées dans le test PAL ont été analysées par corrélation de Spearman, puisque la distribution de cette variable s’écartait largement de la distribution normale.
Résultats
Différences dans les volumes corticaux, l’épaisseur corticale et la performance cognitive entre les sujets avec amci, namci, et les contrôles
Une différence significative a été trouvée dans le volume de l’hippocampe et dans le volume du cortex entorhinal entre les groupes d’étude . Les tests post hoc ont montré que les volumes sont significativement diminués dans le groupe aMCI par rapport aux contrôles et au groupe naMCI, tandis que les deux autres groupes ne diffèrent pas significativement (tableau 3 et figure 1) Parmi les covariables, le sexe a eu un effet significatif sur le volume de l’hippocampe, les sujets masculins avaient une taille d’hippocampe significativement diminuée par rapport aux femmes .
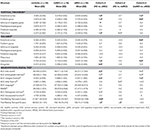
Tableau 3. Différences des structures du SNC et des résultats des tests neuropsychologiques entre les groupes d’étude.
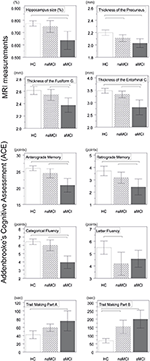
Figure 1. Différences entre les groupes dans les structures du SNC et les tests neuropsychologiques. Les barres verticales représentent les moyennes des groupes, tandis que les barres d’erreur représentent les écarts types. Les lignes horizontales au-dessus des barres verticales indiquent les différences significatives entre les groupes après correction pour comparaisons multiples (p < 0,016). HC, contrôles sains ; aMCI, déficience cognitive légère amnésique ; naMCI, déficience cognitive légère non amnésique ; SNC, système nerveux central.
L’épaisseur moyenne du cortex entorhinal , du gyrus fusiforme , de l’isthme du gyrus cingulé et du précuneus diffèrent également de manière significative entre les groupes d’étude. Selon les tests post-hoc, une diminution de l’épaisseur corticale a été constatée dans le groupe aMCI par rapport aux témoins dans les quatre structures, tandis que l’épaisseur du cortex entorhinal et du gyrus fusiforme était également significativement diminuée dans le groupe aMCI par rapport au groupe naMCI. Les moyennes des groupes, les résultats des tests post-hoc, et les différences entre les groupes en termes de d de Cohen sont résumés dans le tableau 3.
Il y avait une différence significative entre les groupes d’étude dans la mémoire antérograde , la mémoire rétrograde , la fluidité catégorielle . Dans la mémoire antérograde et la fluidité catégorielle, le groupe témoin et le groupe naMCI ont surpassé le groupe aMCI, tandis que les premiers groupes ne différaient pas significativement (tableau 3). En ce qui concerne la mémoire rétrograde, les témoins ont obtenu de meilleurs résultats que le groupe aMCI, mais pas que le groupe naMCI. En ce qui concerne la fluidité des lettres, les témoins ont obtenu de meilleurs résultats que le groupe naMCI, mais pas que le groupe aMCI, alors que les deux groupes MCI ne différaient pas l’un de l’autre (p > 0,05). En outre, dans la fluidité catégorielle, les sujets féminins ont obtenu de meilleurs résultats que les hommes , tandis que l’âge n’a pas eu d’effet significatif sur la performance.
Analyses corrélationnelles
Dans l’ensemble de l’échantillon, une forte corrélation a été trouvée entre les résultats des tests neuropsychologiques et le volume et l’épaisseur des structures cérébrales temporales (tableau 4).

Tableau 4. Corrélations entre les structures du SNC et les résultats des tests neuropsychologiques sur l’ensemble de l’échantillon.
Dans le groupe aMCI, le résultat du test d’apprentissage verbal de Rey a montré une corrélation positive significative avec la taille de l’amygdale (r = 0,47, n = 20, p = 0,03), et l’épaisseur du cortex entorhinal (r = 0,46, n = 20, p = 0,04 ; figure 2). Les sujets présentant une diminution des volumes de l’amygdale et une diminution de l’épaisseur du cortex entorhinal ont montré une moins bonne performance au test de mémoire.

Figure 2. Corrélation entre la performance de la mémoire à court terme, indexée par le test d’apprentissage verbal de Rey, et le volume de l’amygdale et l’épaisseur du cortex entorhinal dans les groupes étudiés. Les corrélations de Pearson étaient significatives (p < 0,05) dans le groupe MCI amnésique et dans l’ensemble de l’échantillon, alors qu’elles n’étaient pas significatives dans le groupe témoin et dans les groupes MCI non amnésiques. Le score total du test verbal Rey sur les axes verticaux est égal à la somme des mots des cinq premiers essais. ligne rouge, ligne de régression dans le groupe aMCI ; ligne pointillée, ligne de régression dans l’échantillon entier ; MCI, mild cognitive impairment ; r et p, coefficient de corrélation de Pearson ajusté pour l’âge et niveau de signification correspondant dans le groupe aMCI.
En outre, les sujets présentant une diminution des volumes entorhinaux (r = 0,49, n = 19, p = 0,03), et une diminution des volumes du gyrus fusiforme (r = 0,48, n = 19, p = 0,04) et de l’épaisseur corticale fusiforme (r = 0.53, n = 19, p = 0,02) ont obtenu des résultats plus faibles dans le subtest de mémoire rétrograde de l’ACE.
Discussion
Les MCI amnésiques et non amnésiques ont été attribués comme prodromes potentiels à différents types de NCD. Les sujets atteints de troubles cognitifs légers amnésiques sont supposés avoir un risque plus élevé de conversion en démence d’Alzheimer, tandis que les sujets atteints de troubles cognitifs légers non amnésiques sont réputés avoir un risque plus élevé de conversion en démence non-Alzheimer (Petersen et al, 1999 ; Killiany et al., 2000 ; Petersen et Negash, 2008).
Les différences structurelles du cerveau ont été examinées par IRM dans les sous-groupes MCI et le groupe de contrôle sain, tandis que les différences de performance cognitive ont été étudiées par des tests neuropsychologiques. D’après les résultats de l’IRM, l’épaisseur du cortex entorhinal, du gyrus fusiforme, de l’isthme du gyrus cingulaire et du précuneus, ainsi que le volume de l’amygdale et de l’hippocampe étaient diminués dans le groupe MCI par rapport aux témoins sains. Ces résultats sont en accord avec les études précédentes qui rapportent que les sujets sains, les patients atteints de MCI ou de la maladie d’Alzheimer peuvent être différenciés les uns des autres sur la base des volumes des structures du lobe temporal telles que l’amygdale ou l’hippocampe (Desikan et al, 2009 ; McEvoy et al., 2009).
Les volumes de l’hippocampe et du cortex entorhinal, et l’épaisseur du cortex entorhinal et du gyrus fusiforme sont significativement diminués dans le groupe aMCI par rapport au groupe naMCI. La plus grande différence entre les groupes a été détectée dans le volume et l’épaisseur du cortex entorhinal (0,9 et 1,2 ET, respectivement), ce qui est en accord avec le fait que l’atrophie dans la MA commence dans cette région. Ces résultats montrent qu’il existe des différences structurelles précoces entre les sous-types de MCI. De plus, le schéma de ces résultats structurels correspond à la pathologie de la maladie d’Alzheimer (Braak et Braak, 1991), ce qui souligne les résultats précédents selon lesquels les aMCI évoluent vers la maladie d’Alzheimer avec une fréquence plus élevée que les naMCI (Killiany et al., 2000 ; Petersen et Negash, 2008).
En comparant le groupe témoin et le groupe naMCI, une différence significative n’a été trouvée que dans l’épaisseur du precuneus qui a diminué dans le groupe naMCI. Il est intéressant de noter qu’une étude récente a trouvé des lésions de la substance blanche chez les patients atteints de naMCI également dans le précuneus (O’Dwyer et al., 2011), qui est une plaque tournante importante soutenant le transfert d’informations entre le gyrus parahippocampique et le cortex préfrontal (Vincent et al., 2006) et joue un rôle important dans le processus de mémoire et l’imaginaire visuel.
Parmi les tests neuropsychologiques, le MMSE ne différait pas entre les groupes d’étude, ce qui est une conséquence probable de l’exclusion des patients atteints de démence. Dans les subtests ACE total, ACE mémoire antérograde, et ACE fluence de catégorie, le groupe aMCI a obtenu de moins bons résultats par rapport au groupe naMCI et au groupe témoin sain. Dans le test de mémoire rétrograde de l’ACE et dans les tests de traçage A et B, le groupe aMCI a seulement obtenu de moins bons résultats que les témoins sains, alors qu’aucune différence n’a été détectée entre les deux sous-groupes MCI. La diminution des performances sur les tâches de mémoire (RAVLT et tâche de mémoire rétrograde de l’ACE) dans le groupe aMCI a été corrélée avec l’implication accrue des structures du lobe temporal telles que le cortex entorhinal, et l’amygdale (Figure 2), ce qui confirme encore nos résultats sur les différences entre les groupes.
Dans la tâche de fluidité des lettres, le groupe naMCI a obtenu de moins bons résultats que le groupe sain, tandis que le groupe aMCI ne différait pas des autres groupes. Le test B de fabrication de pistes est un indice de l’attention visuelle et du changement de tâche. La diminution des performances des deux groupes MCI par rapport aux témoins (tableau 3) est probablement le résultat d’une implication frontale. Les tâches de fluidité des catégories et des lettres reposent toutes deux fortement sur le fonctionnement du lobe frontal, y compris les processus exécutifs qui exigent que les sujets organisent la récupération, surveillent les réponses précédemment rappelées, initient des réponses verbales et inhibent les réponses qui ne correspondent pas aux critères (Henry et al., 2004). « Les deux mesures accèdent également à la mémoire sémantique, une fonction du lobe temporal, bien que la fluidité des lettres semble exploiter cette capacité liée au lobe temporal dans une moindre mesure que la fluidité des catégories » (Lezak et al., 2004). Les études de lésion et d’imagerie cérébrale fonctionnelle soutiennent également l’implication des lobes temporal et frontal dans la capacité de fluidité. Des études antérieures d’IRMf ont montré que la fluence verbale est associée à une activation accrue des lobes frontaux, tandis que les lobes frontal et temporal sont tous deux actifs pendant la fluence catégorielle (Birn et al., 2010). Cela correspond bien à nos résultats selon lesquels l’aMCI diffère significativement selon la fluence catégorielle par rapport au groupe sain et au groupe naMCI, alors qu’il n’y a pas de différence significative entre les deux sous-groupes dans le résultat de la fluence des lettres.
De fortes corrélations ont été trouvées entre les fonctions de mémoire verbale et visuelle telles qu’indexées par les tests RAVLT et PAL, et les volumes et l’épaisseur corticale des structures temporales telles que le cortex entorragique (tableau 4) dans l’ensemble de l’échantillon et également dans le groupe aMCI (figure 2). Ces résultats valident de manière croisée l’utilité de ces marqueurs neuropsychologiques et IRM dans le diagnostic précoce du déclin cognitif pathologique et dans le suivi de la progression de la maladie.
Limitations
Une des limites de l’étude est que la majorité des sujets du groupe aMCI étaient de type multi-domaines, puisque leurs performances dans les fonctions exécutives évaluées par le trail making test B et l’ACE étaient sous la normale. Cette limitation prise avec le fait que le naMCI est une entité plus hétérogène par rapport à l’aMCI peut expliquer pourquoi l’étude actuelle n’a pas été en mesure de trouver des structures du SNC avec une taille diminuée dans le groupe naMCI par rapport au groupe aMCI.
Conclusions
La dénomination de l’aMCI et du naMCI n’est pas seulement théorique mais ces sous-types sont des entités différentes à la fois d’un point de vue neuropsychologique et d’un point de vue structurel cérébral. Le développement de critères IRM et neuropsychologiques spécifiques pour les différents sous-types de troubles cognitifs légers permettra ensuite d’évaluer les déterminants et la prévalence des sous-types de MCI.
L’attribution de sous-types de MCI sera utile pour améliorer la prédiction du type de démence et le risque de conversion en démence. En outre, l’attribution de sous-types de MCI peut fournir une meilleure approche pour tester l’efficacité des options thérapeutiques dans la prévention de la conversion aux troubles neurocognitifs. Sur la base de nos résultats, l’IRM peut être un outil utile à la séparation plus précise entre les sous-types de MCI.
Contributions des auteurs
GC a conçu l’étude, rédigé le protocole, entrepris l’analyse statistique, créé les figures et rédigé la première version du manuscrit ES a participé à l’exécution des mesures, géré les recherches et les analyses de la littérature et rédigé la première version de l’introduction et de la conclusion. ÁS a contribué à la finalisation de toutes les sections du manuscrit. ZF, AH ont participé à l’exécution des mesures, et ont contribué à la rédaction de la section méthodes. ÉC, PS, ZH, GR ont supervisé les expériences au cours de l’étude, y compris la rédaction du manuscrit. Tous les auteurs ont contribué et ont approuvé le manuscrit final.
Funding
L’étude a été soutenue par la subvention « Ambient Assisted Living Joint Programme (AAL)-Call 2 » (Identifiant de projet : AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). The diagnosis of mild cognitive impairment due to Alzheimer’s disease : recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 7, 270-279. doi : 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Validation de l’examen cognitif révisé allemand d’Addenbrooke pour la détection de la déficience cognitive légère, de la démence légère dans la maladie d’Alzheimer et de la dégénérescence lobaire frontotemporale. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi : 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neural systems supporting lexical search guided by letter and semantic category cues : une étude de la fluidité verbale par IRMf en réponse spontanée. Neuroimage. 49, 1099-1107. doi : 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., et Angermeyer, M. C. (2002). Les troubles cognitifs légers – un examen de la prévalence, de l’incidence et des résultats selon les approches actuelles. Acta Psychiatr. Scand. 106, 403-414. doi : 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., et Braak, E. (1991). Mise en scène neuropathologique des changements liés à la maladie d’Alzheimer. Acta Neuropathol. 82, 239-259. doi : 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Identifying cognitively healthy elderly individuals with subsequent memory decline by using automated MR temporoparietal volumes. Radiology 259, 844-851. doi : 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., et Sereno, M. I. (1999). Analyse corticale basée sur la surface. I. Segmentation et reconstruction de surface. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer’s disease. Brain 132, 2048-2057. doi : 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. (2004). MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol. Aging 25, 1197-1203. doi : 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., et Dale, A. M. (2000). Mesure de l’épaisseur du cortex cérébral humain à partir d’images de résonance magnétique. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi : 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequence-independent segmentation of magnetic resonance images. Neuroimage 23(Suppl. 1), S69-S84. doi : 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Analyse corticale basée sur la surface. II : Inflation, flattening, and a surface-based coordinate system. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., et Dale, A. M. (1999b). Moyennage intersujet à haute résolution et système de coordonnées pour la surface corticale. Hum. Brain Mapp. 8, 272-284. doi : 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., et DeKosky, S. T. (2004). Mild cognitive impairment, amnestic type : an epidemiologic study. Neurology 63, 115-121. doi : 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., et Goldberg, T. E. (2011). Utilité des combinaisons de biomarqueurs, de marqueurs cognitifs et de facteurs de risque pour prédire la conversion d’une déficience cognitive légère en maladie d’Alzheimer chez les patients de l’initiative de neuroimagerie de la maladie d’Alzheimer. Arch. Gen. Psychiatry 68, 961-969. doi : 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). La déficience cognitive MIld peut être distinguée de la maladie d’alzheimer et du vieillissement normal pour les essais cliniques. Arch. Neurol. 61, 59-66. doi : 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Validité prédictive et stabilité diagnostique des sous-types de déficience cognitive légère. Alzheimers Dement. 8, 553-559. doi : 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., et Minthon, L. (2006). Association entre les biomarqueurs du LCR et la maladie d’Alzheimer naissante chez les patients présentant une déficience cognitive légère : une étude de suivi. Lancet Neurol. 5, 228-234. doi : 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., et Phillips, L. H. (2004). Performance de la fluence verbale dans la démence de type Alzheimer : une méta-analyse. Neuropsychologia 42, 1212-1222. doi : 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Use of structural magnetic resonance imaging to predict who will get Alzheimer’s disease. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Incidence et résultat de la déficience cognitive légère dans une cohorte prospective basée sur la population. Neurology 59, 1594-1599. doi : 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Neuropsychological Assessment, 4th Edn. New York, NY : Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., et Hodges, J. R. (2000). A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology 55, 1613-1620. doi : 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF biomarkers and incipient Alzheimer disease in patients with mild cognitive impairment. JAMA. 302, 385-393. doi : 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimer disease : quantitative structural neuroimaging for detection and prediction of clinical and structural changes in mild cognitive impairment. Radiology 251, 195-205. doi : 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI conversion to dementia and the APOE genotype : a prediction study with FDG-PET. Neurology 63, 2332-2340. doi : 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. (2011). De multiples indices de diffusion identifient les lésions de la substance blanche dans la déficience cognitive légère et la maladie d’Alzheimer. PLoS ONE 6:e21745. doi : 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). La déficience cognitive légère en tant qu’entité diagnostique. J. Intern. Med. 256, 183-194. doi : 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., et Negash, S. (2008). Déficit cognitif léger : un aperçu. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Mild cognitive impairment : clinical characterization and outcome. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., et DeKosky, S. T. (2001). Practice parameter : early detection of dementia : mild cognitive impairment (an evidence-based review). Rapport du sous-comité des normes de qualité de l’Académie américaine de neurologie. Neurologie 56, 1133-1142. doi : 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). La relation entre le test de fabrication de pistes et les lésions cérébrales organiques. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Enregistrement cohérent inverse hautement précis : une approche robuste. Neuroimage 53, 1181-1196. doi : 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris : Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). A hybrid approach to the skull stripping problem in MRI. Neuroimage 22, 1060-1075. doi : 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Le trouble cognitif léger : même identité pour des entités différentes. J. Alzheimers Dis. 33, 1157-1165. doi : 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Surveillance des signes précoces du déclin cognitif chez les personnes âgées par les jeux informatiques : une étude IRM. PLoS ONE 10:e0117918. doi : 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013) . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., et Lushene, R. (1970). Manuel pour l’inventaire d’anxiété d’état-titre Palo Alto, TX : Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., et Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3e Edn. New York, NY : Oxford University Press.
Strauss, E., Sherman, E. M. S., et Spreen, O. (eds.). (2006b). « Mini Mental State Examination (MMSE), » in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY : Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A et B : données normatives stratifiées selon l’âge et l’éducation. Arch. Clin. Neuropsychol. 19, 203-214. doi : 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Coherent spontaneous activity identifies a hippocampal-parietal memory network. J. Neurophysiol. 96, 3517-3531. doi : 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Échelle de dépression gériatrique. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Grey matter atrophy of basal forebrain and hippocampus in mild cognitive impairment. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi : 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar