Introduction
アルツハイマー病(AD)を含む主要神経認知障害(NCD)は、社会・経済・医療に大きな障害を持つ高齢社会の問題であり、その対策として、認知症の早期発見と早期治療に取り組んでいます。 現在、NCDに対する有効な治療法がないため、近年は初期症状の発見に重点を置いた研究が行われている。 最近の多くの研究から、ADの病理学的プロセスは、認知機能低下の最初の症状が現れる数十年前に始まっていることが明らかになっています(Mattsson et al.) 生理的加齢に伴う認知機能の低下と認知症に伴う重度の低下の中間段階である「軽度認知障害」(MCI)が注目されています。 「MCIでは、神経心理学的検査によって認知能力の軽度の低下が明らかになりますが、全体的な認知機能や日常生活は維持されます」(Petersen, 2004)。 MCIではNCDへの移行率が高いことから、この病前状態の臨床的重要性が指摘されています。 NCDへの転換率は、平均的な高齢者の年間転換率が1-4%であるのに対し、MCIでは年間10-15%である(Petersen et al., 2001; Bischkopf et al., 2002)。 これらの患者の大多数は臨床的なADを発症する。 MCIは、認知症に進行しない安定した状態、あるいは逆の状態である可能性もあることに留意する必要がある。 縦断的な疫学研究により、MCIの転換率は多様であり、正常な認知機能への復帰は比較的頻繁に起こることが報告されている(Larrieu et al.) また、異なる知見から、診断精度が不安定であり、MCI患者をより具体的に識別する必要があることが示唆されている(Han et al.、2012)。 以上のことから、認知症の発症に密接に関連し、早期診断に役立つような症状や平均的な人口との差異を対象とした研究がいくつか行われていることは理解できる。 aMCIでは、記憶喪失が優勢であり、さらにADへの転換のリスクが高い(Grundman, 2004)。 naMCIでは、記憶以外の領域にも障害があり、びまん性レビー小体型認知症など、他の認知症に移行するリスクが高いとされています。 両者とも、単一領域型と多領域型に分類できるが、今回の調査ではサンプル数が限られているため、これ以上の分類は行わなかった。 MCIのバイオマーカーは、ADに移行する患者の特徴を特定する目的で、さまざまな種類のものがテストされてきました。 脳脊髄液バイオマーカー(Hansson et al., 2006)やポジトロン断層法(Mosconi et al., 2004)の結果は、特異度や感度が大きく異なることを指摘したが、構造的磁気共鳴画像法の研究では、素晴らしい結果が得られた(Jack et al.) 興味深いことに,いくつかの先行研究はMCIと健常対照者の違いを調査しているが,MCIのサブタイプを区別しようとした研究はわずかである(Zhangら,2011;Serraら,2013)。
aMCIとnaMCIは理論的には異なる存在だが,これらのサブタイプ間の脳構造の違いを調査した調査はごくわずかである(Serraら,2013)。 本研究の目的は,aMCIとnaMCIの構造的な差異を見出し,aMCIと健常対照者の差異に関するこれまでの知見を再現することである。 MCIと認知症への転換に関する先行研究に基づいて、我々は側頭葉とその近傍領域の構造に注目した(Chiang et al, 2011):内嗅皮質、海馬、海馬傍皮質、扁桃体、楔前部、後帯状皮質、帯状回峡部。
Methods
この研究は、我々が以前に発表した研究(Sirály et al.、2015)を継続したものである。 本研究では、同様の神経心理学的テストバッテリー、および同じMRI取得と処理パイプラインが使用されているため、方法と手順は両論文で同様に説明されています
倫理声明
実験はヘルシンキ宣言とすべての関連国内および国際倫理指針に完全に準拠して行われた。 本研究は、ハンガリー・ブダペストの国家倫理委員会により承認された。 すべての手続きは,参加者から書面によるインフォームドコンセントを得た後に実施された。 参加を辞退した参加候補者は,研究に参加しなかったことによっていかなる不利益も受けなかった。
参加者
研究はブダペストのセンメルヴェイス大学精神医学・心理療法学部で行われた。 合計62名の被験者が研究に参加した。 対象者は全員,開業医やリタイアメントホームで告知された認知トレーニングプログラムへの参加を希望した(本試験はClinicalTrials.govに登録されており,IDは「NCT02310620」である)。 対象者は全員、自立した生活を送ることができる。 人口統計学的および神経心理学的な基本データを表1にまとめた。 aMCIとnaMCIの被験者、および健常対照者は、Petersen基準(Petersen, 2004)に基づいて研究に参加した。 Petersen基準は,日常生活動作の維持,標準的な神経心理学的テストに基づく記憶障害,全体的な認知機能の維持,最終的に認知症の除外とともに,情報提供者によって確証された主観的な記憶の苦情を含んでいる。 記憶障害の評価のための神経心理学的検査は規定されていないため、文献に基づき最も頻繁に使用されているRey Auditory Verbal Learning Test(RAVLT)を適用した(Gomar et al.、2011年)。 aMCIと健常対照者を区別するために、年齢と性別で標準化した母集団平均の1SD未満をカットオフスコアとして適用した。 遅延記憶のサブスコアまたは総スコアのいずれかがカットオフ値を下回った参加者は、aMCI群に分類された。 適用基準は、National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease (Albert et al., 2011)の勧告に基づくものであった。 異なる年齢層に対するRAVLTの正確なカットオフスコアは、表2Aに示されている。 aMCI群に属さないが、Trail making Test BまたはAddenbrooke’s Cognitive Examination(ACE)において、年齢と性別/教育水準で標準化した集団平均を1SD下回った被験者は、naMCI群に属すこととした。 NaMCI群の追加基準は、ACEのVLOM(言語流暢性+言語スコア/方向性+記憶スコア)比が3.2より低いことで、aMCIの可能性がある被験者をnaMCI群から除外した(これらの被験者は研究から除外した)

Table 2. (A). Rey Auditory Verbal Learning Test(RAVLT):年齢で調整した軽度認知障害(MCI)の標準データとカットオフスコア;(B)Mini Mental Examination Test(MMSE):年齢と教育で調整した認知症のカットオフスコア
認知症の被験者は年齢と教育で標準化したミニ精神状態検査(MMSE)スコアにより研究から除外した(Straussら、2006b)。 年齢・学歴別のMMSEの正確なカットオフスコアは表2Bに示すとおりである。 頭部外傷、てんかん、脳卒中の既往、急性精神疾患、統合失調症、躁病、アルコール依存症の診断がある被験者も研究対象から除外した。 画像取得はブダペストのSemmelweis大学MR研究センターで,8チャンネルのSENSEヘッドコイルを備えた3 Tesla Philips Achieva臨床MRIスキャナーで行われた。 高解像度の全脳解剖学的画像はT1重み付け3次元スポイルドグラディエントエコー(T1W 3D TFE)シーケンスを用いて取得された。 各被験者から180枚の連続スライスを取得し、以下の撮影パラメータを設定した。 TR = 9.7 ms; TE = 4.6 ms; フリップ角 = 8°; FOV 240 × 240 mm; voxel size 1.0 × 1.0 × 1.0 mm。
皮質再構成と体積分割はFreesurfer 5.3 image analysis suiteで行い、これはドキュメント化されていてオンラインで自由にダウンロードできる (http://surfer.nmr.mgh.harvard.edu/). これらの手順の技術的な詳細は先行文献に記載されており、我々はこのパイプラインに変更を加えていない。 簡潔に言えば、画像処理には、動き補正(Reuterら、2010)、ハイブリッド流域/表面変形手順を用いた非脳組織の除去(Segonneら、2004)、自動タライラチ変換、皮質下白質のセグメンテーション、および深部灰白質容積構造(海馬、扁桃体、尾状核、被殻、脳室など)(Fischlら、.2010)が含まれる。 2004)の強度正規化、灰白質白質境界のテッセレーション、自動トポロジー補正、強度勾配に従った表面変形を行い、灰白質/白質、灰白質/脳脊髄液境界を、強度の最大変化により他の組織クラスへの移行を規定する場所に最適に配置した(Daleら、1999;FischlおよびDale、2000)。 皮質モデルが完成すると、Freesurferは、さらなるデータ処理と解析のために、多くの変形可能な手順を実行しました。 そのステップには、サーフェスインフレーション(Fischlら、1999a)、被験者間で皮質形状を一致させるために個々の皮質折りたたみパターンを利用した球状アトラスへの登録(Fischlら、1999b)、回旋と溝構造に基づく大脳皮質のユニットへの分割(Fischlら、2004)、曲率と溝深度のマップなど様々な表面ベースのデータの作成が含まれます。 最後に皮質モデルとセグメンテーションの結果は、各被験者の品質チェックと手動で修正されたが、修正によって結果に有意な変化は見られなかった
Procedures
神経心理学検査は、平日の午前8時から午後4時まで行われ、検査はコンピュータ(PALテスト)と紙ベースの神経心理学検査からなる。 検査は、患者と検査者だけが立ち会う明るい別室で行われた。 神経心理学的検査は,心理学者と精神科医の監督のもとで,以前に訓練を受けた医学生2名が実施した。 検査の評価にあたっては、Neuropsychological Compendium (Strauss et al., 2006a) のガイドラインに従った。 紙ベースのテストは、同じ心理学者と精神科医によって、Compendiumに準じて評価された。 PALテスト(Paired Associates Learning Test)はソフトウェアにより自動評価された。 MRデータもFreesurferとSASというソフトウェアで自動的に解析・評価されたので、神経画像データの解析には主観的な判断は加わっていない。 PALテストやニューロイメージングデータの評価・判定は完全に自動化されているため、人間の判断によるバイアスは少ない(紙ベースのテストの評価のみに限定)
Mini Mental State Examination(MMSE)に基づいて認知症の被験者を研究対象から除外した。 MMSEは標準的な検査であり、認知症の被験者と健常対照者を区別する有用な方法として、いくつかの研究によってその有効性が証明されている(Petersen et al.、1999;Gomar et al.、2011)。 先行研究の多くは、認知症のカットオフスコアである26点または年齢調整スコアを用いている。 テストのサブタスクは、志向性、中枢実行機能、迅速な関連形成、言語識別能力、分析・合成能力を評価する。
AdenbrookeのCognitive Examinationは、志向性、注意、記憶、言語流動性、言語、視空間能力などのグローバル認知能力の評価に使用されている(Mathuranath et al, 2000; Alexopoulos et al., 2010)。
Petersen基準に基づく記憶機能の詳細な評価には、Rey Auditory Verbal Learning Testが使用された。 レイテストは言語学習と記憶を評価するテストである(Rey, 1958)。 15語のリスト(リストA)を被験者が即座に反復すること。 このテストは5回繰り返される。 次に、別の15語のリスト(リストBまたは干渉リスト)を1回提示し、それを想起させる。
Trail Making test, Part A and Part B (number connection; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) は選択的注意、実行機能、認知的柔軟性を評価するために使用される. Part Aでは、ランダムに配置された数字を数字の順につなげる必要があり、Part Bでは、ランダムに配置された数字と文字が表示される。 被験者は、あらかじめ決められた順序で数字と文字をつなげるように指示される。 従属変数は、テストを完了するのに必要な時間である。 TMTのパートAは実行機能と注意力を測定し,パートBの成績には認知的柔軟性も反映される。
すべての参加者は,自身の健康状態と記憶機能を評価するフォームに記入し,さらにコンピュータとインターネットの使用,娯楽活動,アルコール消費,食習慣,喫煙について報告しなければならなかった(Yesavage,1988年)。 抑うつ症状の評価には老年期抑うつ尺度(GDS)を用い、不安症状はSpielberger State-Trait Anxiety Inventory(STAI; Spielberger et al. “PALテストでは、1つ以上のウィンドウに抽象的な図形が表示された状態で、3秒間、画面上のランダムな位置で互いにウィンドウが開く。 難易度によって、他のウィンドウは空白のままである。 すべての正方形が表示されると、画面中央に以前に表示された図形が現れ、被験者はその図形をどのウィンドウで見たかを判断しなければならない。 テストは5段階、計8ステージで構成され、各ステージで図形の数は1から8まで増加する。 被験者は10回の試行で1ステージを終了し、それ以外はテストが終了する。 窓の配置は非対称であり、ステージごとに変化する。 (Siraly et al., 2013) コンピュータ化されたテストの間、被験者はコンピュータ画面から半メートルの距離で快適に座り、事前情報に従ってマウスを使って課題を解いた。
統計解析
脳体積、皮質厚、認知パフォーマンスの研究グループ間の差は、年齢と性別を共変量として一般線形モデル解析(SAS 9.2のGLM)により解析された。 体積は頭蓋内総体積(TIV)で標準化し、百分率で表示した。 群間差を分析するために、p値は0.05/3 = 0.016に調整され、ここで3は群間比較の数を表す。
神経心理学的検査の結果とCNS構造の大きさの関係は、ピアソン相関で分析された。
Results
Differences in Cortical Volumes, Cortical Thickness and Cognitive Performance between Subjects with amci, namci and Controls
海馬と嗅内皮質の容積に研究グループ間で有意差が認められた. 共変量のうち,性別は海馬の体積に有意な影響を及ぼし,男性は女性に比べ海馬の大きさが有意に減少した. 図1
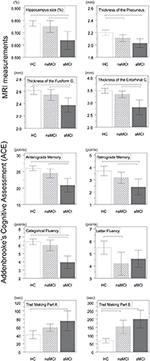
図1. 中枢神経系構造および神経心理学的検査における群間差。 縦棒は群平均を、エラーバーは標準偏差を表す。 縦棒の上の横線は多重比較補正後の有意な群間差を示す(p<1521>0.016)。 HCは健常対照群,aMCIはamnestic mild cognitive impairment,naMCIはnon amnestic mild cognitive impairment,CNSはCentral nervous system。 また、aMCI群ではnaMCI群に比べ、内嗅皮質、楔状回の厚さが有意に減少していた。 群平均値、ポストホックテスト結果、Cohenのdによる群間差は表3にまとめた。
前向記憶、逆行記憶、カテゴリー流暢性で研究群間で有意差があった。 前向性記憶とカテゴリー別流暢性では、対照群とnaMCI群の両方がaMCI群を上回ったが、前者には有意差はなかった(表3)。 逆行性記憶では、対照群はaMCI群を上回ったが、naMCI群には及ばなかった。 文字流暢性では、対照群はnaMCI群を上回ったが、aMCI群には及ばなかったが、両MCI群に差はなかった(p > 0.05)。 さらに,カテゴリー別流暢性では,女性被験者が男性よりも良好な成績を示したが,年齢には有意な影響がなかった。
相関分析
全標本において,神経心理学的検査の結果と側頭脳構造の体積および厚さの間に強い相関が認められた(表4)。
aMCI群では,Rey Verbal Learning Testの結果は,扁桃体の大きさ(r = 0.47,n = 20,p = 0.03)および内腸皮質の厚さ(r = 0.46,n = 20,p = 0.04; 図2)と有意な正の相関が見られた. 扁桃体の体積が減少し、内膜の厚さが減少した被験者は、記憶テストの成績が悪くなった

Figure 2. Rey言語学習テストで指標とした短期記憶パフォーマンスと研究グループにおける扁桃体積および内腸皮質の厚さとの相関。 ピアソン相関は,健忘症MCI群と全標本で有意(p<1521>0.05)であったが,対照群と非健忘症MCI群では有意でなかった。 縦軸のレイ言語テスト合計得点は、最初の5試行の単語の合計に等しい。赤線はMCI群の回帰直線、破線は全標本の回帰直線、MCIは軽度認知障害、rとpは年齢で調整したピアソン相関係数とMCI群の有意水準に対応するもの。
さらに、内膜体積の減少(r = 0.49, n = 19, p = 0.03)、楔状回体積(r = 0.48, n = 19, p = 0.04) および楔状皮質の厚さの減少(r = 0.48, p = 0.53, n = 19, p = 0.02)は,ACEの逆行性記憶下位検査で弱い成績を示した。
Discussion
異なるタイプのNCDsの前兆として,無名のMCIと非名のMCIが割り当てられた。 無記名性軽度認知障害の対象者はアルツハイマー型認知症に移行するリスクが高いとされ、非無記名性軽度認知障害の対象者は非アルツハイマー型認知症に移行するリスクが高いとされる(Petersen et al, 1999; Killiany et al., 2000; Petersen and Negash, 2008)。
MCIサブグループと健常対照群ではMRIにより脳の構造差を、神経心理テストにより認知能力の差を検討した。 MRIの結果,MCIでは内嗅皮質,楔状回,帯状回峡部,楔前部の厚さ,扁桃体,海馬の体積が健常対照群に比べ減少していた。 これらの結果は、扁桃体や海馬などの側頭葉構造の体積に基づいて健常者、MCI患者、アルツハイマー病患者を区別することができると報告した先行研究(Desikan et al, 2009; McEvoy et al., 2009)。
海馬と内腸皮質の体積、内腸皮質と楔状回の厚さは、naMCI群に比べaMCI群で有意に減少している。 このことは、ADの萎縮がこの領域から始まるという事実と一致している。 これらの結果は、MCIのサブタイプ間に早期の構造的差異があることを示している。 さらに、これらの構造的所見のパターンは、アルツハイマー病の病態に適合しており(Braak and Braak, 1991)、これは、aMCIがnaMCIに比べて高い頻度でアルツハイマー病に進行するというこれまでの結果(Killiany et al, 2000; Petersen and Negash, 2008)を裏付けた。 興味深いことに,最近の研究では,naMCI患者の白質病変は楔前部にも認められた(O’Dwyer et al.,2011)。楔前部は海馬傍回と前頭前野の間の情報伝達を持続する重要なハブであり(Vincent et al. ACE total,ACE anterograde memory,ACE category fluencyの各下位検査において,aMCI群はnaMCI群および健常対照群に比べ成績が悪かった。 ACEの逆行性記憶検査とTrail Making AおよびB検査では、aMCI群は健常対照群よりも成績が悪いだけで、2つのMCIサブグループ間の差は検出されなかった。 aMCI群の記憶課題(RAVLTとACE逆行性記憶課題)の成績低下は、内嗅皮質、扁桃体などの側頭葉構造の関与の増加と相関し(図2)、群間差に関する我々の結果をさらに裏付けるものであった。 Trail making B testは視覚的注意とタスクスイッチングの指標である。 両MCI群の成績が対照群と比較して低下しているのは(表3)、前頭葉の関与の結果と考えられる。 カテゴリーと文字の流暢性タスクはどちらも前頭葉の機能に強く依存しており、これには、被験者が検索を組織化し、以前に思い出した反応を監視し、言語的反応を開始し、基準内に収まらない反応を抑制することを必要とする実行プロセスが含まれる(Henry et al.、2004)。 「両測定とも、側頭葉の機能である意味記憶の貯蔵にアクセスしますが、文字の流暢性は、カテゴリーの流暢性よりも程度は低いものの、側頭葉とリンクしたこの能力を利用しているようです」(Lezakら、2004年)。 病変や脳機能イメージング研究もまた、流暢性能力における側頭葉と前頭葉の関与を裏付けています。 以前のfMRI研究では、文字流暢性は前頭葉の活性化に関連し、カテゴリー流暢性では前頭葉と側頭葉の両方が活性化することが示されています(Birn et al.) これは、aMCIが健常者とnaMCI群に比べ、カテゴリー流暢性で有意な差があり、文字流暢性では2つのサブグループ間に有意差がないという我々の知見とよく対応している。
RAVLTとPALテストによって指標される言語と視覚記憶機能、および内膜皮質などの側頭構造の体積と皮質厚の間に強い相関が全例で、さらにaMCI群でも認められた(表4)(図2)。
限界
本研究の限界は、aMCI群の被験者の大半は、trail making test BとACEで評価した実行機能の成績が正常範囲外であり、多領域型であることであった。 aMCIと比較してnaMCIはより異質な存在であるという事実と合わせて、この限界は、本研究がaMCI群と比較してnaMCI群でサイズの減少したCNS構造を見つけることができなかった理由を説明しているかもしれない。 MCIサブタイプの分類は,認知症のタイプや認知症への移行リスクの予測に有用である。 さらに、MCIサブタイプの分類は、神経認知障害への転換を防ぐための治療オプションの有効性を検証するためのより良いアプローチとなる可能性がある。 今回の結果から、MRIはMCIサブタイプのより正確な分類に有用なツールとなり得ることがわかった。 ÁSは原稿の全セクションの最終化に貢献した。 ZF, AHは測定に参加し、方法のセクションの執筆に貢献した。 ÉC, PS, ZH, GRは、原稿執筆を含む研究期間中の実験について監督を行った。
Funding
本研究は、「Ambient Assisted Living Joint Programme (AAL)-Call 2」助成(プロジェクト識別子: AAL_08-1-2011-0005 M3W)、(http://www.aal-europe.eu)により行われたものである。
Conflict of Interest Statement
著者らは、本研究が潜在的な利益相反と解釈され得るいかなる商業的または金銭的関係もない状態で行われたことを宣言する
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C.、他(2011). アルツハイマー病による軽度認知障害の診断:アルツハイマー病の診断ガイドラインに関する国立老化研究所-アルツハイマー病協会ワークグループからの提言。 Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | Cross Ref Full Text | Google Scholar
Alexopoulos, P.Ebert, A.Richter-Schmidinger, T.Scholl, E.Natale, B.Aguilar, C. A.Gourzis, P.、et al. (2010). 軽度認知障害、アルツハイマー病における軽度認知症、前頭側頭葉変性症を検出するためのドイツの改訂版Addenbrooke’s cognitive examinationの妥当性。 Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A.、他 (2010)(2010). 文字と意味カテゴリの手がかりによる語彙検索をサポートする神経系。 言語流暢性の自己ペース型overt response fMRI研究。 Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). 軽度の認知障害-現在のアプローチによる有病率、発生率、転帰のレビュー。 Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H. and Braak, E. (1991). アルツハイマー病関連変化の神経病理学的段階分け。 Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., and al. (2011). MR側頭頭頂部自動ボリュームを使用した、その後の記憶力低下を伴う認知的に健康な高齢者の識別。 Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B. and Sereno, M.I. (1999). 皮質表面に基づく解析。 I.セグメンテーションと表面再構成。 Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W.他 (2009).。 MRIの自動測定により、軽度認知障害とアルツハイマー病の個人を識別する。 Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S.、他 (2004). MRIによる内膜体積は、MCIからADへの転換の良い予測因子である。 Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B. and Dale, A.M. (2000). 磁気共鳴画像からヒト大脳皮質の厚さを測定する。 Proc. Natl.Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T.、他 (2004). 磁気共鳴画像のシーケンスに依存しないセグメンテーション。 Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M.(1999a).MRIを用いた磁気共鳴画像のシークエンスに依存しないセグメンテーション。 皮質表面に基づく解析。 II:膨張、平坦化、およびサーフェスベースの座標系。 Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999 b)(以下略). 高解像度の被験者間平均化と皮質表面の座標系。 Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M…, Dodge, H. H., Shen, C., and DeKosky, S. T. (2004). 軽度認知障害,記憶障害型:疫学的研究。 Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., and Goldberg, T. E. (2011). Alzheimer’s disease neuroimaging initiativeに参加した患者における軽度認知障害からアルツハイマー病への転換を予測するためのバイオマーカー、認知マーカー、危険因子の組み合わせの有用性。 アーチ。 Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004).認知機能障害のある患者を対象に、認知機能障害とアルツハイマー病への転換を予知するためのバイオマーカーとリスク因子の組み合わせの有用性を検討。 高齢者認知障害は、臨床試験においてアルツハイマー病や正常老化と区別することができる。 Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y.、他 (2012). 軽度認知障害サブタイプの予測妥当性と診断の安定性。 Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K. and Minthon, L. (2006). 軽度認知障害患者におけるCSFバイオマーカーと初期アルツハイマー病との関連:追跡調査。 Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). アルツハイマー型認知症における言語流暢性パフォーマンス:メタアナリシス。 Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C.R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al.(1999)。 軽度認知障害におけるMRIを用いた海馬体積によるADの予知。 Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al.(2000).海馬の体積をMRIで測定し、ADの発症を予測する。 アルツハイマー病になる人を予測するための構造的磁気共鳴イメージングの使用。 Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N.ら(2002年). 人口ベースの前向きコホートにおける軽度認知障害の発生率と転帰。 Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). 神経心理学的評価、第4版。 New York, NY: オックスフォード大学出版局.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R.(2000).神経心理学的評価、第4版、ニューヨーク、NY. アルツハイマー病と前頭側頭型認知症の鑑別のための簡単な認知機能テストバッテリー。 Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M.他 (2009).認知症は、認知症である。 軽度認知障害患者におけるCSFバイオマーカーと初期のアルツハイマー病。 JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. Jr., Holland, D.、その他(2009). アルツハイマー病:軽度認知障害における臨床的および構造的変化の検出と予測のための定量的構造神経画像。 Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | Cross Ref Full Text | Google Scholar
Mosconi, L., Perani, D. , Sorbi, S., Herholz, K. , Nacmias, B., Holthoff, V. , et al. MCIから認知症への移行とAPOE遺伝子型:FDG-PETによる予測研究。 Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C.,et al. (2011). 拡散の複数の指標は、軽度認知障害とアルツハイマー病における白質障害を特定する。 PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004).白質障害を識別する複数の拡散指標(Medical Indices of Diffusion). 診断上の実体としての軽度認知障害。 J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen,R. C., and Negash, S. (2008). 軽度認知障害:概要。 CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). 軽度の認知障害:臨床的特徴づけと転帰。 Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R.C., Stevens, J.C., Ganguli, M., Tangalos, E.G., Cummings, J.L., and DeKosky, S.T. (2001). Practice parameter: Early detection of dementia: mild cognitive impairment (an evidence-based review)(実践パラメータ:認知症の早期発見:軽度認知障害)。 米国神経学会の品質基準小委員会の報告書。 Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). 脳の器質的損傷とtrail making testの関係。 J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). 高精度な逆一貫レジストレーション:ロバストアプローチ。 Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A.(1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K.他 (2004). MRIにおける頭蓋骨ストリッピング問題へのハイブリッドアプローチ。 Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M. , Castelli, D.、他 (2013).。 軽度認知障害:異なる実体のための同じアイデンティティ。 J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C.、他(2015). コンピュータゲームによる高齢者の認知機能低下の初期徴候のモニタリング:MRI研究. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013).。 Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., and Lushene, R. (1970). マニュアル for the State-Trait Anxiety Inventory Palo Alto, TX: コンサルティング・サイコロジスト・プレス.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a).のマニュアル。 神経心理学的検査の大要、第3版。 New York, NY: オックスフォード大学出版局.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). 「ミニ・メンタル・ステート・テスト(MMSE)」(Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004).を参照。 軌跡作成テストAとB:年齢と教育によって層別化された規範的データ。 Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | Cross Ref Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E.、他 (2006)(2011). 海馬-頭頂葉の記憶ネットワークを特定するコヒーレントな自発的活動。 J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J.A. (1988). 老年期うつ病スケール。 Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A.他 (2011). 軽度認知障害における前脳基底部および海馬の灰白質萎縮。 J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar