- Introduzione
- Metodi
- Dichiarazione etica
- Partecipanti
- Acquisizione ed elaborazione delle immagini RM
- Procedure
- Analisi statistica
- Risultati
- Differenze nei volumi corticali, spessore corticale e prestazioni cognitive tra soggetti con amci, namci, e controlli
- Analisi correlazionali
- Discussione
- Limitazioni
- Conclusioni
- Contributi degli autori
- Finanziamento
- Conflict of Interest Statement
Introduzione
I grandi disturbi neurocognitivi (NCD) o demenza, compreso il morbo di Alzheimer (AD), sono un problema devastante della nostra società che invecchia, con un enorme peso sociale, economico e medico. Dal momento che al momento non abbiamo un trattamento efficace per il NCD, la ricerca recente si è concentrata sul rilevamento dei sintomi precoci. Prove convergenti da molti studi recenti hanno rivelato che il processo patologico di AD inizia decenni prima dei primi sintomi di declino cognitivo (Mattsson et al., 2009). Lo stadio intermedio tra il declino cognitivo previsto nell’invecchiamento fisiologico e il declino grave nella demenza, noto come “decadimento cognitivo lieve” (MCI) ha guadagnato molto interesse. “Nell’MCI una lieve compromissione delle capacità cognitive può essere rivelata da test neuropsicologici, mentre le funzioni cognitive globali e le attività quotidiane sono conservate” (Petersen, 2004). Il più alto tasso di conversione in NCD nell’MCI dà il significato clinico di questa condizione pre-malattia. Il tasso di conversione in NCD è del 10-15% all’anno nell’MCI rispetto al tasso annuale dell’1-4% nella popolazione anziana media (Petersen et al., 2001; Bischkopf et al., 2002). La maggior parte di questi pazienti sviluppa un AD clinico. Va notato che l’MCI potrebbe essere anche una condizione stabile o inversa che non progredisce in demenza. Studi epidemiologici longitudinali hanno riportato un tasso di conversione variato e una reversione relativamente frequente alla cognizione normale (Larrieu et al., 2002; Ganguli et al., 2004). Diversi risultati suggeriscono l’instabilità dell’accuratezza diagnostica e la necessità di un’identificazione più specifica tra i pazienti MCI (Han et al., 2012). Alla luce di quanto sopra, è comprensibile che diversi studi si concentrino sui sintomi e sulle differenze rispetto alla popolazione media che sono strettamente legati allo sviluppo della demenza e possono quindi essere utilizzati per aiutare la diagnosi precoce.
I pazienti con MCI possono essere ulteriormente classificati come MCI amnestico (aMCI) e non amnestico (naMCI). Nell’aMCI la perdita di memoria è predominante ed è associata a un alto rischio di ulteriore conversione in AD (Grundman, 2004). Gli individui con naMCI hanno problemi in altri domini oltre alla memoria e hanno un rischio maggiore di convertirsi in altre forme di demenza come la demenza diffusa a corpi di Lewy. Entrambi i tipi possono essere ulteriormente categorizzati in sottotipi a singolo dominio e multi dominio, tuttavia nella presente indagine non è stata fatta un’ulteriore categorizzazione a causa della limitata dimensione del campione. Tipi significativi di biomarcatori di MCI sono stati testati con l’obiettivo di identificare le caratteristiche speciali dei pazienti che si trasformano in AD. Mentre i risultati dei biomarcatori del liquido cerebrospinale (Hansson et al., 2006) e gli studi di tomografia a emissione di positroni (Mosconi et al., 2004) hanno evidenziato una specificità e una sensibilità molto variabili, gli studi di risonanza magnetica strutturale hanno rivelato risultati impressionanti (Jack et al., 1999; deToledo-Morrell et al., 2004). È interessante notare che diversi studi precedenti hanno indagato le differenze tra soggetti con MCI e controlli sani, solo pochi studi hanno cercato di differenziare tra i sottotipi di MCI (Zhang et al., 2011; Serra et al., 2013).
Mentre aMCI e naMCI sono entità teoricamente diverse, solo poche indagini hanno studiato le differenze strutturali del cervello tra questi sottotipi di MCI (Serra et al., 2013). Lo scopo dello studio è stato quello di trovare le differenze strutturali tra aMCI e naMCI, e di replicare i risultati precedenti sulla differenziazione tra aMCI e controlli sani. Sulla base di studi precedenti su MCI e conversione in demenza ci siamo concentrati sulle strutture del lobo temporale e le regioni vicine (Chiang et al, 2011): la corteccia entorinale, l’ippocampo, la corteccia paraippocampale, l’amigdala, il giro fusiforme, il precuneo, la corteccia cingolata posteriore e l’istmo del giro cingolato.
Metodi
Questo studio è una continuazione del nostro lavoro precedentemente pubblicato (Sirály et al., 2015). Dal momento che una batteria di test neuropsicologici simile, e la stessa pipeline di acquisizione ed elaborazione MRI è stata utilizzata nel presente studio, i metodi e le procedure sono stati descritti in modo simile in entrambi i documenti.
Dichiarazione etica
Gli esperimenti sono stati condotti nel pieno rispetto della Dichiarazione di Helsinki e tutte le linee guida etiche nazionali e internazionali pertinenti. La ricerca è stata approvata dal Comitato etico nazionale, Budapest, Ungheria. Tutte le procedure sono state eseguite solo dopo aver ottenuto il consenso informato scritto dei partecipanti. Tutti i potenziali partecipanti che hanno rifiutato di partecipare o altrimenti non hanno partecipato non sono stati svantaggiati in alcun modo dalla mancata partecipazione allo studio.
Partecipanti
Lo studio è stato condotto presso il Dipartimento di Psichiatria e Psicoterapia, Università Semmelweis, Budapest. Complessivamente 62 soggetti sono stati arruolati nello studio. Tutti i soggetti hanno chiesto di partecipare a un programma di formazione cognitiva annunciato tra i medici generici e in una casa di riposo (Lo studio è registrato su ClinicalTrials.gov, l’identificatore è “NCT02310620”). Tutti i soggetti erano in grado di condurre una vita indipendente. I dati demografici e neuropsicologici di base sono riassunti nella tabella 1.

Tabella 1. Dati demografici e risultati dei test neuropsicologici di base.
I soggetti con aMCI e naMCI e i controlli sani sono stati inclusi nello studio in base ai criteri di Petersen (Petersen, 2004). I criteri di Petersen includono il reclamo soggettivo della memoria corroborato da un informatore insieme alle attività quotidiane conservate, un deficit di memoria basato su un test neuropsicologico standard, funzioni cognitive globali conservate e infine l’esclusione della demenza. Non specifica un test neuropsicologico per la valutazione dei danni alla memoria, quindi abbiamo applicato il Rey Auditory Verbal Learning Test (RAVLT), che è il test più frequentemente utilizzato in base alla letteratura (Gomar et al., 2011). Per la differenziazione tra aMCI e controlli sani abbiamo applicato un punteggio di cutoff di 1 SD sotto la media della popolazione standardizzata per età e sesso. I partecipanti che hanno ottenuto un punteggio inferiore al valore di cutoff sia nel subscore di richiamo ritardato che nel punteggio totale, sono stati inseriti nel gruppo aMCI. I criteri applicati si basano sulle raccomandazioni del National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease (Albert et al., 2011). I punteggi cutoff esatti per il RAVLT per i diversi gruppi di età sono forniti nella Tabella 2A. I soggetti che non erano nel gruppo aMCI, ma hanno ottenuto un punteggio di 1 SD sotto la media della popolazione standardizzata per età e sesso/istruzione nel Trail making Test B o nell’Addenbrooke’s Cognitive Examination (ACE), sono stati inseriti nel gruppo naMCI. Un ulteriore criterio per il gruppo naMCI era un rapporto VLOM (punteggio di fluenza verbale + linguaggio/orientamento + memoria) inferiore a 3,2 nell’ACE per escludere possibili soggetti aMCI dal gruppo naMCI (questi soggetti sono stati esclusi dallo studio).

Tabella 2. (A). Rey Auditory Verbal Learning Test (RAVLT): dati normativi e punteggi di cut-off per il Mild Cognitive Impairment (MCI) aggiustati per l’età; (B) Mini Mental Examination Test (MMSE): punteggi di cut-off per la demenza aggiustati per età e istruzione.
I soggetti con demenza sono stati esclusi dallo studio in base ai punteggi del Mini Mental State Examination (MMSE) standardizzati per età e istruzione (Strauss et al., 2006b). I punteggi esatti per il MMSE nei diversi gruppi di età e istruzione sono forniti nella tabella 2B. I soggetti con storia di trauma cranico, epilessia o ictus, o diagnosi di disturbo psichiatrico acuto, schizofrenia o mania, dipendenza da alcol sono stati esclusi dallo studio.
Acquisizione ed elaborazione delle immagini RM
Tutti i soggetti sono stati esaminati mediante risonanza magnetica cerebrale producendo immagini strutturali ad alta risoluzione, che sono state utilizzate per ulteriori elaborazioni e analisi. Le acquisizioni delle immagini sono state effettuate presso il Centro di Ricerca MR, Università Semmelweis, Budapest su uno scanner di risonanza magnetica clinica Philips Achieva 3 Tesla dotato di una bobina cranica SENSE a otto canali. L’alta risoluzione, le immagini anatomiche dell’intero cervello sono state ottenute utilizzando una sequenza T1 pesata a 3 dimensioni spoiled gradient echo (T1W 3D TFE). 180 fette contigue sono state acquisite da ogni soggetto con i seguenti parametri di imaging: TR = 9.7 ms; TE = 4.6 ms; flip angle = 8°; FOV di 240 × 240 mm; dimensione del voxel di 1.0 × 1.0 × 1.0 mm.
La ricostruzione corticale e la segmentazione volumetrica sono state eseguite da Freesurfer 5.3 suite di analisi delle immagini, che è documentato e liberamente disponibile per il download online (http://surfer.nmr.mgh.harvard.edu/). I dettagli tecnici di queste procedure sono descritti nelle pubblicazioni precedenti, non abbiamo apportato modifiche a questa pipeline. Brevemente, l’elaborazione delle immagini comprende la correzione del movimento (Reuter et al., 2010), la rimozione del tessuto non cerebrale utilizzando un ibrido spartiacque / superficie procedura di deformazione (Segonne et al., 2004), automatizzato Talairach trasformazione, segmentazione della materia bianca subcorticale, e profonde strutture volumetriche materia grigia (tra cui ippocampo, amigdala, caudato, putamen, ventricoli) (Fischl et al, 2004) normalizzazione dell’intensità, tassellazione del confine tra materia grigia e materia bianca, correzione automatica della topologia e deformazione della superficie a seguito di gradienti di intensità per posizionare in modo ottimale i confini grigio/bianco e grigio/fluido cerebrospinale nel punto in cui il maggiore spostamento di intensità definisce la transizione all’altra classe di tessuto (Dale et al., 1999; Fischl e Dale, 2000). Una volta che i modelli corticali sono stati completati, Freesurfer eseguito una serie di procedure deformabili per in ulteriore elaborazione dei dati e analisi. Le fasi includevano l’inflazione della superficie (Fischl et al., 1999a), la registrazione su un atlante sferico che utilizzava modelli individuali di piegatura corticale per far corrispondere la geometria corticale tra i soggetti (Fischl et al., 1999b), la parcellizzazione della corteccia cerebrale in unità basate sulla struttura giroscopica e sulcale (Fischl et al., 2004), e la creazione di una varietà di dati basati sulla superficie, comprese le mappe di curvatura e profondità sulcale. Infine i modelli corticali e i risultati della segmentazione sono stati controllati e corretti manualmente su ogni soggetto, tuttavia la correzione non ha mostrato cambiamenti significativi nei risultati.
Procedure
Gli esami neuropsicologici sono stati eseguiti nei giorni feriali tra le 8 e le 16. Gli esami consistevano in test neuropsicologici computerizzati (cioè il test PAL) e su carta. I test si svolgevano in una stanza separata e ben illuminata dove erano presenti solo il paziente e un esaminatore. Anche i test di riferimento sono stati completati e valutati secondo le raccomandazioni del Compendio Neuropsicologico (Strauss et al., 2006a), mentre i test computerizzati sono stati valutati dal software.
I test neuropsicologici sono stati somministrati da due studenti di medicina precedentemente formati sotto la supervisione di uno psicologo e uno psichiatra. Durante la valutazione dei test sono state seguite le linee guida del Compendio Neuropsicologico (Strauss et al., 2006a). I test cartacei sono stati valutati dallo stesso psicologo e da uno psichiatra secondo il compendio. I Paired Associates Learning Test (PAL test) sono stati valutati automaticamente da un software. Anche i dati di risonanza magnetica sono stati analizzati e valutati automaticamente dal software Freesurfer e SAS; quindi nessun giudizio soggettivo è stato coinvolto nell’analisi dei dati di neuroimaging. Dal momento che la valutazione del test PAL e dei dati di neuroimaging erano totalmente automatici, i bias da giudizi umani erano bassi (limitati solo alla valutazione dei test cartacei).
I soggetti con demenza sono stati esclusi dallo studio sulla base del Mini Mental State Examination (MMSE). Il MMSE è un test standard; la sua efficacia è stata dimostrata da diversi studi, come un metodo utile per differenziare i soggetti con demenza dai controlli sani (Petersen et al., 1999; Gomar et al., 2011). La maggior parte degli studi precedenti ha utilizzato il punteggio di cut off di 26 o il punteggio adeguato all’età per la demenza. Le sottoattività del test valutano l’orientamento, la funzione esecutiva centrale, la formazione di associazioni rapide, la capacità di identificazione verbale e la capacità di analisi e sintesi.
L’Addenbrooke’s Cognitive Examination è stato utilizzato per valutare le prestazioni cognitive globali, tra cui orientamento, attenzione, memoria, fluenza verbale, abilità verbali e visuospaziali (Mathuranath et al, 2000; Alexopoulos et al., 2010).
Il Rey Auditory Verbal Learning Test è stato utilizzato per la valutazione dettagliata delle funzioni di memoria sulla base dei criteri di Petersen. Il test di Rey valuta l’apprendimento e la memoria verbale (Rey, 1958). Una lista di 15 parole (lista A) deve essere ripetuta dal soggetto immediatamente. Questo test viene ripetuto 5 volte. Poi un’altra lista di 15 parole (lista B o lista di interferenza) viene presentata una volta che dovrebbe essere richiamata. Poi la lista A deve essere ricordata senza ripetere, e poi questo compito viene ripetuto dopo 30 minuti.
Il Trail Making test, parte A e parte B (connessione di numeri; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) è usato per valutare l’attenzione selettiva, le funzioni esecutive e la flessibilità cognitiva. Nella parte A, i numeri distribuiti in modo casuale devono essere collegati in ordine numerico, mentre nella parte B vengono visualizzati numeri e lettere distribuiti in modo casuale. Il soggetto viene istruito a collegare i numeri e le lettere in un ordine predefinito. La variabile dipendente è il tempo richiesto per completare il test. La parte A del TMT misura le funzioni esecutive e l’attenzione, mentre nelle prestazioni della parte B si riflette anche la flessibilità cognitiva.
I risultati dei test neuropsicologici sono riassunti nella tabella 1.
Tutti i partecipanti hanno completato un modulo in cui hanno valutato il proprio stato di salute e la funzione della memoria; inoltre, hanno dovuto riferire sul loro uso del computer e di internet, sulle attività ricreative, sul consumo di alcol, sulle abitudini alimentari e sul fumo (Yesavage, 1988). La Geriatric Depression Scale (GDS) è stata utilizzata per valutare i sintomi depressivi, mentre i sintomi di ansia sono stati misurati con lo Spielberger State-Trait Anxiety Inventory (STAI; Spielberger et al., 1970).
La memoria visuo-spaziale è stata misurata con un’implementazione del test PAL utilizzato in diverse batterie di test neuropsicologici (Siraly et al., 2013). “Nel test PAL le finestre si aprono in posizioni casuali sullo schermo una dopo l’altra per 3 s con forme astratte mostrate in una o più finestre. Altre finestre rimangono vuote a seconda del livello di difficoltà. Quando tutti i quadrati sono stati mostrati, le forme mostrate in precedenza appaiono al centro dello schermo e i partecipanti devono decidere in quale finestra hanno visto quella forma prima. Il test consiste di cinque diversi livelli in otto fasi in totale, il numero di forme aumenta da 1 a 8 nelle diverse fasi. I soggetti avevano 10 prove per completare una data fase, altrimenti il test finiva. La disposizione delle finestre era asimmetrica nel test e cambiava di tappa in tappa.” (Siraly et al., 2013) Durante il test computerizzato i soggetti erano seduti comodamente ad una distanza di mezzo metro dallo schermo del computer e seguendo le informazioni precedenti risolvevano i compiti con l’uso del mouse.
Analisi statistica
Le differenze tra i gruppi di studio nei volumi cerebrali, lo spessore corticale e le prestazioni cognitive sono state analizzate tramite analisi del modello lineare generale (GLM in SAS 9.2) con età e sesso come covariate. I volumi sono stati standardizzati per il volume intracranico totale (TIV), e sono dati in percentuale. Al fine di analizzare le differenze tra i gruppi sono stati applicati i confronti t post hoc, dove i valori di p sono stati aggiustati a 0.05/3 = 0.016, dove tre sta per il numero di confronti tra gruppi.
La relazione tra i risultati dei test neuropsicologici e le dimensioni delle strutture del SNC sono stati analizzati da correlazioni di Pearson. Le correlazioni con il numero di stadi completati nel test PAL sono state analizzate mediante correlazione di Spearman, poiché la distribuzione di questa variabile si discostava ampiamente dalla distribuzione normale.
Risultati
Differenze nei volumi corticali, spessore corticale e prestazioni cognitive tra soggetti con amci, namci, e controlli
È stata trovata una differenza significativa nel volume dell’ippocampo e nel volume della corteccia entorinale tra i gruppi di studio. I test post hoc hanno mostrato che i volumi sono significativamente diminuiti nel gruppo aMCI rispetto ai controlli e al gruppo naMCI, mentre gli altri due gruppi non differivano significativamente (Tabella 3 e Figura 1) Tra le covariate, il genere ha avuto un effetto significativo sul volume dell’ippocampo, i soggetti maschi avevano una dimensione dell’ippocampo significativamente diminuita rispetto alle femmine .
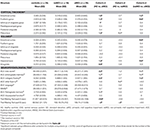
Tabella 3. Differenze delle strutture del SNC e dei risultati dei test neuropsicologici tra i gruppi di studio.
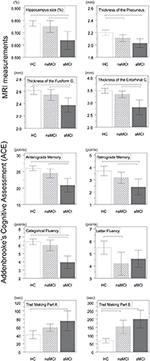
Figura 1. Tra le differenze di gruppo nelle strutture del SNC e nei test neuropsicologici. Le barre verticali rappresentano le medie di gruppo, mentre le barre di errore rappresentano le deviazioni standard. Le linee orizzontali sopra le barre verticali indicano significative tra le differenze di gruppo dopo la correzione per confronti multipli (p < 0.016). HC, controlli sani; aMCI, decadimento cognitivo lieve amnestico; naMCI, decadimento cognitivo lieve non amnestico; CNS, sistema nervoso centrale.
Lo spessore medio della corteccia entorinale, il giro fusiforme, l’istmo del giro cingolato e il precuneo sono anche significativamente diversi tra i gruppi di studio. Secondo i test post-hoc, spessore corticale diminuito sono stati trovati nel aMCI rispetto ai controlli in tutte e quattro le strutture, mentre lo spessore della corteccia entorinale e il giro fusiforme erano anche significativamente diminuito nel gruppo aMCI rispetto al gruppo naMCI. Le medie di gruppo, i risultati dei test post-hoc e le differenze tra i gruppi in termini di Cohen’s d sono riassunti nella tabella 3.
C’era una differenza significativa tra i gruppi di studio nella memoria anterograda, memoria retrograda, fluenza categoriale. Nella memoria anterograda e nella fluenza categorica sia il gruppo di controllo che il gruppo naMCI hanno superato il gruppo aMCI, mentre i primi gruppi non differivano significativamente (Tabella 3). Nella memoria retrograda i controlli hanno superato il gruppo aMCI, ma non il gruppo naMCI. Nella fluenza delle lettere i controlli hanno superato il gruppo naMCI, ma non il gruppo aMCI, mentre i due gruppi MCI non differivano tra loro (p > 0,05). Inoltre nella fluenza categorica i soggetti di sesso femminile hanno ottenuto risultati migliori dei maschi, mentre l’età non ha avuto alcun effetto significativo sulla performance.
Analisi correlazionali
Nell’intero campione sono state trovate forti correlazioni tra i risultati dei test neuropsicologici e il volume e lo spessore delle strutture cerebrali temporali (Tabella 4).

Tabella 4. Correlazioni tra le strutture del SNC e i risultati dei test neuropsicologici in tutto il campione.
Nel gruppo aMCI il risultato del Rey Verbal Learning Test ha mostrato una significativa correlazione positiva con la dimensione dell’amigdala (r = 0,47, n = 20, p = 0,03), e lo spessore della corteccia entorinale (r = 0,46, n = 20, p = 0,04; Figura 2). I soggetti con volumi di amigdala diminuiti e spessore entorinale diminuito hanno mostrato prestazioni più scarse nel test di memoria.

Figura 2. Correlazione tra le prestazioni di memoria a breve termine come indicizzato dal test di apprendimento verbale di Rey e il volume dell’amigdala e lo spessore della corteccia entorinale nei gruppi di studio. Le correlazioni di Pearson erano significative (p < 0,05) nel gruppo MCI amnestico e nell’intero campione, mentre non erano significative nel controllo e nei gruppi MCI non amnestici. La linea rossa, linea di regressione nel gruppo aMCI; linea tratteggiata, linea di regressione nell’intero campione; MCI, decadimento cognitivo lieve; r e p, coefficiente di correlazione di Pearson aggiustato per età e corrispondente livello di significatività nel gruppo aMCI.
Inoltre i soggetti con volumi entorinali diminuiti (r = 0,49, n = 19, p = 0,03), e diminuiti volumi giro fusiforme (r = 0,48, n = 19, p = 0,04) e spessore corticale fusiforme (r = 0.53, n = 19, p = 0,02) hanno ottenuto risultati più deboli nel subtest di memoria retrograda dell’ACE.
Discussione
MCI amnestico e non amnestico sono stati assegnati come potenziali prodromi a diversi tipi di NCD. Si presume che i soggetti con decadimento cognitivo lieve amnestico abbiano un rischio maggiore di convertirsi in demenza di Alzheimer, mentre i soggetti con decadimento cognitivo lieve non amnestico hanno un rischio maggiore di convertirsi in demenza non-Alzheimer (Petersen et al, 1999; Killiany et al., 2000; Petersen e Negash, 2008).
Le differenze strutturali del cervello sono state esaminate tramite MRI nei sottogruppi MCI e nel gruppo di controllo sano, mentre le differenze nelle prestazioni cognitive sono state studiate tramite test neuropsicologici. Secondo i risultati della risonanza magnetica, lo spessore della corteccia entorinale, il giro fusiforme, l’istmo del giro cingolare e il precuneo, e il volume dell’amigdala e dell’ippocampo sono diminuiti nell’aMCI rispetto ai controlli sani. Questi risultati sono in linea con gli studi precedenti che riportano che i soggetti sani, i pazienti con MCI o malattia di Alzheimer possono essere differenziati gli uni dagli altri in base ai volumi delle strutture del lobo temporale come l’amigdala o l’ippocampo (Desikan et al, 2009; McEvoy et al., 2009).
I volumi dell’ippocampo e della corteccia entorinale, e lo spessore della corteccia entorinale e del giro fusiforme sono significativamente diminuiti nel gruppo aMCI rispetto al gruppo naMCI. La più grande differenza tra i gruppi è stata rilevata nel volume e nello spessore della corteccia entorinale (0,9 e 1,2 SD, rispettivamente), che è in linea con il fatto che l’atrofia nel MA inizia in questa regione. Questi risultati mostrano che ci sono differenze strutturali precoci tra i sottotipi di MCI. Inoltre il modello di questi risultati strutturali sono adatti alla patologia della malattia di Alzheimer (Braak e Braak, 1991), che sottolineano quei risultati precedenti che l’aMCI progredisce alla malattia di Alzheimer con una frequenza maggiore rispetto al naMCI (Killiany et al., 2000; Petersen e Negash, 2008).
Confrontando il controllo e il gruppo naMCI una differenza significativa è stata trovata solo nello spessore del precuneo che era diminuito nel gruppo naMCI. È interessante notare che un recente studio ha trovato lesioni della materia bianca nei pazienti con naMCI anche nel precuneo (O’Dwyer et al., 2011), che è un importante nodo che sostiene il trasferimento di informazioni tra il giro paraippocampale e la corteccia prefrontale (Vincent et al., 2006) e gioca un ruolo importante nel processo di memoria e immaginario visivo.
Tra i test neuropsicologici, il MMSE non differisce tra i gruppi di studio, che è una probabile conseguenza dell’esclusione dei pazienti con demenza. Nei test ACE totale, ACE memoria anterograda, e ACE categoria fluenza il gruppo aMCI eseguito peggio rispetto al gruppo naMCI e il gruppo di controllo sano. Nel test di memoria retrograda dell’ACE e nei test Trail Making A e B il gruppo aMCI ha avuto prestazioni peggiori solo rispetto ai controlli sani, mentre nessuna differenza è stata rilevata tra i due sottogruppi MCI. La diminuzione delle prestazioni sui compiti di memoria (RAVLT e ACE compito di memoria retrograda) nel gruppo aMCI correlato con l’aumento del coinvolgimento delle strutture del lobo temporale come la corteccia entorinale, e l’amigdala (Figura 2), che conferma ulteriormente i nostri risultati sulle differenze tra i gruppi.
Nel compito di fluenza lettera il gruppo naMCI eseguito peggio del gruppo sano, mentre l’aMCI non differisce dagli altri gruppi. Il test Trail making B è un indice dell’attenzione visiva e della commutazione dei compiti. La diminuzione delle prestazioni di entrambi i gruppi MCI rispetto ai controlli (Tabella 3) è probabilmente il risultato del coinvolgimento frontale. Sia i compiti di categoria che quelli di fluidità delle lettere si basano fortemente sul funzionamento del lobo frontale, compresi i processi esecutivi che richiedono ai soggetti di organizzare il recupero, monitorare le risposte precedentemente richiamate, avviare risposte verbali e inibire le risposte che non rientrano nei criteri (Henry et al., 2004). “Entrambe le misure accedono anche ai magazzini di memoria semantica, una funzione del lobo temporale; anche se la fluidità delle lettere sembra attingere a questa capacità legata al lobo temporale in misura minore rispetto alla fluidità delle categorie” (Lezak et al., 2004). Gli studi di lesione e di imaging cerebrale funzionale supportano anche il coinvolgimento dei lobi temporali e frontali nella capacità di fluenza. Precedenti studi di fMRI hanno mostrato che la fluenza delle lettere è associata a una maggiore attivazione dei lobi frontali, mentre entrambi i lobi frontali e temporali sono attivi durante la fluenza delle categorie (Birn et al., 2010). Questo corrisponde bene con i nostri risultati che l’aMCI differisce significativamente secondo la fluenza di categoria in confronto al gruppo sano e naMCI, mentre non vi è alcuna differenza significativa tra i due sottogruppi nel risultato della fluenza di lettere.
Sono state trovate forti correlazioni tra le funzioni di memoria verbale e visiva come indicizzato dal RAVLT e i test PAL, e i volumi e lo spessore corticale delle strutture temporali come la corteccia entorinale (Tabella 4) nell’intero campione e anche nel gruppo aMCI (Figura 2). Questi risultati convalidano l’utilità di questi marcatori neuropsicologici e MRI nella diagnosi precoce del declino cognitivo patologico e nel monitoraggio della progressione della malattia.
Limitazioni
Un limite dello studio è che la maggior parte dei soggetti del gruppo aMCI erano di tipo multidominio, poiché le loro prestazioni nelle funzioni esecutive valutate dal trail making test B e dall’ACE erano sotto la norma. Questa limitazione presa insieme al fatto che il naMCI è un’entità più eterogenea rispetto all’aMCI può spiegare perché lo studio attuale non è stato in grado di trovare strutture del SNC con dimensioni ridotte nel gruppo naMCI rispetto al gruppo aMCI.
Conclusioni
La denominazione di aMCI e naMCI non è solo teorica ma questi sottotipi sono entità diverse sia da un punto di vista neuropsicologico che strutturale del cervello. Lo sviluppo di criteri specifici di MRI e neuropsicologici per i diversi sottotipi di decadimento cognitivo lieve permetterà poi di valutare i determinanti e la prevalenza dei sottotipi di MCI.
L’assegnazione dei sottotipi di MCI sarà utile per migliorare la previsione del tipo di demenza e il rischio di conversione in demenza. Inoltre l’assegnazione dei sottotipi di MCI può fornire un approccio migliore per testare l’efficacia delle opzioni terapeutiche nel prevenire la conversione a disturbi neurocognitivi. Sulla base dei nostri risultati la risonanza magnetica può essere uno strumento utile per la separazione più precisa tra i sottotipi di MCI.
Contributi degli autori
GC ha progettato lo studio, scritto il protocollo, intrapreso l’analisi statistica, creato le figure e scritto la prima bozza del manoscritto ES ha partecipato all’esecuzione delle misure, gestito le ricerche e le analisi della letteratura e scritto la prima bozza dell’introduzione e la conclusione. ÁS ha contribuito alla finalizzazione di tutte le sezioni del manoscritto. ZF, AH hanno partecipato all’esecuzione delle misurazioni e hanno contribuito alla scrittura della sezione dei metodi. ÉC, PS, ZH, GR hanno supervisionato gli esperimenti durante lo studio, compresa la scrittura del manoscritto. Tutti gli autori hanno contribuito e hanno approvato il manoscritto finale.
Finanziamento
Lo studio è stato sostenuto dal “Ambient Assisted Living Joint Programme (AAL)-Call 2” (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). La diagnosi di decadimento cognitivo lieve dovuto alla malattia di Alzheimer: raccomandazioni del National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. Validazione dell’esame cognitivo tedesco rivisto di Addenbrooke per il rilevamento del decadimento cognitivo lieve, della demenza lieve nella malattia di Alzheimer e della degenerazione lobare frontotemporale. Dement. Geriatr. Cogn. Disordine. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. Sistemi neurali che supportano la ricerca lessicale guidata da spunti lettera e categoria semantica: uno studio fMRI di risposta spontanea di fluenza verbale. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., and Angermeyer, M. C. (2002). Mild cognitive impairment – una revisione della prevalenza, incidenza e risultati secondo gli approcci attuali. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., and Braak, E. (1991). Stabilizzazione neuropatologica dei cambiamenti legati all’Alzheimer. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF00308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. Identificazione di individui anziani cognitivamente sani con successivo declino della memoria utilizzando volumi MR temporoparietali automatizzati. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., e Sereno, M. I. (1999). Analisi corticale basata sulla superficie. I. Segmentazione e ricostruzione della superficie. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Weiner, M. W., et al. (2009). Misure automatizzate di risonanza magnetica identificano individui con decadimento cognitivo lieve e malattia di Alzheimer. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., et al. MRI-derivato volume entorinale è un buon predittore di conversione da MCI a AD. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., and Dale, A. M. (2000). Misurare lo spessore della corteccia cerebrale umana da immagini di risonanza magnetica. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Segmentazione indipendente dalla sequenza di immagini di risonanza magnetica. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., and Dale, A. M. (1999a). Analisi basata sulla superficie corticale. II: Inflazione, appiattimento e un sistema di coordinate basato sulla superficie. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., and Dale, A. M. (1999b). Mediazione intersoggetto ad alta risoluzione e un sistema di coordinate per la superficie corticale. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C., e DeKosky, S. T. (2004). Decadimento cognitivo lieve, tipo amnestico: uno studio epidemiologico. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., e Goldberg, T. E. (2011). Utilità delle combinazioni di biomarcatori, marcatori cognitivi e fattori di rischio per prevedere la conversione da decadimento cognitivo lieve alla malattia di Alzheimer in pazienti nell’iniziativa di neuroimaging della malattia di Alzheimer. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). Il deterioramento cognitivo mite può essere distinto dalla malattia di alzheimer e dall’invecchiamento normale per gli studi clinici. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. Validità predittiva e stabilità diagnostica dei sottotipi di deterioramento cognitivo lieve. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K., and Minthon, L. (2006). Associazione tra biomarcatori CSF e incipiente malattia di Alzheimer in pazienti con decadimento cognitivo lieve: uno studio di follow-up. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., and Phillips, L. H. (2004). Prestazioni di fluenza verbale nella demenza di tipo Alzheimer: una meta-analisi. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. Previsione di AD con MRI-based volume ippocampale in lieve deterioramento cognitivo. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. Uso della risonanza magnetica strutturale per prevedere chi avrà la malattia di Alzheimer. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. Incidenza ed esito del deterioramento cognitivo lieve in una coorte prospettica basata sulla popolazione. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., and Fischer, J. S. (2004). Valutazione neuropsicologica, 4th Edn. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W., and Hodges, J. R. (2000). Una breve batteria di test cognitivi per differenziare la malattia di Alzheimer e la demenza frontotemporale. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. Biomarcatori CSF e incipiente malattia di Alzheimer in pazienti con decadimento cognitivo lieve. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr. Malattia di Alzheimer: neuroimaging strutturale quantitativo per il rilevamento e la previsione dei cambiamenti clinici e strutturali nel decadimento cognitivo lieve. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. Conversione MCI a demenza e il genotipo APOE: uno studio di previsione con FDG-PET. Neurology 63, 2332-2340. doi: 10.1212/01.WNL.0000147469.18313.3B
PubMed Abstract | CrossRef Full Text
O’Dwyer, L., Lamberton, F., Bokde, A. L., Ewers, M., Faluyi, Y. O., Tanner, C., et al. Indici multipli di diffusione identifica il danno della materia bianca nel decadimento cognitivo lieve e malattia di Alzheimer. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Compromissione cognitiva lieve come entità diagnostica. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., and Negash, S. (2008). Decadimento cognitivo lieve: una panoramica. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., and Kokmen, E. (1999). Deterioramento cognitivo lieve: caratterizzazione clinica e risultati. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L., and DeKosky, S. T. (2001). Parametro di pratica: individuazione precoce della demenza: decadimento cognitivo lieve (una revisione basata sull’evidenza). Rapporto del sottocomitato degli standard di qualità dell’accademia americana di neurologia. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). La relazione del test di trail making con il danno cerebrale organico. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Registrazione coerente inversa altamente accurata: un approccio robusto. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Parigi: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). Un approccio ibrido al problema dello stripping del cranio in MRI. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. Deterioramento cognitivo lieve: stessa identità per entità diverse. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Monitoraggio dei segni precoci di declino cognitivo negli anziani da giochi per computer: uno studio MRI. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovacs, V., Csibri, E., Hidasi, Z., Salacz, P., et al. (2013). Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R., e Lushene, R. (1970). Manuale per lo State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). “Mini Mental State Examination (MMSE),” in Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A e B: dati normativi stratificati per età e istruzione. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. Coerente attività spontanea identifica una rete di memoria ippocampale-parietale. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Scala di depressione geriatrica. Psicofarmacolo. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. Atrofia della materia grigia del proencefalo basale e dell’ippocampo nel decadimento cognitivo lieve. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar