- Introduction
- Menetelmät
- Eettinen lausunto
- Osallistujat
- MR-kuvien hankinta ja käsittely
- Menetelmät
- Statistinen analyysi
- Tulokset
- Aivokuoren tilavuuden, aivokuoren paksuuden ja kognitiivisen suoriutumisen erot amci-, namci- ja kontrolliryhmien välillä
- Korrelaatioanalyysit
- Keskustelu
- Limitations
- Johtopäätökset
- Tekijöiden kontribuutiot
- Rahoitus
- Conflict of Interest Statement
Introduction
Pääasialliset neurokognitiiviset häiriöt tai dementia, mukaan luettuna Alzheimerin tauti (Alzheimerin tauti, Alzheimerin Alzheimerin tauti (Alzheimerin tauti, Alzheimerin tauti, AD), ovat ikääntyvän yhteiskuntamme tuhoisa ongelma, jolla on valtava sosiaalinen ja taloudellinen taakka. Koska meillä ei tällä hetkellä ole tehokasta hoitoa NCD:hen, viimeaikaiset tutkimukset ovat keskittyneet varhaisten oireiden havaitsemiseen. Monista viimeaikaisista tutkimuksista saatujen todisteiden perusteella on käynyt ilmi, että Alzheimerin taudin patologinen prosessi alkaa vuosikymmeniä ennen ensimmäisiä kognitiivisen heikkenemisen oireita (Mattsson ym., 2009). Fysiologisen ikääntymisen odotettavissa olevan kognitiivisen heikkenemisen ja dementian vakavan heikkenemisen välinen välivaihe, jota kutsutaan ”lieväksi kognitiiviseksi heikentymiseksi” (MCI), on herättänyt paljon kiinnostusta. ”MCI:ssä kognitiivisten taitojen lievä heikkeneminen voidaan osoittaa neuropsykologisilla testeillä, kun taas globaalit kognitiiviset toiminnot ja päivittäiset toiminnot säilyvät” (Petersen, 2004). MCI:n korkeampi muuntumisprosentti NCD:ksi osoittaa tämän sairautta edeltävän tilan kliinisen merkityksen. MCI-taudista muuttuu vuosittain 10-15 prosenttia NCD:ksi, kun se on 1-4 prosenttia keskimääräisessä ikääntyneessä väestössä (Petersen ym., 2001; Bischkopf ym., 2002). Suurimmalle osalle näistä potilaista kehittyy kliininen Alzheimerin tauti. On huomattava, että MCI voi olla myös vakaa tai käänteinen tila, joka ei etene dementiaksi. Epidemiologisissa pitkittäistutkimuksissa raportoitiin muunnosasteesta ja suhteellisen yleisestä palautumisesta normaaliin kognitioon (Larrieu ym., 2002; Ganguli ym., 2004). Erilaiset havainnot viittaavat diagnostisen tarkkuuden epävakauteen ja tarpeeseen tarkempaan tunnistamiseen MCI-potilaiden välillä (Han ym., 2012). Edellä esitetyn perusteella on ymmärrettävää, että useat tutkimukset kohdistuvat oireisiin ja eroihin keskivertoväestöstä, jotka liittyvät läheisesti dementian kehittymiseen ja joita voidaan siten käyttää varhaisen diagnoosin apuna.
MCI-potilaat voidaan luokitella edelleen amnestiseen (aMCI) ja ei-amnestiseen MCI:hen (naMCI). AMCI:ssä muistin heikkeneminen on hallitsevaa, ja siihen liittyy suuri riski muuttua edelleen AD:ksi (Grundman, 2004). NaMCI:tä sairastavilla henkilöillä on heikentymiä muillakin osa-alueilla kuin muistissa, ja heillä on suurempi riski siirtyä muihin dementian muotoihin, kuten diffuusiin Lewyn kappaleen dementiaan. Molemmat tyypit voidaan luokitella edelleen yhden osa-alueen ja usean osa-alueen alatyyppeihin, mutta tässä tutkimuksessa ei tehty tarkempaa luokittelua otoksen rajallisen koon vuoksi. Merkittäviä MCI:n biomarkkereita on testattu, jotta voitaisiin tunnistaa AD:ksi muuttuvien potilaiden erityispiirteet. Aivo-selkäydinnesteen biomarkkereiden (Hansson ym., 2006) ja positroniemissiotomografiatutkimusten (Mosconi ym., 2004) tulokset osoittivat, että spesifisyys ja herkkyys ovat hyvin erilaisia, mutta rakenteellisen magneettikuvauksen tutkimukset osoittivat vaikuttavia tuloksia (Jack ym., 1999; deToledo-Morrell ym., 2004). Mielenkiintoista on, että useissa aiemmissa tutkimuksissa tutkittiin MCI:tä sairastavien henkilöiden ja terveiden kontrollihenkilöiden välisiä eroja, mutta vain muutamissa tutkimuksissa pyrittiin erottelemaan MCI:n alatyypit toisistaan (Zhang ym., 2011; Serra ym., 2013).
Vaikka aMCI ja naMCI ovat teoreettisesti erilaisia kokonaisuuksia, vain muutamissa tutkimuksissa tutkittiin aivojen rakenteellisia eroavaisuuksia näiden MCI:n alatyyppien välillä (Serra ym., 2013). Tutkimuksen tavoitteena oli selvittää aMCI:n ja naMCI:n välisiä rakenteellisia eroja ja toistaa aiemmat havainnot aMCI:n ja terveiden kontrollien välisestä erottelusta. Aiempien MCI:tä ja dementiaksi muuntumista koskevien tutkimusten perusteella keskityimme ohimolohkon ja lähialueiden rakenteisiin (Chiang et al., 2011): entorinaalinen aivokuori, hippokampus, parahippokampuksen aivokuori, amygdala, fusiforminen gyrus, precuneus, posteriorinen cingulaarinen aivokuori ja cingulaarisen gyrusin isthmus.
Menetelmät
Tämä tutkimus on jatkoa aiemmin julkaisemallemme työlle (Sirály ym., 2015). Koska tässä tutkimuksessa on käytetty samanlaista neuropsykologista testipatteristoa ja samaa MRI-hankinta- ja käsittelyputkea, menetelmät ja menettelyt on kuvattu samalla tavalla molemmissa julkaisuissa.
Eettinen lausunto
Kokeet suoritettiin täysin Helsingin julistuksen ja kaikkien asiaankuuluvien kansallisten ja kansainvälisten eettisten ohjeiden mukaisesti. Tutkimuksen hyväksyi kansallinen eettinen komitea, Budapest, Unkari. Kaikki toimenpiteet suoritettiin vasta sen jälkeen, kun osallistujilta oli saatu kirjallinen tietoinen suostumus. Kaikille mahdollisille osallistujille, jotka kieltäytyivät osallistumasta tai eivät muuten osallistuneet, ei aiheutunut minkäänlaista haittaa siitä, että he eivät osallistuneet tutkimukseen.
Osallistujat
Tutkimus toteutettiin psykiatrian ja psykoterapian laitoksella, Semmelweisin yliopistossa, Budapestissa. Tutkimukseen osallistui yhteensä 62 koehenkilöä. Kaikki koehenkilöt hakivat osallistumista kognitiiviseen harjoitusohjelmaan, josta ilmoitettiin yleislääkäreiden keskuudessa ja vanhainkodissa (Tutkimus on rekisteröity ClinicalTrials.gov-sivustolle, tunniste on ”NCT02310620”). Kaikki koehenkilöt pystyivät elämään itsenäistä elämää. Demografiset ja neuropsykologiset perustiedot on esitetty tiivistetysti taulukossa 1.

Taulukko 1. Demografiset tiedot ja neuropsykologisten perustestien tulokset.
Tutkimukseen otettiin mukaan aMCI:tä ja naMCI:tä sairastavat koehenkilöt sekä terveet kontrollit Petersenin kriteerien perusteella (Petersen, 2004). Petersenin kriteereihin kuuluvat subjektiivinen muistivaivaiva, jonka informantti vahvistaa yhdessä arkipäivän toimintojen säilymisen kanssa, muistin heikkeneminen tavanomaisen neuropsykologisen testin perusteella, globaalien kognitiivisten toimintojen säilyminen ja lopuksi dementian poissulkeminen. Siinä ei määritellä neuropsykologista testiä muistihäiriöiden arvioimiseksi, minkä vuoksi käytimme Reyn auditiivista verbaalista oppimistestiä (Rey Auditory Verbal Learning Test, RAVLT), joka on kirjallisuuden perusteella yleisimmin käytetty testi (Gomar ym., 2011). AMCI:n ja terveiden kontrolliryhmien erottamiseksi toisistaan käytimme raja-arvona 1 SD alle väestön keskiarvon, joka on vakioitu iän ja sukupuolen mukaan. Osallistujat, joiden pistemäärä alitti raja-arvon joko viivästyneen muistamisen osa-alueella tai kokonaispistemäärässä, luokiteltiin aMCI-ryhmään. Sovelletut kriteerit perustuvat Alzheimerin taudin diagnostisia suuntaviivoja käsittelevien National Institute on Aging-Alzheimer’s Association -työryhmien suosituksiin (Albert ym., 2011). RAVLT:n tarkat raja-arvot eri ikäryhmille esitetään taulukossa 2A. Koehenkilöt, jotka eivät kuuluneet aMCI-ryhmään, mutta jotka saivat 1 SD:n pistemäärän alle iän ja sukupuolen/koulutuksen suhteen vakioidun väestön keskiarvon joko Trail making Test B -testissä tai Addenbrooken kognitiivisessa tutkimuksessa (ACE), luokiteltiin naMCI-ryhmään. NaMCI-ryhmän lisäkriteerinä oli alle 3,2 VLOM-suhde (verbaalisen sujuvuuden + kielen pistemäärä/orientaation + muistin pistemäärä) ACE:ssä, jotta mahdolliset aMCI-henkilöt voitiin sulkea pois naMCI-ryhmästä (nämä henkilöt suljettiin tutkimuksen ulkopuolelle).

Taulukko 2. Verbaalisen sujuvuuden + kielen pisteet/orientaation + muistin pisteet. (A). Rey Auditory Verbal Learning Test (RAVLT): normatiiviset tiedot ja raja-arvot lievää kognitiivista heikentymistä (MCI) varten ikään sovitettuna; (B) Mini Mental Examination Test (MMSE): raja-arvot dementiaa varten ikään ja koulutukseen sovitettuna.
Dementiaa sairastavat koehenkilöt suljettiin pois tutkimuksesta ikään ja koulutukseen sovitettujen Mini Mental State Examination (MMSE) -pisteiden mukaan (Strauss ym., 2006b). MMSE:n tarkat raja-arvot eri ikä- ja koulutusryhmissä esitetään taulukossa 2B. Tutkimuksesta suljettiin pois myös koehenkilöt, joilla oli aiemmin ollut päävamma, epilepsia tai aivohalvaus tai joilla oli diagnosoitu akuutti psykiatrinen häiriö, skitsofrenia tai mania, alkoholiriippuvuus.
MR-kuvien hankinta ja käsittely
Kaikki koehenkilöt tutkittiin aivojen magneettikuvauksella (MRI), joka tuotti korkearesoluutioisia rakennekuvia, joita käytettiin myöhempään käsittelyyn ja analysointiin. Kuvantaminen tehtiin Semmelweisin yliopiston MR-tutkimuskeskuksessa Budapestissa 3 Teslan Philips Achieva -kliinisellä magneettikuvauslaitteella, joka oli varustettu kahdeksankanavaisella SENSE-pääkäämillä. Korkean resoluution koko aivojen anatomiset kuvat saatiin käyttämällä T1-painotettua kolmiulotteista pilattua gradienttikaikujaksoa (T1W 3D TFE). Kustakin koehenkilöstä otettiin 180 vierekkäistä viipaletta seuraavilla kuvausparametreilla: TR = 9,7 ms; TE = 4,6 ms; kääntökulma = 8°; FOV 240 × 240 mm; vokselikoko 1,0 × 1,0 × 1,0 mm.
Kortikaalinen rekonstruktio ja volumetrinen segmentointi suoritettiin Freesurfer 5.3 -kuva-analyysipaketin avulla, joka on dokumentoitu ja vapaasti ladattavissa verkossa (http://surfer.nmr.mgh.harvard.edu/). Näiden menettelyjen tekniset yksityiskohdat on kuvattu aiemmissa julkaisuissa, emme tehneet muutoksia tähän putkeen. Lyhyesti sanottuna kuvankäsittelyyn kuuluu liikekorjaus (Reuter et al., 2010), ei-aivokudoksen poisto hybridi-vesialtaan/pinnan muodonmuutosmenetelmällä (Segonne et al., 2004), automatisoitu Talairach-muunnos, subkortikaalisen valkean aineen segmentointi ja syvän harmaan aineen tilavuusrakenteet (mukaan luettuina hippokampus, amygdala, caudate, putamen, kammiot) (Fischl et al., 2004) intensiteettinormalisointi, harmaan ja valkoisen aineen rajan tesselointi, automaattinen topologiakorjaus ja pinnan muodonmuutos intensiteettigradienttien mukaan, jotta harmaan ja valkoisen aineen sekä harmaan ja selkäydinnesteen rajat voidaan sijoittaa optimaalisesti paikkaan, jossa suurin intensiteettimuutos määrittelee siirtymän toiseen kudosluokkaan (Dale et al., 1999; Fischl ja Dale, 2000). Kun kortikaaliset mallit oli saatu valmiiksi, Freesurfer-ohjelmalla suoritettiin useita muodonmuutosmenettelyjä tietojen jatkokäsittelyä ja analysointia varten. Vaiheisiin kuuluivat pinnan inflaatio (Fischl ym., 1999a), rekisteröinti sfääriseen atlakseen, jossa hyödynnettiin yksilöllisiä kortikaalisia taittomalleja kortikaalisen geometrian sovittamiseksi yhteen eri koehenkilöiden välillä (Fischl ym., 1999b), aivokuoren parkeeraus yksiköihin gyraali- ja sulfaalirakenteen perusteella (Fischl ym., 2004) ja erilaisten pintoihin perustuvien tietojen, mukaan lukien kaarevuuskarttojen ja sulfaalien syvyyskarttojen, luominen. Lopuksi aivokuoren mallit ja segmentoinnin tulokset tarkistettiin laadullisesti ja korjattiin manuaalisesti jokaisella koehenkilöllä, mutta korjaukset eivät kuitenkaan osoittaneet merkittäviä muutoksia tuloksiin.
Menetelmät
Neuropsykologiset tutkimukset suoritettiin arkipäivisin klo 8-16. Tutkimukset koostuivat tietokonepohjaisista (eli PAL-testistä) ja paperipohjaisista neuropsykologisista testeistä. Testit suoritettiin erillisessä hyvin valaistussa huoneessa, jossa olivat läsnä vain potilas ja tutkija. Myös vertailutestit täytettiin ja arvioitiin Neuropsykologisen kompendiumin (Strauss ym., 2006a) suositusten mukaisesti, kun taas tietokonepohjaiset testit arvioitiin ohjelmiston avulla.
Neuropsykologiset testit suoritti kaksi aiemmin koulutettua lääketieteen opiskelijaa psykologin ja psykiatrin valvonnassa. Testien arvioinnissa noudatettiin Neuropsychological Compendiumin (Strauss ym., 2006a) ohjeita. Sama psykologi ja psykiatri arvioivat paperipohjaiset testit kompendiumin mukaisesti. Paired Associates Learning Test (PAL-testi) arvioitiin automaattisesti ohjelmistolla. Myös magneettikuvaustiedot analysoitiin ja arvioitiin automaattisesti Freesurfer- ja SAS-ohjelmistolla, joten neurokuvantamistietojen analysointiin ei liittynyt subjektiivisia arvioita. Koska PAL-testin ja neurokuvantamistietojen arviointi ja arviointi oli täysin automaattista, ihmisen tekemien arvioiden aiheuttama harha oli vähäinen (rajoittuen vain paperipohjaisten testien arviointiin).
Tutkimuksesta suljettiin pois dementiaa sairastavat koehenkilöt MMSE-testin (Mini Mental State Examination) perusteella. MMSE on vakiotesti; sen tehokkuus on useissa tutkimuksissa osoitettu hyödylliseksi menetelmäksi dementiaa sairastavien koehenkilöiden ja terveiden kontrollihenkilöiden erottamisessa toisistaan (Petersen ym., 1999; Gomar ym., 2011). Useimmissa aiemmissa tutkimuksissa käytettiin 26 pisteen raja-arvoa tai ikäkorjattua dementiapistemäärää. Testin osatehtävissä arvioidaan orientaatiota, keskeisiä toimeenpanevia toimintoja, nopeaa assosiaatioiden muodostamista, verbaalista tunnistamiskykyä sekä kykyä analysoida ja syntetisoida.
Addenbrooken kognitiivista tutkimusta käytettiin arvioimaan globaalia kognitiivista suorituskykyä, mukaan lukien orientaatiota, tarkkaavaisuutta, muistia, verbaalista sujuvuutta, verbaalisia ja visuospatiaalisia taitoja (Mathuranath ym, 2000; Alexopoulos ym., 2010).
Rey Auditory Verbal Learning Test -testiä käytettiin muistitoimintojen yksityiskohtaiseen arviointiin Petersenin kriteerien perusteella. Reyn testillä arvioidaan sanallista oppimista ja muistia (Rey, 1958). Koehenkilön tuli toistaa 15 sanan luettelo (luettelo A) välittömästi. Tämä testi toistetaan 5 kertaa. Sitten esitetään kerran toinen 15 sanan luettelo (luettelo B tai interferenssiluettelo), joka on muistettava. Sen jälkeen lista A pitäisi palauttaa mieleen ilman toistoa, ja sitten tämä tehtävä toistetaan 30 minuutin kuluttua.
The Trail Making -testiä, osa A ja osa B (numeroyhteys; REITAN, 1955; Tombaugh, 2004; Alexopoulos et al., 2010) käytetään arvioimaan valikoivaa tarkkaavaisuutta, toimeenpanevia toimintoja ja kognitiivista joustavuutta. A-osassa satunnaisesti jaetut numerot on yhdistettävä numerojärjestyksessä, kun taas B-osassa näytetään satunnaisesti jaettuja numeroita ja kirjaimia. Koehenkilöä ohjeistetaan yhdistämään numerot ja kirjaimet ennalta määritellyssä järjestyksessä. Riippuvainen muuttuja on testin suorittamiseen kuluva aika. TMT:n osa A mittaa toimeenpanotoimintoja ja tarkkaavaisuutta, kun taas osan B suorituksessa näkyy myös kognitiivinen joustavuus.
Neuropsykologisten testien tulokset on koottu taulukkoon 1.
Kaikki osallistujat täyttivät lomakkeen, jossa he arvioivat omaa terveydentilaansa ja muistitoimintojaan; lisäksi heidän oli raportoitava tietokoneen ja internetin käytöstä, vapaa-ajan aktiviteeteistaan, alkoholin kulutuksesta, ruokailutottumuksistaan ja tupakoinnista.
Kaikki osallistujat täyttivät lomakkeen, jossa he arvioivat omaa terveydentilaansa ja muistitoimintojaan.
Lomake oli laadittu taulukon 1 mukaisesti. Masennusoireiden arviointiin käytettiin Geriatrista masennusasteikkoa (Geriatric Depression Scale, GDS), kun taas ahdistusoireita mitattiin Spielberger State-Trait Anxiety Inventory -mittarilla (Spielberger State-Trait Anxiety Inventory, STAI; Spielberger ym., 1970).
Visospatiaalista muistia mitattiin useissa neuropsykologisissa testipattereissa käytetyn PAL-testin toteutuksella (Siraly ym., 2013). ”PAL-testissä ikkunat avautuvat satunnaisissa paikoissa ruudulla peräkkäin 3 s ajaksi, ja yhdessä tai useammassa ikkunassa näytetään abstrakteja muotoja. Muut ikkunat jäävät tyhjiksi vaikeustasosta riippuen. Kun kaikki neliöt oli näytetty, aiemmin näytetyt muodot ilmestyivät ruudun keskelle, ja osallistujien oli päätettävä, missä ikkunassa he näkivät kyseisen muodon aiemmin. Testi koostuu viidestä eri tasosta, joissa on yhteensä kahdeksan vaihetta, ja muotojen määrä kasvaa 1:stä 8:aan eri vaiheissa. Koehenkilöillä oli 10 kokeilua aikaa suorittaa tietty vaihe loppuun, muuten testi päättyi. Ikkunoiden sijoittelu oli testissä epäsymmetrinen ja se muuttui vaiheesta toiseen.” (Siraly ym., 2013) Tietokonetestin aikana koehenkilöt istuivat mukavasti puolen metrin etäisyydellä tietokoneen ruudusta ja ennakkotietojen jälkeen he ratkaisivat tehtävät hiiren avulla.
Statistinen analyysi
Tutkimusryhmien väliset erot aivojen tilavuudessa, kortikaalipaksuudessa ja kognitiivisessa suoriutumisessa analysoitiin yleisen lineaarisen mallin analyysillä (General Linear Model Analysis, GLM-analyysi SAS-ohjelmassa SAS 9.2:n versiossa), jossa kovariaattoreina käytettiin ikää ja sukupuolta. Tilavuudet standardoitiin kallonsisäisen kokonaistilavuuden (TIV) suhteen, ja ne ilmoitetaan prosentteina. Ryhmien välisten erojen analysoimiseksi käytettiin post hoc t-vertailuja, joissa p-arvot mukautettiin arvoon 0,05/3 = 0,016, jossa kolme tarkoittaa ryhmien välisten vertailujen lukumäärää.
Neuropsykologisten testien tulosten ja keskushermostorakenteiden koon välistä suhdetta analysoitiin Pearsonin korrelaatioilla. Korrelaatiot PAL-testissä suoritettujen vaiheiden lukumäärän kanssa analysoitiin Spearmanin korrelaatiolla, koska tämän muuttujan jakauma poikkesi suurelta osin normaalijakaumasta.
Tulokset
Aivokuoren tilavuuden, aivokuoren paksuuden ja kognitiivisen suoriutumisen erot amci-, namci- ja kontrolliryhmien välillä
Tutkimusryhmien välillä havaittiin merkitseviä eroja hippokampuksen tilavuudessa ja entorinaalisen aivokuoren tilavuudessa . Post hoc -testit osoittivat, että tilavuudet pienenivät merkitsevästi aMCI-ryhmässä suhteessa kontrolleihin ja naMCI-ryhmään, kun taas kaksi muuta ryhmää eivät eronneet merkitsevästi toisistaan (taulukko 3 ja kuvio 1) Kovariaateista sukupuolella oli merkitsevä vaikutus hippokampuksen tilavuuteen, miespuolisilla koehenkilöillä oli merkitsevästi pienentynyt hippokampuksen koko suhteessa naispuolisiin koehenkilöihin .
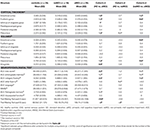
TAULUKKO 3. Keskushermoston rakenteiden ja neuropsykologisten testitulosten erot tutkimusryhmien välillä.
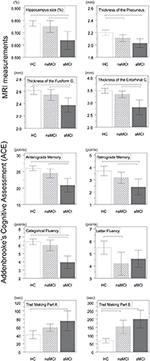
Kuva 1. Ryhmien väliset erot keskushermoston rakenteissa ja neuropsykologisissa testeissä. Pystypalkit kuvaavat ryhmien keskiarvoja ja virhepalkit keskihajontoja. Pystypalkkien yläpuolella olevat vaakaviivat osoittavat merkitseviä ryhmien välisiä eroja moninkertaisten vertailujen korjauksen jälkeen (p < 0,016). HC, terveet kontrollit; aMCI, amnestinen lievä kognitiivinen heikkeneminen; naMCI, ei-amnestinen lievä kognitiivinen heikkeneminen; CNS, keskushermosto.
Myös entorinaalisen aivokuoren , fusiformisen gyrusin , cingulaarisen gyrusin isthmusin ja precuneuksen keskimääräiset paksuudet erosivat merkitsevästi toisistaan tutkimusryhmien välillä. Post-hoc-testien mukaan aMCI-ryhmässä havaittiin vähentynyt aivokuoren paksuus suhteessa kontrolleihin kaikissa neljässä rakenteessa, kun taas entorinaalisen aivokuoren ja fusiformisen gyrusin paksuus väheni merkitsevästi myös aMCI-ryhmässä suhteessa naMCI-ryhmään. Ryhmien keskiarvot, post-hoc-testien tulokset ja ryhmien väliset erot Cohenin d:n suhteen on koottu taulukkoon 3.
Tutkimusryhmien välillä oli merkitsevä ero anterogradessa muistissa , retrogradessa muistissa , kategorisessa sujuvuudessa . Anterogradessa muistissa ja kategorisessa sujuvuudessa sekä kontrolliryhmä että naMCI-ryhmä ylittivät aMCI-ryhmän, kun taas edelliset ryhmät eivät eronneet toisistaan merkitsevästi (taulukko 3). Retrogradisessa muistissa kontrolliryhmä oli parempi kuin aMCI-ryhmä, mutta ei naMCI-ryhmä. Kirjainten sujuvuudessa kontrollit ylittivät naMCI-ryhmän, mutta eivät aMCI-ryhmää, kun taas nämä kaksi MCI-ryhmää eivät eronneet toisistaan (p > 0,05). Lisäksi kategorisessa sujuvuudessa naispuoliset koehenkilöt suoriutuivat paremmin kuin miehet , kun taas iällä ei ollut merkittävää vaikutusta suoriutumiseen.
Korrelaatioanalyysit
Koko otoksessa havaittiin vahvaa korrelaatiota neuropsykologisten testien tulosten ja ohimolohkon aivorakenteiden tilavuuden ja paksuuden välillä (taulukko 4).
 TAULUKKO 4
TAULUKKO 4
Taulukko 4. Neuropsykologisten testien tulokset. Keskushermoston rakenteiden ja neuropsykologisten testitulosten väliset korrelaatiot koko otoksessa.
MCI-ryhmässä Reyn verbaalisen oppimistestin tuloksella oli merkitsevä positiivinen korrelaatio amygdalan koon (r = 0,47, n = 20, p = 0,03) ja entorinaalisen aivokuoren paksuuden (r = 0,46, n = 20, p = 0,04; kuva 2) kanssa. Koehenkilöillä, joiden amygdala-tilavuudet olivat pienentyneet ja entorinaalisen aivokuoren paksuus pienentynyt, oli heikompi suorituskyky muistitestissä.

Kuvio 2. Reyn verbaalisella oppimistestillä indeksoidun lyhytkestoisen muistisuorituksen sekä amygdalan tilavuuden ja entorinaalisen aivokuoren paksuuden välinen korrelaatio tutkimusryhmissä. Pearsonin korrelaatiot olivat merkitseviä (p < 0,05) amnestisen MCI:n ryhmässä ja koko otoksessa, kun taas kontrolliryhmässä ja ei-amnestisen MCI:n ryhmissä ne eivät olleet merkitseviä. Rey-verbaalitestin kokonaispistemäärä pystyakselilla vastaa viiden ensimmäisen kokeen sanojen summaa. punainen viiva, regressiosuora aMCI-ryhmässä; katkoviiva, regressiosuora koko otoksessa; MCI, lievä kognitiivinen heikentyminen; r ja p, Pearsonin korrelaatiokerroin, joka on korjattu iällä ja vastaavalla merkitsevyystasolla aMCI-ryhmässä.
Lisäksi koehenkilöt, joilla oli pienentynyt entorhinaalinen tilavuus (r = 0.49, n = 19, p = 0.03) ja pienentynyt fusiformisen gyrusin tilavuus (r = 0.48, n = 19, p = 0.04) ja fusiformisen aivokuoren paksuus (r = 0.53, n = 19, p = 0.02) suoriutuivat heikommin ACE:n retrogradisen muistin osatestissä.
Keskustelu
Amnestinen ja ei-amnestinen MCI määriteltiin potentiaalisiksi prodromeiksi erityyppisille NCD: lle. Tutkittavilla, joilla on amnestinen lievä kognitiivinen heikentyminen, oletetaan olevan suurempi riski siirtyä Alzheimerin dementiaan, kun taas tutkittavilla, joilla on ei-amnestinen lievä kognitiivinen heikentyminen, sanotaan olevan suurempi riski siirtyä muuhun kuin Alzheimerin dementiaan (Petersen et al., 1999; Killiany ym., 2000; Petersen ja Negash, 2008).
Aivojen rakenteellisia eroja tutkittiin magneettikuvauksella MCI-alaryhmissä ja terveessä kontrolliryhmässä, kun taas kognitiivisen suorituskyvyn eroja tutkittiin neuropsykologisilla testeillä. Magneettikuvaustulosten mukaan entorinaalisen aivokuoren, fusiformisen gyrusin, cingulaarisen gyrusin isthmusin ja precuneuksen paksuus sekä amygdalan ja hippokampuksen tilavuus olivat pienentyneet aMCI:ssä verrattuna terveisiin kontrolleihin. Nämä havainnot ovat linjassa aiempien tutkimusten kanssa, joissa raportoidaan, että terveet koehenkilöt, MCI- tai Alzheimerin tautia sairastavat potilaat voidaan erottaa toisistaan ohimolohkorakenteiden, kuten amygdalan tai hippokampuksen, tilavuuden perusteella (Desikan et al., 2009; McEvoy ym., 2009).
Hippokampuksen ja entorinaalisen aivokuoren tilavuudet sekä entorinaalisen aivokuoren ja fusiformisen gyrusin paksuus ovat merkitsevästi pienentyneet aMCI-ryhmässä suhteessa naMCI-ryhmään. Suurin ryhmien välinen ero havaittiin entorinaalisen aivokuoren tilavuudessa ja paksuudessa (0,9 ja 1,2 SD), mikä on sopusoinnussa sen kanssa, että Alzheimerin taudin atrofia alkaa tältä alueelta. Nämä tulokset osoittavat, että MCI:n alatyyppien välillä on varhaisia rakenteellisia eroja. Lisäksi näiden rakenteellisten löydösten malli sopii Alzheimerin taudin patologiaan (Braak ja Braak, 1991), mikä korostaa niitä aiempia tuloksia, joiden mukaan aMCI etenee Alzheimerin taudiksi useammin kuin naMCI (Killiany ym., 2000; Petersen ja Negash, 2008).
Vertailtaessa kontrolliryhmää ja naMCI-ryhmää havaittiin merkitsevä ero ainoastaan precuneuksen paksuudessa, joka pieneni naMCI-ryhmässä. Mielenkiintoista on, että hiljattain tehdyssä tutkimuksessa havaittiin naMCI-potilailla valkean aineen vaurioita myös precuneuksessa (O’Dwyer ym., 2011), joka on tärkeä solmukohta, joka ylläpitää tiedonsiirtoa parahippokampuksen gyrusin ja prefrontaalisen aivokuoren välillä (Vincent ym., 2006) ja jolla on tärkeä rooli muistiprosessissa ja visuaalisessa mielikuvituskyvyssä.
NEuropsykologisista testeistä MMSE-testit eivät eronneet toisistaan eri tutkittavien ryhmien välillä, mikä johtunee siitä, että tutkimuksesta oli suljettu pois potilaat, joilla todettiin dementia. ACE total-, ACE anterograde memory- ja ACE category fluency -alatesteissä aMCI-ryhmä suoriutui huonommin suhteessa naMCI-ryhmään ja terveeseen kontrolliryhmään. ACE:n retrogradisen muistin testissä ja Trail Making A ja B -testeissä aMCI-ryhmä suoriutui vain huonommin kuin terveet kontrolliryhmät, kun taas kahden MCI-alaryhmän välillä ei havaittu eroa. Heikentynyt suorituskyky muistitehtävissä (RAVLT ja ACE:n retrogradinen muistitehtävä) aMCI-ryhmässä korreloi ohimolohkorakenteiden, kuten entorinaalisen aivokuoren ja amygdalan, lisääntyneen osallistumisen kanssa (kuvio 2), mikä vahvistaa entisestään tuloksiamme ryhmien välisistä eroista.
Kirjainten sujuvuus-tehtävässä naMCI-ryhmä suoriutui huonommin kuin terveiden ryhmä, kun taas aMCI-ryhmä ei eronnut muista ryhmistä. Trail making B -testi on visuaalisen tarkkaavaisuuden ja tehtävän vaihtamisen indeksi. Molempien MCI-ryhmien heikentynyt suorituskyky suhteessa kontrolliryhmiin (taulukko 3) on todennäköisesti seurausta otsalohkon osallistumisesta. Sekä kategoria- että kirjainten sujuvuustehtävät perustuvat vahvasti otsalohkon toimintaan, mukaan lukien toimeenpanoprosessit, jotka edellyttävät koehenkilöiltä tiedonhaun organisoimista, aiemmin muistettujen vastausten seuraamista, verbaalisten vastausten käynnistämistä ja sellaisten vastausten estämistä, jotka eivät sovi kriteereihin (Henry et al., 2004). ”Molemmilla mittareilla päästään käsiksi myös semanttisiin muistivarastoihin, jotka ovat ohimolohkon toiminto; tosin kirjainten sujuvuus näyttää hyödyntävän tätä ohimolohkoon liittyvää kykyä pienemmässä määrin kuin luokkien sujuvuus” (Lezak ym., 2004). Myös aivojen vaurio- ja toiminnalliset aivokuvantamistutkimukset tukevat ohimo- ja otsalohkojen osallisuutta sujuvuuskykyyn. Aiemmat fMRI-tutkimukset osoittivat, että kirjeen sujuvuuteen liittyy lisääntynyttä aktivaatiota otsalohkoissa, kun taas sekä otsa- että ohimolohkot ovat aktiivisia luokan sujuvuuden aikana (Birn ym., 2010). Tämä vastaa hyvin havaintojamme, joiden mukaan aMCI eroaa merkittävästi kategorian sujuvuuden mukaan verrattuna terveeseen ja naMCI-ryhmään, kun taas kirjainten sujuvuuden tuloksessa ei ole merkittävää eroa näiden kahden alaryhmän välillä.
Verbaalisten ja visuaalisten muistitoimintojen, joita indikoivat RAVLT- ja PAL-testit, sekä ohimorakenteiden, kuten entorinaalisen aivokuoren, tilavuuksien ja kortikaalisen paksuuden välillä havaittiin vahvoja korrelaatioita (taulukko 4) koko näytteessä ja myös aMCI-ryhmässä (kuva 2). Nämä havainnot ristiinvalidoivat näiden neuropsykologisten ja magneettikuvausmarkkereiden käyttökelpoisuuden patologisen kognitiivisen heikkenemisen varhaisdiagnostiikassa ja taudin etenemisen seurannassa.
Limitations
Tutkimuksen rajoituksena on se, että suurin osa aMCI-ryhmään kuuluvista koehenkilöistä oli monitekijätyyppejä, sillä heidän suorituksensa toimeenpanevissa toiminnoissa, joita arvioitiin polkujen tekemisen testi B:llä ja ALVLT:llä, olivat alle normaalirajan. Tämä rajoitus yhdessä sen kanssa, että naMCI on heterogeenisempi kokonaisuus suhteessa aMCI:hen, saattaa selittää, miksi tässä tutkimuksessa ei pystytty löytämään CNS-rakenteita, joiden koko oli pienentynyt naMCI-ryhmässä suhteessa aMCI-ryhmään.
Johtopäätökset
AMCI:n ja naMCI:n nimeäminen ei ole vain teoreettista, vaan nämä alatyypit ovat erilaisia kokonaisuuksia sekä neuropsykologiselta että aivojen rakenteelliselta näkökannalta. Erityisten MRI- ja neuropsykologisten kriteerien kehittäminen lievän kognitiivisen heikentymisen eri alatyypeille mahdollistaa sen jälkeen MCI-alatyyppien määräävien tekijöiden ja esiintyvyyden arvioinnin.
MCI-alatyyppien määrittäminen on hyödyllistä dementiatyypin ja dementiaan muuttumisen riskin ennustamisen parantamiseksi. Lisäksi MCI-alatyyppien määrittäminen voi tarjota paremman lähestymistavan testata hoitovaihtoehtojen tehokkuutta neurokognitiivisiin häiriöihin siirtymisen estämisessä. Tulostemme perusteella magneettikuvaus voi olla hyödyllinen väline MCI-alatyyppien tarkempaan erotteluun.
Tekijöiden kontribuutiot
GC suunnitteli tutkimuksen, kirjoitti protokollan, teki tilastollisen analyysin, laati luvut ja kirjoitti käsikirjoituksen ensimmäisen luonnoksen ES osallistui mittausten suorittamiseen, hoiti kirjallisuushaut ja -analyysit sekä kirjoitti johdannon ja johtopäätösten ensimmäisen luonnoksen. ÁS osallistui käsikirjoituksen kaikkien osien viimeistelyyn. ZF, AH osallistuivat mittausten suorittamiseen ja osallistuivat menetelmäosion kirjoittamiseen. ÉC, PS, ZH, GR valvoivat kokeita tutkimuksen aikana, mukaan lukien käsikirjoituksen kirjoittaminen. Kaikki kirjoittajat osallistuivat lopullisen käsikirjoituksen laatimiseen ja ovat hyväksyneet sen.
Rahoitus
Tutkimusta on tuettu ”Ambient Assisted Living Joint Programme (AAL)-Call 2” -apurahalla (Project Identifier: AAL_08-1-2011-0005 M3W), (http://www.aal-europe.eu).
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Albert, M. S., DeKosky, S. T., Dickson, D., Dubois, B., Feldman, H. H., Fox, N. C., et al. (2011). Alzheimerin taudin aiheuttaman lievän kognitiivisen heikentymisen diagnosointi: Alzheimerin taudin diagnostisia suuntaviivoja käsittelevien National Institute on Aging-Alzheimer’s Association -työryhmien suositukset. Alzheimers Dement. 7, 270-279. doi: 10.1016/j.jalz.2011.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Alexopoulos, P., Ebert, A., Richter-Schmidinger, T., Scholl, E., Natale, B., Aguilar, C. A., Gourzis, P., et al. (2010). Saksalaisen tarkistetun Addenbrooken kognitiivisen testin validointi lievän kognitiivisen heikentymisen, alzheimerin taudin lievän dementian ja otsa-ohimolohkodegeneraation havaitsemiseksi. Dement. Geriatr. Cogn. Disord. 29, 448-456. doi: 10.1159/000312685
PubMed Abstract | CrossRef Full Text | Google Scholar
Birn, R. M., Kenworthy, L., Case, L., Caravella, R., Jones, T. B., Bandettini, P. A., et al. (2010). Neuraaliset järjestelmät, jotka tukevat kirjain- ja semanttisten luokkavihjeiden ohjaamaa leksikaalista hakua: verbaalisen sujuvuuden fMRI-tutkimus, jossa verbaalista sujuvuutta tutkitaan itseohjautuvasti ja avoimesti. Neuroimage. 49, 1099-1107. doi: 10.1016/j.neuroimage.2009.07.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Bischkopf, J., Busse, A., ja Angermeyer, M. C. (2002). Lievä kognitiivinen heikentyminen – katsaus prevalenssiin, esiintyvyyteen ja tuloksiin nykyisten lähestymistapojen mukaan. Acta Psychiatr. Scand. 106, 403-414. doi: 10.1034/j.1600-0447.2002.01417.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Braak, H., ja Braak, E. (1991). Alzheimeriin liittyvien muutosten neuropatologinen vaiheistus. Acta Neuropathol. 82, 239-259. doi: 10.1007/BF0030308809
PubMed Abstract | CrossRef Full Text | Google Scholar
Chiang, G. C., Insel, P. S., Tosun, D., Schuff, N., Truran-Sacrey, D., Raptentsetsang, S., et al. (2011). Kognitiivisesti terveiden iäkkäiden henkilöiden tunnistaminen, joilla on myöhempi muistin heikkeneminen, käyttämällä automatisoituja MR temporoparietaalisia tilavuuksia. Radiology 259, 844-851. doi: 10.1148/radiol.11101637
PubMed Abstract | CrossRef Full Text | Google Scholar
Dale, A. M., Fischl, B., and Sereno, M. I. (1999). Aivokuoren pintaan perustuva analyysi. I. Segmentointi ja pinnan rekonstruktio. Neuroimage 9, 179-194.
PubMed Abstract | Google Scholar
Desikan, R. S., Cabral, H. J., Hess, C. P., Hess, C. P., Dillon, W. P., Glastonbury, C. M., Glastonbury, C. M., Weiner, M. W. ym. et al. (2009). Automaattiset MRI-mittaukset tunnistavat henkilöt, joilla on lievä kognitiivinen heikentyminen ja Alzheimerin tauti. Brain 132, 2048-2057. doi: 10.1093/brain/awp123
PubMed Abstract | CrossRef Full Text | Google Scholar
deToledo-Morrell, L., Stoub, T. R., Bulgakova, M., Wilson, R. S., Bennett, D. A., Leurgans, S., ym. et al. (2004). Magneettikuvauksesta saatu entorinaalinen tilavuus on hyvä ennustaja MCI:stä AD:ksi muuttumisen suhteen. Neurobiol. Aging 25, 1197-1203. doi: 10.1016/j.neurobiolaging.2003.12.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., ja Dale, A. M. (2000). Ihmisen aivokuoren paksuuden mittaaminen magneettikuvista. Proc. Natl. Acad. Sci. U.S.A. 97, 11050-11055. doi: 10.1073/pnas.200033797
CrossRef Full Text | Google Scholar
Fischl, B., Salat, D. H., van der Kouwe, A. J., Makris, N., Segonne, F., Quinn, B. T., et al. (2004). Sequence-independent segmentation of magnetic resonance images. Neuroimage 23(Suppl. 1), S69-S84. doi: 10.1016/j.neuroimage.2004.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Fischl, B., Sereno, M. I., ja Dale, A. M. (1999a). Aivokuoren pintaan perustuva analyysi. II: Inflaatio, litistäminen ja pintapohjainen koordinaattijärjestelmä. Neuroimage 9, 195-207.
PubMed Abstract | Google Scholar
Fischl, B., Sereno, M. I., Tootell, R. B., ja Dale, A. M. (1999b). Korkean resoluution koehenkilöiden välinen keskiarvoistus ja kortikaalisen pinnan koordinaattijärjestelmä. Hum. Brain Mapp. 8, 272-284. doi: 10.1002/(SICI)1097-0193(1999)8:4<272::AID-HBM10>3.0.CO;2-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Ganguli, M., Dodge, H. H., Shen, C. ja DeKosky, S. T. (2004). Lievä kognitiivinen heikentyminen, amnestinen tyyppi: epidemiologinen tutkimus. Neurology 63, 115-121. doi: 10.1212/01.WNL.0000132523.27540.81
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomar, J. J., Bobes-Bascaran, M. T., Conejero-Goldberg, C., Davies, P., ja Goldberg, T. E. (2011). Biomarkkereiden, kognitiivisten merkkiaineiden ja riskitekijöiden yhdistelmien hyödyllisyys Alzheimerin taudin neurokuvantamisaloitteeseen osallistuvien potilaiden lievästä kognitiivisesta heikentymisestä Alzheimerin tautiin siirtymisen ennustamisessa. Arch. Gen. Psychiatry 68, 961-969. doi: 10.1001/archgenpsychiatry.2011.96
PubMed Abstract | CrossRef Full Text
Grundman, M. (2004). MIld kognitiivinen heikentyminen voidaan erottaa Alzheimerin taudista ja normaalista ikääntymisestä kliinisiä tutkimuksia varten. Arch. Neurol. 61, 59-66. doi: 10.1001/archneur.61.1.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Han, J. W., Kim, T. H., Lee, S. B., Park, J. H., Lee, J. J., Huh, Y., et al. (2012). Lievän kognitiivisen häiriön alatyyppien ennustava pätevyys ja diagnostinen vakaus. Alzheimers Dement. 8, 553-559. doi: 10.1016/j.jalz.2011.08.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hansson, O., Zetterberg, H., Buchhave, P., Londos, E., Blennow, K. ja Minthon, L. (2006). CSF-biomarkkereiden ja alkavan Alzheimerin taudin välinen yhteys potilailla, joilla on lievä kognitiivinen heikentyminen: seurantatutkimus. Lancet Neurol. 5, 228-234. doi: 10.1016/S1474-4422(06)70355-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Henry, J. D., Crawford, J. R., ja Phillips, L. H. (2004). Verbaalisen sujuvuuden suorituskyky Alzheimer-tyyppisessä dementiassa: meta-analyysi. Neuropsychologia 42, 1212-1222. doi: 10.1016/j.neuropsychologia.2004.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Jack, C. R. Jr, Petersen, R. C., Xu, Y. C., O’Brien, P. C., Smith, G. E., Ivnik, R. J., et al. (1999). AD:n ennustaminen magneettikuvaukseen perustuvalla hippokampuksen tilavuudella lievässä kognitiivisessa heikentymisessä. Neurology 52, 1397-1403.
PubMed Abstract | Google Scholar
Killiany, R. J., Gomez-Isla, T., Moss, M., Kikinis, R., Sandor, T., Jolesz, F., et al. (2000). Rakenteellisen magneettikuvauksen käyttö Alzheimerin tautiin sairastuvien ennustamisessa. Ann. Neurol. 47, 430-439.
PubMed Abstract | Google Scholar
Larrieu, S., Letenneur, L., Orgogozo, J. M., Fabrigoule, C., Amieva, H., Le, C. N., et al. (2002). Lievän kognitiivisen heikentymisen esiintyvyys ja tulokset väestöpohjaisessa prospektiivisessa kohortissa. Neurology 59, 1594-1599. doi: 10.1212/01.WNL.0000034176.07159.F8
PubMed Abstract | CrossRef Full Text | Google Scholar
Lezak, M. D., Howieson, D. B., Loring, D. W., Hannay, H. J., ja Fischer, J. S. (2004). Neuropsykologinen arviointi, 4. painos. New York, NY: Oxford University Press.
Mathuranath, P. S., Nestor, P. J., Berrios, G. E., Rakowicz, W. ja Hodges, J. R. (2000). Lyhyt kognitiivinen testipatteristo Alzheimerin taudin ja frontotemporaalisen dementian erottamiseksi. Neurology 55, 1613-1620. doi: 10.1212/01.wnl.0000434309.85312.19
PubMed Abstract | CrossRef Full Text | Google Scholar
Mattsson, N., Zetterberg, H., Hansson, O., Andreasen, N., Parnetti, L., Jonsson, M., et al. (2009). CSF-biomarkkerit ja alkava Alzheimerin tauti potilailla, joilla on lievä kognitiivinen heikentyminen. JAMA. 302, 385-393. doi: 10.1001/jama.2009.1064
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, L. K., Fennema-Notestine, C., Roddey, J. C., Hagler, D. J. Jr., Holland, D., et al. (2009). Alzheimerin tauti: kvantitatiivinen rakenteellinen neurokuvantaminen lievän kognitiivisen heikentymisen kliinisten ja rakenteellisten muutosten havaitsemiseksi ja ennustamiseksi. Radiology 251, 195-205. doi: 10.1148/radiol.2511080924
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosconi, L., Perani, D., Sorbi, S., Herholz, K., Nacmias, B., Holthoff, V., et al. (2004). MCI:n muuttuminen dementiaksi ja APOE-genotyyppi: FDG-PET:llä tehty ennustetutkimus. Useat diffuusioindeksit tunnistavat valkean aineen vaurioita lievässä kognitiivisessa heikentymisessä ja Alzheimerin taudissa. PLoS ONE 6:e21745. doi: 10.1371/journal.pone.0021745
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C. (2004). Lievä kognitiivinen heikentyminen diagnostisena kokonaisuutena. J. Intern. Med. 256, 183-194. doi: 10.1111/j.1365-2796.2004.01388.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petersen, R. C., ja Negash, S. (2008). Lievä kognitiivinen heikentyminen: yleiskatsaus. CNS Spectr. 13, 45-53.
PubMed Abstract | Google Scholar
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G. ja Kokmen, E. (1999). Lievä kognitiivinen heikentyminen: kliininen luonnehdinta ja tulokset. Arch. Neurol. 56, 303-308.
PubMed Abstract | Google Scholar
Petersen, R. C., Stevens, J. C., Ganguli, M., Tangalos, E. G., Cummings, J. L. ja DeKosky, S. T. (2001). Käytäntöparametri: dementian varhainen toteaminen: lievä kognitiivinen heikentyminen (näyttöön perustuva katsaus). Amerikan neurologian akatemian laatustandardien alakomitean raportti. Neurology 56, 1133-1142. doi: 10.1212/WNL.56.9.1133
PubMed Abstract | CrossRef Full Text | Google Scholar
REITAN, R. M. (1955). Jäljen tekemisen testin suhde orgaaniseen aivovaurioon. J. Consult. Psychol. 19, 393-394.
PubMed Abstract
Reuter, M., Rosas, H. D., Fischl, B. (2010). Erittäin tarkka käänteinen johdonmukainen rekisteröinti: vankka lähestymistapa. Neuroimage 53, 1181-1196. doi: 10.1016/j.neuroimage.2010.07.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Rey, A. (1958). L’examen Clinique en Psychologie Paris: Presses universitaires de France.
Google Scholar
Segonne, F., Dale, A. M., Busa, E., Glessner, M., Salat, D., Hahn, H. K., et al. (2004). Hybridilähestymistapa kallonpoisto-ongelmaan magneettikuvauksessa. Neuroimage 22, 1060-1075. doi: 10.1016/j.neuroimage.2004.03.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Serra, L., Giulietti, G., Cercignani, M., Spano, B., Torso, M., Castelli, D., et al. (2013). Lievä kognitiivinen heikentyminen: sama identiteetti eri kokonaisuuksille. J. Alzheimers Dis. 33, 1157-1165. doi: 10.3233/JAD-2012-121663
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirály, E., Szabó, Á., Szita, B., Kovács, V., Fodor, Z., Marosi, C., et al. (2015). Vanhusten kognitiivisen heikkenemisen varhaisten merkkien seuranta tietokonepelien avulla: MRI-tutkimus. PLoS ONE 10:e0117918. doi: 10.1371/journal.pone.0117918
PubMed Abstract | CrossRef Full Text | Google Scholar
Siraly, E., Szita, B., Kovács, V., Kovács, V., Csibri, E., Hidasi, Z., Hidasi, Z., Salacz, P., et al. (2013). . Neuropsychopharmacol. Hung. 15, 139-146.
PubMed Abstract | Google Scholar
Spielberger, C., Gorsuch, R. ja Lushene, R. (1970). Manual for the State-Trait Anxiety Inventory Palo Alto, TX: Consulting Psychologist Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (2006a). A Compendium of Neuropsychological Tests, 3rd Edn. New York, NY: Oxford University Press.
Strauss, E., Sherman, E. M. S., and Spreen, O. (eds.). (2006b). ”Mini Mental State Examination (MMSE)”, teoksessa Compendium of Neuropsychological Tests, 3rd Edn. (New York, NY: Oxford University Press), 168-188.
Google Scholar
Tombaugh, T. N. (2004). Trail Making Test A ja B: normatiiviset tiedot iän ja koulutuksen mukaan jaoteltuna. Arch. Clin. Neuropsychol. 19, 203-214. doi: 10.1016/S0887-6177(03)00039-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Vincent, J. L., Snyder, A. Z., Fox, M. D., Shannon, B. J., Andrews, J. R., Raichle, M. E., et al. (2006). Koherentti spontaani aktiivisuus tunnistaa hippokampus-parietaalisen muistiverkon. J. Neurophysiol. 96, 3517-3531. doi: 10.1152/jn.00048.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yesavage, J. A. (1988). Geriatrinen masennusasteikko. Psychopharmacol. Bull. 24, 709-711.
PubMed Abstract | Google Scholar
Zhang, H., Trollor, J. N., Wen, W., Zhu, W., Crawford, J. D., Kochan, N. A., et al. (2011). Tyvitumakkeiden ja hippokampuksen harmaan aineen atrofia lievässä kognitiivisessa heikentymisessä. J. Neurol. Neurosurg. Psychiatry 82, 487-493. doi: 10.1136/jnnp.2010.217133
PubMed Abstract | CrossRef Full Text | Google Scholar